类胡萝卜素代谢及功能研究进展
靳 青 毕宇霖 刘晓牧 万发春*
(1.山东省农业科学院畜牧兽医研究所,济南 250100;2.山东省畜禽疫病防治与繁育重点实验室,济南 250100;3.山东农业大学动物科技学院,泰安 271018)
类胡萝卜素(carotenoids)为进行光合作用的生物产生的亲脂性色素,动物自身不能合成类胡萝卜素。流行病学研究表明,类胡萝卜素可以降低多种癌症、代谢综合征、肥胖、白内障以及黄斑变性等疾病的发病率[1-4]。近年来关于类胡萝卜素的研究重点主要集中于动物体内类胡萝卜素的富集规律和生理功能评价,这些研究有助于通过人工富集的动物组织作为类胡萝卜素源[5]。β-胡萝卜素(β-carotene)和黄体素(lutein)分别为胡萝卜素(carotenes)和类胡萝卜素含氧衍生物——叶黄素(xanthophylls)这两大类类胡萝卜素的典型代表。其中β-胡萝卜素在实际生产中被广泛应用。β-胡萝卜素在欧美等国及日本都已形成市场,世界β-胡萝卜素的年需求量为1 200~1 500 t,美国以每年10%~15%的递增率增长,我国对β-胡萝卜素的需求量也日益增大。类胡萝卜素还有一些潜在的功能未被发掘,其作用机制尚不明确。本文在论述类胡萝卜素的基本特征、吸收和转运的基础上,就类胡萝卜素转化为维生素A的机制以及类胡萝卜素的生物活性功能做一综述,为进一步研究类胡萝卜素在人类健康及动物生产中的应用提供理论基础。
1 类胡萝卜素的种类与特性
类胡萝卜素是一类广泛存在于自然界的有色物质,在动物体内具有多种重要的生物学活性。自然界中类胡萝卜素的种类繁多,已经发现有600多种,其中大部分己知的类胡萝卜素由8个类异戊二烯组成,碳原子数为40的四萜占大多数,但也有碳原子数少于40的类萝卜素,比如β-脱辅基-胡萝卜醛,近期在古细菌中也发现了碳原子数大于40的类胡萝卜素。在所有类胡萝卜素中,有50种可在人类饮食中找到,但只有10种可在人类血清中大量检测到[6]。
类胡萝卜素根据其化学结构可分为胡萝卜素和叶黄素两大类。其中,胡萝卜素为烃类,叶黄素为类胡萝卜素的含氧衍生物,极性比胡萝卜素弱。许多类胡萝卜素具有维生素A原活性,其中以β-胡萝卜素维生素A原活性最高,而番茄红素(lycopene)和叶黄素等则不具有维生素A原活性,称为非维生素A原类胡萝卜素(non-pro-vitamin A carotenoids)。除了少数类胡萝卜素是以游离态呈现,通常大部分天然类胡萝卜素在动物体内是以蛋白质结合物的形式存在。
近年试验研究表明,类胡萝卜素在基因表达、细胞增殖和分化调控、信号传导和细胞间隙连接通讯、机体抗氧化和免疫等方面有重要作用[7]。目前基本都采用反相高效液相色谱法,并配合紫外可见光检测器、质谱或核磁共振或二极管阵列检测器,对样品中的类胡萝卜素进行定性定量分析[8]。
2 类胡萝卜素在动物体组织内的分布、吸收与转运
2.1 分布和吸收
在自然条件下类胡萝卜素是动物体内维生素A的主要来源,其中β-胡萝卜素的维生素A原活性最高[9-10],这主要是因为其具有的对称结构,1分子β-胡萝卜素可以产生2分子的维生素A[9]。类胡萝卜素在人体内主要存在于脂肪组织中,而在动物体内则主要存在于肝脏中,少量分布于脂肪组织、肾脏和皮肤。但陈波等[11]报道,在鸡体内,腹部脂肪中类胡萝卜素含量高于肝脏。不同种类类胡萝卜素在不同种类动物体内的分布不同,Yang等[12]报道,分布在绵羊和山羊的脂肪组织和血清中的类胡萝卜素主要为叶黄素,而在其肝脏中则β-胡萝卜素含量较高,叶黄素不存在;在牛血清和脂肪组织中β-胡萝卜素的含量占主导地位,而且其脂肪组织中叶黄素含量也较高,在其肝脏中β-胡萝卜素含量较低。在动物个体的不同生长阶段类胡萝卜素在其体内的分布也不同。在生长初期,类胡萝卜素主要分布于肝脏、脂肪组织、血液、皮肤及羽毛中,随着性成熟,便逐渐转移到生殖器官如卵巢中。
食物中的类胡萝卜素主要以蛋白质结合物的形式存在,在动物体内经消化酶的作用将其从蛋白质结合物中分离出来,在十二指肠内与其他脂类一起经胆汁乳化后形成乳糜微粒(chylomicrons,CM),随后通过胆固醇转运载体转运或被动扩散吸收[13]。类胡萝卜素在小肠内的吸收代谢机制如图1所示。在上皮细胞内,β-胡萝卜素在β-胡萝卜素-15,15’-加氧酶(β-carotene-15,15’-momoxygenase 1,BCMO1)的催化下被分解为视黄醛(retinaldehyde,RAL),然后RAL被还原为视黄醇(retinol,ROH),或者在视黄醛脱氢酶(retinal dehydrogenase,RALDH)的作用下被氧化为视黄酸(retinoic acid,RA)[14];ROH 在卵磷脂视黄醇酰基转移酶(lecithin-retinol acyltransferase,LRAT)的作用下与Ⅱ型细胞视黄醇结合蛋白(cellular retinol binding protein typeⅡ,CRBP-Ⅱ)结合形成视黄酯(retinyl ester,RE)[15]。RE 被载脂蛋白 B(apolipoprotein B,apoB)包被,经门静脉或淋巴进入血液循环[16]。未降解的β-胡萝卜素随乳糜颗粒进入血液循环,在肝脏内转化为维生素A或进入体内沉积。少量类胡萝卜素可通过被动扩散被小肠吸收[13]。
B类Ⅰ型清道夫受体(scavenger receptor class B typeⅠ,SR-BⅠ)和分化抗原簇36(cluster of differentiation 36,CD36)是类胡萝卜素小肠吸收过程中的2个关键因子。SR-BⅠ位于小肠绒毛黏膜表面,在整个小肠内均表达,但主要负责亲脂性分子在十二指肠内的吸收[18-19]。CD36主要在空肠和回肠内表达,在十二指肠内不表达,对其功能还不完全清楚,可能在β-胡萝卜素向肠上皮细胞的转运[20-21]和长链脂肪酸在肠内的吸收[22-23]方面起重要作用。
由于类胡萝卜素是脂溶性的,极性的差异会影响它们的组织分布以及在脂蛋白之间的重新分配和交换,另外,食物中脂肪的含量,胆酸盐的含量,食物中维生素A的水平,食物中纤维物质的类型、含量及食物中各类胡萝卜素之间的相互作用等都影响类胡萝卜素的吸收和转化,其调控机制尚不明确,有待进一步探索。
2.2 转运
类胡萝卜素在十二指肠内形成乳糜颗粒后,被分泌到肠黏膜细胞,然后排入肠系膜淋巴管,通过胸导管运输到静脉血[24]。在肠淋巴管内,类胡萝卜素和视黄酯相关的乳糜微粒可避开肝脏代谢被肝外组织吸收。在此过程中,乳糜颗粒在脂蛋白脂肪酶(lipoprotein lipase,LPL)的作用下,其中的甘油三酯被水解,形成乳糜颗粒残基(chylomicron remnants,CRs),随后被载脂蛋白 E(apolipoprotein E,apoE)吸收,意味着肝脏清除的完成。
在肝脏内,类胡萝卜素被积累,或作为极低密度脂蛋白(very low density lipoprotein,VLDL)的一部分重新分泌到血液循环。在空腹状态下,血浆中有10%~19%的类胡萝卜素通过VLDL运输,大部分(55%)通过低密度脂蛋白(low-density lipoproteins,LDL)运输,约33%通过高密度脂蛋白(high density lipoprotein,HDL)转运。β-胡萝卜素和番茄红素主要通过LDL和VLDL转运;黄体素和玉米黄素在 LDL和HDL间平均分布[25-26];叶黄素则在不同脂蛋白之间(尤其是LDL和HDL之间)转运,脂溶性类胡萝卜素占据LDL和HDL的核心位置,很少与其他脂蛋白交流,从而阻止了不同脂蛋白之间的相互交换[27](图2)。
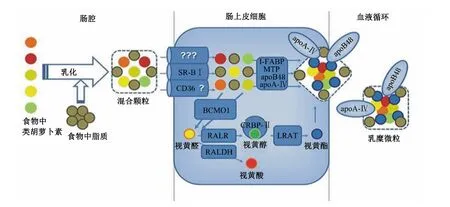
图1 类胡萝卜素在小肠内的吸收代谢机制示意图(仿自Shmarakov等[17])Fig.1 Schematic diagram of absorption and metabolism mechanisms of carotenoids in the intestine(modified from Shmarakov et al[17])

图2 类胡萝卜素在不同脂蛋白间的分布(仿自Shmarakov等[17])Fig.2 Carotenoid distribution among different lipoprotein classes(modified from Shmarakov et al[17])
由于类胡萝卜素的吸收和转运途径与脂肪酸的代谢途径相同,因此,参与吸收与转运过程的蛋白质也会间接影响血液中类胡萝卜素含量,包括apoB和载脂蛋白A-Ⅳ(apolipoprotein A-Ⅳ,apoA-Ⅳ)[28-29]。目前关于类胡萝卜素在动物体内的运输主要通过被动扩散还是选择性吸收,以及分配调控机制均尚无定论,有待进一步深入研究。
3 类胡萝卜素的代谢
吸收后的类胡萝卜素在动物体内的代谢主要有2个酶——BCMO1和 β-胡萝卜素-9’,10’-双加氧脱氢酶(β-carotene-9’,10’-dioxygenase,BCO2)参与,分别以对称裂解和非对称裂解方式将类胡萝卜素裂解。BCMO1位于细胞质内,主要催化作为维生素A原的类胡萝卜素;BCO2位于线粒体内,其具有更广的底物特异性,可催化大多数类胡萝卜素[30]。已有研究表明,BCMO1为动物体内β-胡萝卜素裂解的关键酶,而BCO2的作用则所知有限[17]。
3.1 BCMO1 的作用机制
类胡萝卜素向维生素A转化的主要途径为其对称断裂反应,该反应在BCMO1的催化下完成,使β-胡萝卜素在15,15’双键位置断裂,生成2分子视黄醛,此过程通过3个阶段完成:15,15’双键的环氧化作用、双键的水化开环和二醇形式的氧化断裂[31-32]。
人类BCMO1基因位于第16号染色体上,其在动物界进化过程中是保守的。目前研究人员已经克隆出了人[33]、牛[34]、猪[35]、鼠[36]等多种哺乳动物 以 及 鸡[37]、果 蝇[38]、斑 马 鱼[39-40]、海 洋 细菌[41]等多个物种的 BCMO1 基因。Yan 等[42]首次尝试对人类BCMO1进行分子克隆与定性,但完整的分子克隆最终由 Lindqvist等[33]在 2002年获得。人类BCMO1与小鼠、大鼠、斑马鱼和果蝇中同源酶相比,氨基酸序列相似性分别为85%、84%、67%和22%[43]。该基因在动物的大多数组织和器官中都表达,但差异很大,以肠黏膜细胞中的活性最高[44]。
类胡萝卜素在动物体内可以转变为维生素A,且不会出现因过量摄食而造成维生素A累积中毒的现象。BCMO1活性主要受组织特异性负反馈调节机制调控,此外,在人类和不同物种中也可能受遗传变异的影响而使其活性有所不同。已知BCMO1的调控机制是当机体摄入过多的β-胡萝卜素时,肠上皮细胞中会生成大量RA,RA与视黄酸受体(retionic acid receptor,RAR)结合,激活肠道特异同源框(intestine specific homeobox,ISX),ISX既可以直接抑制BCMO1基因的表达,也可以通过SR-BⅠ间接抑制BCMO1基因的表达[45-46],从而避免产生过多的维生素 A[47](图 3)。Seino等[45]对小鼠进行维生素A缺乏处理时发现,当小鼠维生素A缺乏时,ISX被抑制,进而激活BCMO1基因的表达。动物机体通过上述途径有效调节各组织器官内维生素A的平衡,从而维持正常的生理功能。
作为催化类胡萝卜素对称断裂的酶,BCMO1的活性及其代谢功能为动物体内类胡萝卜素前体向维生素A转化的主要途径,为满足人体对维生素A的需求发挥着重要作用。在体内缺乏维生素A时,BCMO1可通过对外周组织,尤其是对维生素A水平比较敏感的组织内类胡萝卜素的对称断裂来维持维生素A水平的稳定[34]。
3.2 BCO2 的作用机制
除了对称裂解外,研究人员还在哺乳动物、植物和蓝藻中发现β-胡萝卜素能在15,15’以外的双键位置断裂,产生不同链长的β-胡萝卜醛,然后进一步转化为RAL[48]。催化这种反应的1个最主要的酶就是 BCO2,它可使β-胡萝卜素在9’,10’之间的双键断裂,生成β-胡萝卜醛和β-紫罗酮[49-50]。当BCO2催化β-胡萝卜素分解时,需要Fe2+作为必要的辅助因子,产生1分子的β-阿朴-10’-胡萝卜醛和 1分子的 β-紫罗酮。BCO2与BCMO1在氨基酸序列上有40%的相似性,其表达部位也大都相同,但BCO2对底物的识别范围更广[51]。对BCO2的免疫组织化学分析表明,在BCMO1表达的细胞类型中BCO2同样表达,包括小肠和胃黏膜上皮细胞、肝实质细胞、睾丸间质和睾丸支持细胞、肾小管、肾上腺、外分泌胰腺以及眼睛视网膜色素上皮细胞和睫状体上皮细胞,除上述细胞类型外,BCO2还可在心脏和骨骼肌细胞、前列腺和子宫内膜结缔组织以及内分泌胰腺中特异表达[51]。
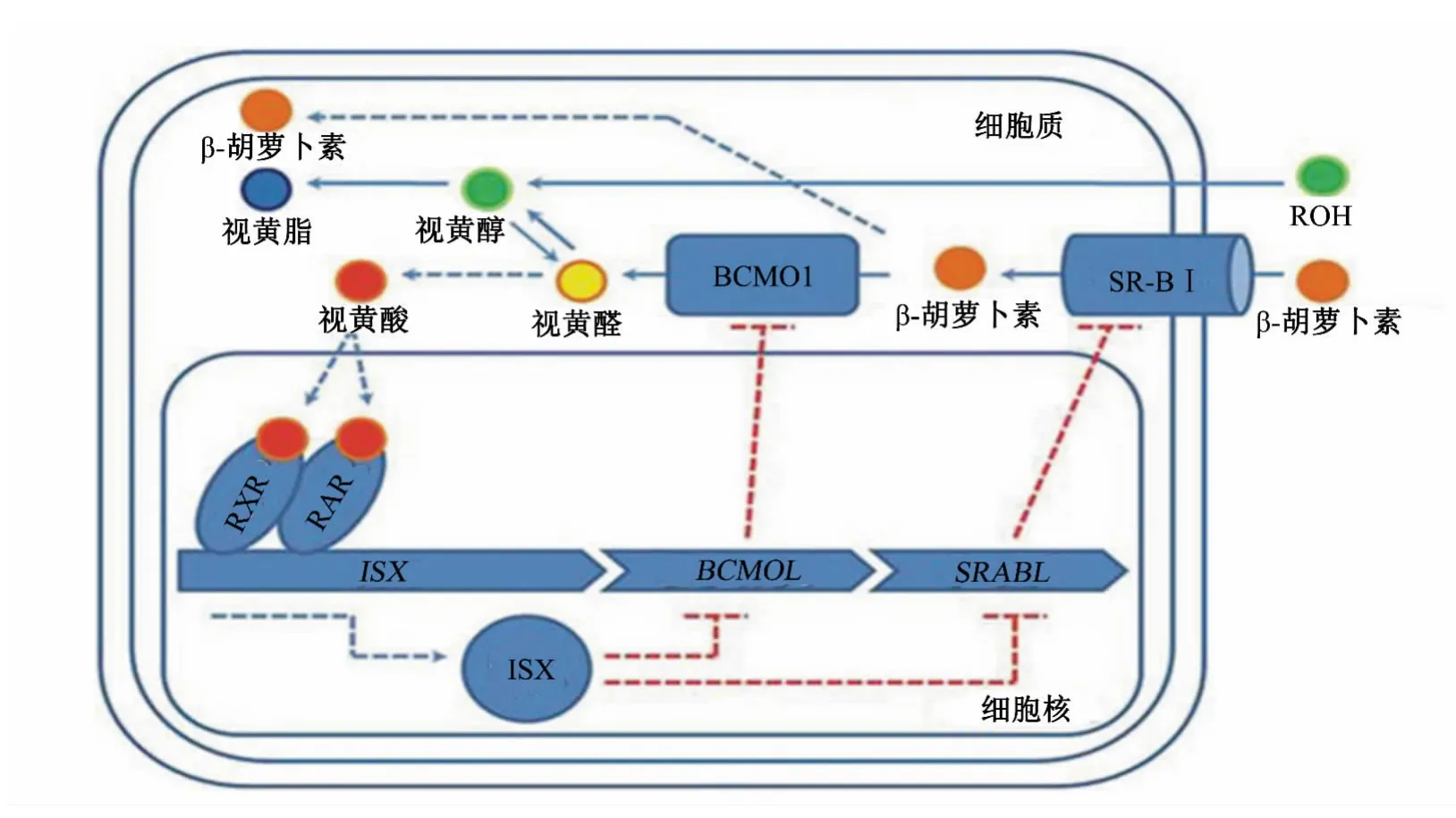
图3 β-胡萝卜素在小肠内吸收和代谢的负反馈调节机制(仿自Shmarakov等[17])Fig.3 Negative feedback regulatory mechanism ofβ-carotene absorption and metabolism in the intestine(modified from Shmarakov et al[17])
Amengual等[30]研究发现,BCO2 是一种线粒体类胡萝卜素氧化酶,与BCMO1相比,可催化更多的底物,它既可催化胡萝卜素,也可催化叶黄素;对脊椎动物中BCO2的底物识别研究表明,中央多烯链骨架和紫罗酮环对底物特异性均发挥着重要作用。Hu等[52]以重组雪貂BCO2作为类胡萝卜素代谢模型的研究表明,BCO2可催化全反式β-胡萝卜素和番茄红素的5-顺式和13-顺式异构体。酶动力学分析表明,BCO2对玉米黄质和黄体素的催化活性要比对β-玉米黄质高,与β-胡萝卜素相比,其对番茄红素的顺式异构体的催化活性更高[30,52-53]。
关于类胡萝卜素非对称裂解的生理重要性及BCO2基因的表达调控仍所知甚少。原认为BCO2基因的主要功能是增加β-胡萝卜素向维生素A的转化,但研究发现BCO2基因的缺失不会影响维生素A的合成[27],只有BCMO1基因缺失才会阻碍维生素 A 的生成[12,14,30]。Luvizotto 等[54]研究表明,与BCMO1基因相比,BCO2基因的表达几乎不受维生素A的影响。Ziouzenkova等[55]研究发现,BCO2催化的产物能够影响维甲酸类X受体 α(retinoid X receptorα,RXRα)和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activatereceptorγ,PPARγ)的转录活性和生物学反应,表明PPARγ可能具有潜在的调节BCO2基因表达的功能。
4 类胡萝卜素的生物活性功能
类胡萝卜素做为动物机体必需的一种营养素,它以不同方式几乎影响机体的一切组织细胞。以其自身功能及作为动物体内维生素A的主要来源,在人类健康及动物养殖业中均发挥着重要的作用。现就其维生素A原活性、抗氧化促氧化性、对动物繁殖的影响、对机体免疫力的影响、着色功能以及抗癌功能进行概述。
4.1 维生素A原活性
许多类胡萝卜素分子一端具有β2酮芷环,且其侧链长不少于11个碳原子,它们均具有维生素A原活性,其中以β-胡萝卜素的维生素A原活性最高。类胡萝卜素具有顺式和反式2种构型,其中以顺式构型的类胡萝卜素的维生素A原活性最高。能将具有维生素A原活性的类胡萝卜素转化成 RAL 的 关 键 酶 为 BCMO1[37]。Anthony[56]指出,维生素A缺乏症会引起角膜上皮的脱落、增厚和角质化,使原来透明的角膜变成不透明,造成角膜溃疡,晶体脱落以致失明,轻者会发生夜盲;还会损害上皮组织细胞的生长与分化,使人的皮肤变厚、干燥,痂变或产生皱纹。维生素A缺乏时,也会导致生殖能力丧失。缺乏维生素A的婴幼儿易引起肺炎、麻疹以及腹泻等传染病,严重时会造成死亡。服用适量维生素A可以消除或缓解上述症状,但如果超量摄入,可导致中毒。具有维生素A原活性的类胡萝卜素既可治疗维生素A缺乏症,又不会因服用剂量过大造成维生素A中毒,为维生素A最安全的来源。
4.2 抗氧化/促氧化性
研究发现,活性氧自由基可与DNA、蛋白质、脂类发生反应,抑制它们的生理功能,从而引发癌症、动脉硬化等慢性疾病。类胡萝卜素分子结构含有多个共轭双键,具有捕捉、淬灭自由基和单线态氧的功能,从而减少自由基对细胞的损伤,组织光氧化和脂质氧化与自由基反应生成无毒物质,或中断自由基的连锁反应来清除体内的自由基[57]。1分子β-胡萝卜素可抑制1 000分子的活性氧[58]。类胡萝卜素还可与α-生育酚(维生素E)合用,协同产生抗氧化作用[59]。此外,类胡萝卜素还可显著降低过氧化氢诱发的DNA损伤[60]。Krinsky[61]研究发现,类胡萝卜素捕捉和淬灭自由基和单线氧的能力与其分子中共轭双键的数量有关,共轭双键数量越多,能力越强。β-胡萝卜素可拮抗阿霉素对大鼠心肌组织含锰超氧化物歧化酶信使RNA(Mn-SOD mRNA)、含铜锌超氧化物歧化酶信使RNA(Cu,Zn-SOD mRNA)和谷胱甘肽过氧化物酶信使RNA(GPx mRNA)造成的表达降低,从而拮抗阿霉素所导致的Mn-SOD、Cu,Zn-SOD 和 GPx 活性降低[62]。
类胡萝卜素在氧化方面具有双重作用,研究表明其还有促氧化的作用。类胡萝卜素表现为抗氧化还是促氧化可能依赖于氧压的大小和类胡萝卜素的浓度。Zhang等[63]研究表明,低氧条件下β-胡萝卜素产生了浓度依赖性的抗氧化作用;但在高氧压条件下,β-胡萝卜素表现出了促氧化的作用。高剂量的β-胡萝卜素可能会与石棉接触人群及吸烟者肺内大量的自由基发生反应形成氧化产物,使β-胡萝卜素变成促氧化剂,从而诱导DNA损伤,引起癌变,进而增加了这类人群的肺癌患病率[64]。而在小鼠和大鼠体内,β-胡萝卜素可以拮抗香烟烟气所诱导的脂质过氧化作用[65]。但哺乳动物体内的氧分压较低,类胡萝卜素是其较为有效的一种抗氧化剂。
4.3 对动物繁殖的影响
大量试验表明,在饲料中添加β-胡萝卜素可提高动物的繁殖能力。动物体内缺乏β-胡萝卜素会导致黄体细胞和孕酮分泌减少,这一现象可通过补充β-胡萝卜素而得到改善,但增加维生素A的补充量却不能达到同样的效果,β-胡萝卜素的繁殖重要性超过维生素A,因为注射β-胡萝卜素能增加子宫内某些特殊蛋白质的合成。血浆中β-胡萝卜素水平与黄体的直径和重量呈正相关,血浆、卵泡中β-胡萝卜素水平与血浆孕酮水平呈正相关,而且血浆、卵泡、黄体中β-胡萝卜素水平受发情周期、怀孕情况以及黄体功能的影响,但与维生素A水平无关[66]。此外,β-胡萝卜素还与雌激素和黄体素的合成有关,并改善受胎率及缩短离乳至首次发情间隔[67]。
β-胡萝卜素对动物繁殖的特殊作用是因为维生素A不能直接进入卵泡和黄体,即使血液中维生素A的水平很高,卵泡中依然缺乏维生素A,而β-胡萝卜素能直接进入卵泡和黄体细胞中,当卵泡中维生素A水平较低时,补充β-胡萝卜素可提高卵泡中维生素A水平,一方面,β-胡萝卜素在卵泡和黄体细胞内转化为维生素A,另一方面,β-胡萝卜素作为细胞膜和细胞器的组成成分,通过其单独或相互关联的细胞活动来控制细胞功能:1)利用β-胡萝卜素优良的抗氧化性,保护卵泡(黄体)和子宫细胞免受自由基的损伤,从而保护重要的细胞器,有助于维持卵巢细胞生成类固醇的机能,使子宫功能达到最佳水平。2)利用β-胡萝卜素来形成维生素A,使卵泡中维生素A水平更高,有利于RA的形成,促进粒细胞中雌激素的生物合成。3)促进黄体酮的合成。进入黄体中的β-胡萝卜素能与黄体细胞的微粒体牢固结合,从而激发黄体酮的合成[66]。
4.4 对机体免疫力的影响
类胡萝卜素可提高机体体液免疫、细胞免疫和非特异性免疫反应,增强动物的抵抗力。在饲料中添加β-胡萝卜素可以使血浆溶菌酶的活性增加[68]。Chew 等[69]发现 β-胡萝卜素可刺激大鼠、牛和猪淋巴细胞的增殖。虾青素、斑蝥黄、叶黄素和β-胡萝卜素有刺激动物体内免疫应答反应、抑制肿瘤生长的作用,叶黄素可以阻止肿瘤相关的淋巴细胞亚群的改变,影响B细胞的增殖分化、抗体的产生和T细胞亚群比例[70]。虾青素和叶黄素可以增加小鼠离体脾细胞对T细胞抗原的抗体应答反应[70]。研究表明,小鼠胎儿免疫系统的发育需要母鼠类胡萝卜素刺激[71]。类胡萝卜素可能与禽类胚胎形成过程中法氏囊B细胞的发育和出生后法氏囊中存在的大量类胡萝卜素有关[71]。在人类研究方面,在食物中添加β-胡萝卜素可以有效地增加辅助性T细胞和T淋巴细的数量,增强自然杀伤细胞的活性[72]。
4.5 着色功能
类胡萝卜素是一种有效的天然着色剂,因分子中特殊的共轭结构使之具有良好的着色功能,着色范围是黄色、橙红,着色力强,色泽稳定均匀,能与钾、锌、钙等元素并存而不变色。胡萝卜素在体内主要作为维生素A原起营养代谢的作用,而叶黄素则主要作为色素具有着色功能[73],同时胡萝卜素也有一定的着色功能。β-胡萝卜素在我国是允许使用的8种饲料着色剂之一,饲料中合理添加类胡萝卜素不仅可满足人们的审美观,对动物和人都有一定的保健功能。
4.6 抗癌功能
类胡萝卜素,尤其是β-胡萝卜素具有抑制肿瘤细胞生长的作用,该作用主要通过改变细胞生长模式来抑制细胞生长,诱导细胞凋亡来实现。Schwartz等[74]研究表明,在体外培养的人鳞状细胞中添加70μmol/L的β-胡萝卜素可抑制细胞的增殖;进一步分析发现,其发挥抑制作用的同时伴随着一种类似于热休克蛋白的7 ku的蛋白质的迅速表达。β-胡萝卜素抑制细胞生长的分子机制在人成纤维细胞上也有报道,研究表明,β-胡萝卜素可以抑制细胞周期蛋白D1相关cdk4激酶(cyclin D1-associated cdk4 kinase)活性,同时降低超磷酸化视网膜细胞瘤蛋白水平[75]。
越来越多的研究显示,β-胡萝卜素具有潜在的诱导癌细胞凋亡的功能。例如,在人结肠癌细胞中添加10μmol/Lβ-胡萝卜素可引起染色质凝聚[76],β-胡萝卜素还可诱导结肠癌细胞和白血病细胞凋亡[77-78]。值得注意的是,在体外试验中β-胡萝卜素诱导细胞凋亡所需浓度(2~20μmol/L)比正常人血清中β-胡萝卜素浓度要高,但人体可通过补充大剂量类胡萝卜素来提高血清中β-胡萝卜素的浓度[79-80]。Nierenberg 等[79]研究表明,人体补充50 mg/dβ-胡萝卜素,可使血清中类胡萝卜素的浓度提高到 16.1 μmol/L。Prince等[80]研究显示,人体摄入不同剂量的β-胡萝卜素(51~102 mg/d),可使血清中类胡萝卜素的浓度稳定在2.0~13.2 μmol/L。β-胡萝卜素诱导癌细胞凋亡可能是通过其潜在的调节半胱天冬酶级联反应活性来实现的,具体调控网络有待进一步研究。
除上述功能外,类胡萝卜素还在延缓衰老、预防心血管疾病以及防治白内障、关节炎、糖尿病、肾小球炎、肝炎、肝硬化等慢性疾病方面具有一定的功效。
5 小结
类胡萝卜素作为维生素A原,除了能满足机体的维生素A需求、预防维生素A缺乏症外,还在对维护人类健康、预防疾病、提高机体免疫力、维持畜禽正常生长与繁殖以及着色等方面发挥着重要的作用。近年来,有关类胡萝卜素吸收、转运及代谢机理方面的研究日益增多,也取得了明显进展,但仍有不少问题有待进一步深入研究与探索,如类胡萝卜素在动物体内的吸收及转运途径,维生素A的生成、调控及作用机理,BCO2基因的调控模式及主要功能等。此外,类胡萝卜素潜在的生物活性功能也有待进一步发掘与深入研究。
致谢:
感谢山东省农业科学院畜牧兽医研究所刘桂芬博士对文稿所提的宝贵意见。
[1] RICCIONI G,D’ORAZIO N,SPERANZA L,et al.Carotenoids and asymptomatic carotid atherosclerosis[J].Journal of Biological Regulators and Homeostatic Agents,2010,24(4):447-452.
[2] VILLAÇA CHAVESG,GONÇALVES DE SOUZA G,CARDOSO DE MATOS A,et al.Serum retinol and βcarotene levels and risk factors for cardiovascular disease in morbid obesity[J].International Journal for Vitamin and Nutrition Research,2010,80(3):159-167.
[3] WEGNER A,KHORAMNIA R.Cataract is a self-defence reaction to protect the retina from oxidative damage[J].Medical Hypotheses,2011,76(5):741-744.
[4] ZHOU H Y,ZHAO X F,JOHNSON E J,et al.Serum carotenoids and risk of age-related macular degeneration in a Chinese population sample[J].Investigative Ophthalmology and Visual Science,2011,52(7):4338-4344.
[5] SAHINA N,AKDEMIR F,ORHAN C,et al.Lycopeneenriched quail egg as functional food for humans[J].Food Research International,2008,41(3):295-300.
[6] PAETAU I,KHACHIK F,BROWN E D,et al.Chronic ingestion of lycopene-rich tomato juice or lycopene supplements significantly increases plasma concentrations of lycopene and related tomato carotenoids in humans[J].The American Journal of Clinical Nutrition,1998,68(6):1187-1195.
[7] KARADAS F,PAPPAS A C,SURAI P F,et al.Embryonic development within carotenoid-enriched eggs influences the post-hatch carotenoid status of the chicken[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2005,141(2):244-251.
[8] INBARAJ B S,LU H,HUNG C F,et al.Determination of carotenoids and their esters in fruits of Lycium barbarum Linnaeus by HPLC-DAD-APCI-MS[J].Journal of Pharmaceutical and Biomedical Analysis,2008,47(4/5):812-818.
[9] WEBER D,GRUNE T.The contribution ofβ-carotene to vitamin A supply of humans[J].Molecular Nutrition & Food Research,2012,56(2):251-258.
[10] DONHOWE E G,KONG F.Beta-carotene:digestion,microencapsulation,and in vitro bioavailability[J].Food and Bioprocess Technology,2014,7(2):338-354.
[11] 陈波,江祖旭,刘清,等.不同来源的类胡萝卜素在鸡体组织中的沉积[J].中国家禽,1997(11):7-8.
[12] YANG A,LARSEN T W,TUME R K.Carotenoid and retinol concentrations in serum,adipose tissue and liver and carotenoid transport in sheep,goats and cattle[J].Australian Journal of Agricultural Research,1992,43(8):1809-1817.
[13] YONEKURA L,NAGAO A.Intestinal absorption of dietary carotenoids[J].Molecular Nutrition & Food Research,2007,51(1):107-115.
[14] FIERCE Y,DE MORAIS VIEIRA M,PIANTEDOSI R,et al.In vitro and in vivo characterization of retinoid synthesis from β-carotene[J].Archives of Biochemistry and Biophysics,2008,472(2):126-138.
[15] HERR F M,WARDLAW S A,KAKKAD B,et al.Intestinal vitamin A metabolism:coordinate distribution of enzymes and CRBP(Ⅱ)[J].Journal of Lipid Research,1993,34(9):1545-1554.
[16] IQBAL J,HUSSAIN M M.Intestinal lipid absorption[J].American Journal of Physiology.Endocrinology and Metabolism,2009,296(6):E1183-E1194.
[17] SHMARAKOV I O,YUEN J J,BLANER W S.Carotenoid metabolism and enzymology[M]//TANUMIHARDJO S A.Carotenoids and human health.Nutrition and health.New York:Humana Press,2013:29-56.
[18] REBOUL E,ABOU L,MIKAIL C,et al.Lutein transport by Caco-2 TC-7 cells occurs partly by a facilitated process involving the scavenger receptor class B typeⅠ (SR-BⅠ)[J].The Biochemical Journal,2005,387(Pt 2):455-461.
[19] MOUSSA M,LANDRIER JF,REBOUL E,et al.Lycopene absorption in human intestinal cells and in mice involves scavenger receptor class B typeⅠbut not Niemann-Pick C1-like 1[J].The Journal of Nutrition,2008,138(8):1432-1436.
[20] NICOLLE C,CARDINAULT N,APRIKIAN O,et al.Effect of carrot intake on cholesterol metabolism and on antioxidant status in cholesterol-fed rat[J].European Journal of Nutrition,2003,42(5):254-261.
[21] RICHELLE M,ENSLEN M,HAGER C,et al.Both free and esterified plant sterols reduce cholesterol absorption and the bioavailability ofβ-carotene andα-tocopherol in normocholesterolemic humans[J].The A-merican Journal of Clinical Nutrition,2004,80(1):171-177.
[22] DROVER V A,AJMAL M,NASSIR F,et al.CD36 deficiency impairs intestinal lipid secretion and clearance of chylomicrons from the blood[J].The Journal of Clinical Investigation,2005,115(5):1290-1297.
[23] DROVER V A,NGUYEN D V,BASTIE C C,et al.CD36 mediates both cellular uptake of very long chain fatty acids and their intestinal absorption in mice[J].The Journal of Biological Chemistry,2008,283(19):13108-13115.
[24] O’DRISCOLL C M.Anatomy and physiology of the lymphatics[M]//CHARMAN W N,STELLA V J.Lymphatic transport of drugs.Boca Raton,FL:CRC Press,1992:1-35.
[25] CLEVIDENCE B A,BIERI JG.Association of carotenoids with human plasma lipoproteins[J].Methods in Enzymology,1993,214:33-46.
[26] KRINSKY N I,JOHNSON E J.Carotenoid actions and their relation to health and disease[J].Molecular Aspects of Medicine,2005,26(6):459-516.
[27] TYSSANDIER V,CHOUBERT G,GROLIER P,et al.Carotenoids,mostly the xanthophylls,exchange between plasma lipoproteins[J].International Journal for Vitamin and Nutrition Research,2002,72(5):300-308.
[28] BOREL P,MOUSSA M,REBOUL E,et al.Human plasma levels of vitamin E and carotenoids are associated with genetic polymorphisms in genes involved in lipid metabolism[J].The Journal of Nutrition,2007,137(12):2653-2659.
[29] BOREL P,MOUSSA M,REBOUL E,et al.Human fasting plasma concentrations of vitamin E and carotenoids,and their association with genetic variants in apo C-Ⅲ,cholesteryl ester transfer protein,hepatic lipase,intestinal fatty acid binding protein and microsomal triacylglycerol transfer protein[J].British Journal of Nutrition,2009,101(5):680-687.
[30] AMENGUAL J,LOBO G P,GOLCZAK M,et al.A mitochondrial enzyme degrades carotenoids and protects against oxidative stress[J].The FASEB Journal,2011,25(3):948-959.
[31] LEUENBERGER M G,ENGELOCH-JARRET C,WOGGON W D.The reaction mechanism of the enzyme-catalyzed central cleavage ofβ-carotene to retinal[J].Angewandte Chemie International Edition,2001,40(14):2613-2617.
[32] KLOER D P,SCHULZ G E.Structural and biological aspects of carotenoid cleavage[J].Cellular and Molecular Life Sciences,2006,63(19/20):2291-2303.
[33] LINDQVIST A,ANDERSSON S.Biochemical properties of purified recombinant human beta-carotene 15,15’-monooxygenase[J].The Journal of Biological Chemistry,2002,277(26):23942-23948.
[34] MORALESA,ROSAS A,GONZÁLEZ A,et al.Cloning of the bovine β-carotene-15,15’oxygenase and expression in gonadal tissues[J].International Journal for Vitamin and Nutrition Research,2006,76(1):9-17.
[35] NAGAO A,DURING A,HOSHINO C,et al.Stoichiometric conversion of all trans-β-carotene to retinal by pig intestinal extract[J].Archives of Biochemistry and Biophysics,1996,328(1):57-63.
[36] BARUA A B,OLSON J A.β-carotene is converted primarily to retinoids in rats in vivo[J].The Journal of Nutrition,2000,130(8):1996-2001.
[37] WYSS A.Carotene oxygenases:a new family of double bond cleavage enzymes[J].The Journal of Nutrition,2004,134(1):246S-250S.
[38] VON LINTIG J,VOGT K.Filling the gap in vitamin A research.Molecular identification of an enzyme cleaving beta-carotene to retinal[J].The Journal of Biological Chemistry,2000,275(16):11915-11920.
[39] LAMPERT J M,HOLZSCHUH J,HESSEL S,et al.Provitamin A conversion to retinal via the β,β-carotene-15,15’-oxygenase(bcox)is essential for pattern formation and differentiation during zebrafish embryogenesis[J].Development,2003,130(10):2173-2186.
[40] BIEHLMAIER O,LAMPERT J M,VON LINTIG J,et al.Photoreceptor morphology is severely affected in the β,β-carotene-15,15’-oxygenase(bcox)zebrafish morphant[J].European Journal of Neuroscience,2005,21(1):59-68.
[41] KIM Y S,KIM N H,YEOM SJ,et al.In vitro characterization of a recombinant Blh protein from an uncultured marine bacterium as a beta-carotene 15,15’-dioxygenase[J].The Journal of Biological Chemistry,2009,284(23):15781-15793.
[42] YAN W,JANG G F,HAESELEER F,et al.Cloning and characterization of a human beta,beta-carotene-15,15’-dioxygenase that is highly expressed in the retinal pigment epithelium[J].Genomics,2001,72(2):193-202.
[43] VON LINTIG J.Colors with functions:elucidating the biochemical and molecular basis of carotenoid metabolism[J].Annual Review of Nutrition,2010,30:35-56.
[44] DURING A,NAGAO A,HOSHINO C,et al.Assay of β-carotene 15,15’-dioxygenase activity by reversephase high-pressure liquid chromatography[J].Analytical Biochemistry,1996,241(2):199-205.
[45] SEINO Y,MIKI T,KIYONARI H,et al.ISX participates in the maintenance of vitamin A metabolism by regulation of beta-carotene 15,15’-monooxygenase(Bcmo1)expression[J].The Journal of Biological Chemistry,2008,283(8):4905-4911.
[46] LOBO G P,HESSEL S,EICHINGER A,et al.ISX is a retinoic acid-sensitive gatekeeper that controls intestinal β,β-carotene absorption and vitamin A production[J].The FASEB Journal,2010,24(6):1656-1666.
[47] LIETZ G,LANGE J,RIMBACH G.Molecular and dietary regulation of β,β-carotene 15,15’-monooxygenase 1(BCMO1)[J].Archives of Biochemistry and Biophysics,2010,502(1):8-16.
[48] SCHERZINGER D,AL-BABILI S.In vitro characterization of a carotenoid cleavage dioxygenase from Nostoc sp.PCC 7120 reveals a novel cleavage pattern,cytosolic localization and induction by highlight[J].Molecular Microbiology,2008,69(1):231-244.
[49] KIEFER C,HESSEL S,LAMPERT J M,et al.Identification and characterization of a mammalian enzyme catalyzing the asymmetric oxidative cleavage of provitamin A[J].The Journal of Biological Chemistry,2001,276(17):14110-14116.
[50] POLIAKOV E,GENTLEMAN S,CHANDER P,et al.Biochemical evidence for the tyrosine involvement in cationic intermediate stabilization in mouseβ-carotene 15,15’-monooxygenase[J].BMC Biochemistry,2009,10:31.
[51] LINDQVIST A,HE Y G,ANDERSSON S.Cell typespecific expression ofβ-carotene 9’,10’-monooxygenase in human tissues[J].Journal of Histochemistry& Cytochemistry,2005,53(11):1403-1412.
[52] HU K Q,LIU C,ERNST H,et al.The biochemical characterization of ferret carotene-9’,10’-monooxygenase catalyzing cleavage of carotenoids in vitro and in vivo[J].The Journal of Biological Chemistry,2006,281(28):19327-19338.
[53] MEIN J R,DOLNIKOWSKI G G,ERNST H,et al.Enzymatic formation of apo-carotenoids from the xanthophyll carotenoids lutein,zeaxanthin and β-cryptoxanthin by ferret carotene-9’,10’-monooxygenase[J].Archives of Biochemistry and Biophysics,2011,506(1):109-121.
[54] LUVIZOTTO R A M,NASCIMENTO A F,VEERAMACHANENI S,et al.Chronic alcohol intake upregulates hepatic expression of carotenoid cleavage enzymes and PPAR in rats[J].The Journal of Nutrition,2010,140(10):1808-1814.
[55] ZIOUZENKOVA O,ORASANU G,SHARLACH M,et al.Retinaldehyde represses adipogenesis and diet-induced obesity[J].Nature Medicine,2007,13(6):695-702.
[56] ANTHONY T D.Fat soluble vitamins,their biochemistry and application[M].Trowbridge:Redwood Burn Ltd.,1985:1-61.
[57] BIARD C,HARDY C,MOTREUIL S,et al.Dynamics of PHA-induced immune response and plasma carotenoids in birds:should we have a closer look?[J].The Journal of Experimental Biology,2009,212(9):1336-1343.
[58] OLSON J A.Molecular actions of carotenoids[M]//CANFIELD L M.Carotenoids in human health.New York:Academy of Sciences,1993:156-166.
[59] 陈波.不同来源的类胡萝卜素在动物机体内的沉积[J].中国家禽,1997(11):7-8.
[60] 马爱国.抗氧化营养素对DNA损伤的保护作用[J].青岛医学院学报,1996,32(2):95-97.
[61] KRINSKY N I.Effects of carotenoids in cellular and animal systems[J].The American Journal of Clinical Nutrition,1991,53(1):238S-246S.
[62] 阳冠明,孙胜涛,李树全,等.β-胡萝卜素对阿霉素致大鼠心肌组织的超氧化物歧化酶、谷胱甘肽过氧化物酶mRNA表达改变的影响[J].中国药理学通报,2006,22(4):465-470.
[63] ZHANG P,OMAYE S T.Antioxidant and prooxidant roles forβ-carotene,α-tocopherol and ascorbic acid in human lung cells[J].Toxicology in Vitro,2001,15(1):13-24.
[64] 胡春艳,浦跃朴,尹立红,等.β-胡萝卜素对香烟烟气诱导脂质过氧化的交互作用[J].卫生研究,2004,33(2):144-146.
[65] 江志琴,朱心强.高剂量β-胡萝卜素对大量吸烟者肺癌的不利影响及其作用机制[J].国外医学:卫生学分册,2005,32(5):265-269.
[66] WANG JY,LARSON L L,OWEN F G.Effect of beta-carotene supplementation on reproductive performance of dairy heifers[J].Theriogenology,1982,18(4):461-473.
[67] TALAVERA F,CHEW B P.Comparative role of retinol,retinoie acid and beta-carotene on progesterone secretion by pig corpus leteum in vitro[J].Journal of Reproduction and Fertility,1988,82:611.
[68] AMAR E C,KIRON V,SATOH S,et al.Enhancement of innate immunity in rainbow trout(Oncorhynchus mykiss Walbaum)associated with dietary intake of carotenoids from natural products[J].Fish & Shellfish Immunology,2004,16(4):527-537.
[69] CHEW B P,PARK J S.Carotenoid action on the immune response[J].The Journal of Nutrition,2004,134(1):257S-261S.
[70] KOUTSOS E A,GARCÍA LÓPEZ J C,KLASING K C.Carotenoids from in ovo or dietary sources blunt systemic indices of the inflammatory response in growing chicks(Gallus gallus domesticus)[J].The Journal of Nutrition,2006,136(4):1027-1031.
[71] GARCIA A L,RÜHL R,HERZ U,et al.Retinoid-and carotenoid-enriched diets influence the ontogenesis of the immune system in mice[J].Immunology,2003,110(2):180-187.
[72] MCDEVITT T M,TCHAO R,HARRISON E H,et al.Carotenoids normally present in serum inhibit proliferation and induce differentiation of a human monocyte/macrophage cell line(U937)[J].The Journal of Nutrition,2005,135(2):160-164.
[73] 周利梅,周光宏.类胡萝卜素在动物营养中的研究进展[J].粮食与饲料工业,2001(2):39-41.
[74] SCHWARTZ J L,SINGH R P,TEICHER B,et al.Induction of a 70kD protein associated with the selective cytotoxicity of beta-carotene in human epidermal carcinoma[J].Biochemical and Biophysical Research Communications,1990,169(3):941-946.
[75] STIVALA L A,SAVIO M,QUARTA S,et al.The antiproliferative effect ofβ-carotene requires p21waf1/cip1in normal human fibroblasts[J].European Journal of Biochemistry,2000,267(8):2290-2296.
[76] MUTO Y,FUJII J,SHIDOJI Y,et al.Growth retardation in human cervical dysplasia-derived cell lines by β-carotene through down-regulation of epidermal growth factor receptor[J].The American Journal of Clinical Nutrition,1995,62(Suppl.6):1535S-1540S.
[77] PALOZZA P,SERINI S,MAGGIANO N,et al.Induction of cell cycle arrest and apoptosis in human colon adenocarcinoma cell lines by β-carotene through down-regulation of cyclin A and Bcl-2 family proteins[J].Carcinogenesis,2002,23(1):11-18.
[78] PALOZZA P,SERINI S,TORSELLO A,et al.Regulation of cell cycle progression and apoptosis byβ-carotene in undifferentiated and differentiated HL-60 leukemia cells:possible involvement of a redox mechanism[J].International Journal of Cancer,2002,97(5):593-600.
[79] NIERENBERG D W,STUKEL T A,BARON J A,et al.Determinants of increase in plasma concentration of beta-carotene after chronic oral supplementation[J].The American Journal of Clinical Nutrition,1991,53(6):1443-1449.
[80] PRINCE M R,FRISOLI J K.Beta-carotene accumulation in serum and skin[J].The American Journal of Clinical Nutrition,1993,57(2):175-181.

