去神经支配对鼠后肢缺血诱导的侧支血管管壁激活的影响
罗明英 邹智荣 范 艳 陈媛丽 刘承杏 蔡维君
(1昆明医科大学人体解剖与组织胚胎学系,云南650500;2中南大学湘雅医学院组织胚胎学系,长沙410003)
侧支血管的生长是由原有的微小动脉发育成较大的具有导血功能的动脉血管的过程,能使血管的直径增加20倍,体积增加50倍[1]。侧支血管的重塑需要侧支血管管壁各层结构的激活,以保证侧支血管的正常生长发育。如果侧支血管管壁的重塑出现异常,则会导致异常的侧支血管生长。激活侧支血管管壁重塑的因素有许多,包括血流切应力、炎症细胞和基质金属蛋白酶等[2,3]。在以前的研究中我们观察到去除神经支配后,侧支血管的生长异常,主要表现为血管管壁过度增生,血管管腔狭窄,侧支血管数目减少的一种内向性生长方式[4]。但造成侧支血管异常生长竟是否是由于去神经支配后影响了侧支血管生长过程中血管壁激活的某些因素仍不清楚。本实验采用大鼠后肢股动脉结扎结合坐骨神经和股神经切除诱导侧支血管生长模型,结合共聚焦免疫荧光术,观察去除神经支配后对大鼠后肢股动脉结扎诱导的侧支血管壁激活的影响,从而阐明去神经支配后侧支血管内向性生长的可能影响因素。
材料和方法
1.动物模型
健康成年SD大鼠26只(中南大学湘雅医学院实验动物学部提供),雌雄不限,体重200-220g,10%水合氯醛溶液(0.4μl/kg)腹腔注射麻醉,无菌条件下右下肢股后部纵切口约3cm,梨状肌下暴露并切断坐骨神经,断端埋入邻近肌肉,术后消毒缝合皮肤,给予抗生素治疗。存活1w后,对动物重新麻醉,暴露并分离双侧股动脉,在右侧股深动脉发出处用苯酚将股深动脉上的神经损毁,同时在股深动脉的稍下方采用双结扎法结扎股动脉,然后再切断股神经,左侧行单纯股动脉结扎。
2.取材,切片
分别存活1w和8w,动物麻醉后快速取下双侧带有侧支血管的股薄肌,置液氮冷冻,OCT复合物进行包埋处理,-80℃保存待用,用作免疫荧光组织化学染色。
3.免疫荧光染色
三顿冰冻切片机连续切片,片厚10μm,4%多聚甲醛固定15min,组织切片用1%BSA封闭,封闭后分别加入Vimentin(mouse,1∶600)、CD11b(mouse,1∶100)、MMP-2(rabbit,1∶200)的一抗,湿盒中4℃冰箱过夜,然后依据一抗的种属分别加入生物素化的抗鼠、抗兔的二抗(1∶200),室温孵育2h,最后加入链霉素-卵白素化Cy3(1∶400)和偶联Rodamin的α-SM actin(1∶500)进行双标,室温孵育50min,其中除1%BSA孵育30min之外,其余各步均需用0.01mol/L PBS洗3次,每次10min。防荧光淬灭剂封片,Nikon激光共聚焦显微镜下拍片。
用5%BSA代替一抗作为阴性对照,排除二抗的非特异性染色。
4.定量分析
Nikon共聚焦显微镜下摄片后,采用EZ-C1 3.70FreeViewer图像分析软件分别对单纯结扎侧和结扎加去神经侧的Vimentin、CD11b和MMP-2的免疫荧光强度进行测量,单位以每平方微米Arbitrary Units(AU/μm2)表示。
5.统计学处理
结 果
1.Vimentin免疫荧光染色
采用波形蛋白(Vimentin)作为外膜成纤维细胞和中膜平滑肌细胞合成表型的标志物,同时为了区分血管中膜和外膜,我们用α-SM actin与其进行荧光双标,观察Vimentin在外膜和中膜的表达变化。
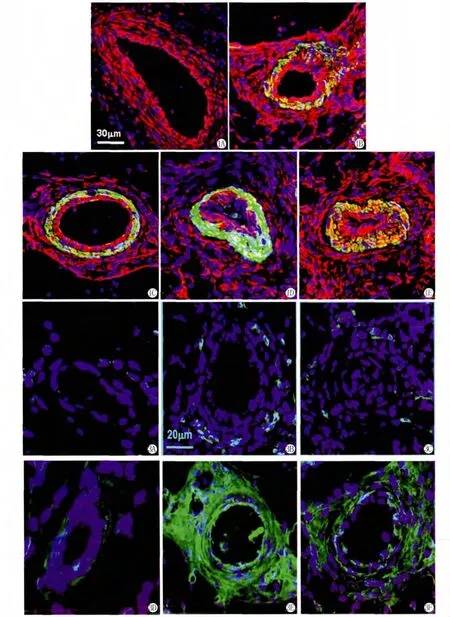
在正常血管,Vimentin的表达适度(图1A);1w后,Vimentin在单纯结扎侧和结扎加去神经侧的表达均增加,但是外膜Vimentin的表达在结扎侧要比结扎加去神经侧高(图1B,D);8w后,Vimentin的表达在单纯结扎侧类似于正常血管,但在结扎加去神经侧,Vimentin在中膜表达仍然很高,并且在外膜的表达增加(图1C,E)。中膜和外膜的统计学分析见(图2)。
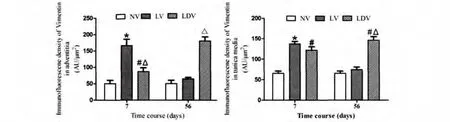
图2 1w、8wvimentin在单纯结扎(LV)和结扎加去神经(LDV)血管外膜和中膜比较。*和#:LV和LDV与正常血管(NV)比较(P<0.001);△和※:LDV与LV比较(P<0.001)Fig.2The comparison of vimentin in the adventitia and tunic media between ligation(LV)and ligation plus denervation(LDV)in 1wor 8w.*and# :LV or LDV vs NV(P<0.001);△and※ :LDV vs LV(P<0.001)
2.CD11b和MMP-2免疫荧光染色
我们用CD11b作为巨噬细胞标志物检测了侧支血管单核细胞/巨噬细胞浸润的变化,以及用MMP-2抗体检测基质金属蛋白酶在生长侧支血管的表达。
在正常动脉血管,外膜有少量的CD11b阳性细胞(图3A);1w后,在单纯股动脉结扎侧,CD11b阳性细胞数目在侧支血管外膜增多(图3B),荧光强度为57.14±8.5AU/μm2;而在股动脉结扎加去神经侧,CD11b在外膜的表达则明显减少(图3C),荧光强度为22.52±7.8AU/μm2。
在正常动脉血管,MMP-2在外膜的表达弱(图3D);1w后,在单纯股动脉结扎侧,MMP-2在外膜的表达明显增强(图3E),荧光强度为103.49±21.3AU/μm2;单纯股动脉结扎加去神经侧,MMP-2在外膜的表达相对较低(图3F),荧光强度为48.12±13.7AU/μm2。与单纯股动脉结扎侧相比,其差异具有统计学意义(P<0.05)(图4)。
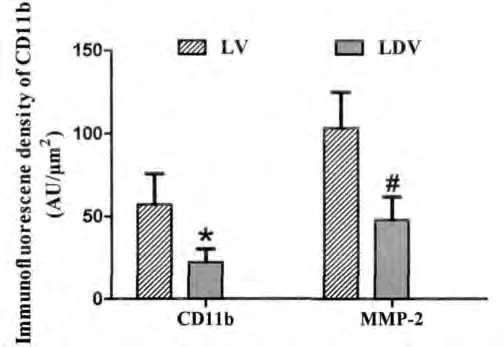
图4 1wCD11b和 MMP-2在单纯结扎(LV)和结扎加去神经(LDV)比较。*和#:LDV与LV比较(P<0.001)Fig.4The comparison of CD11b 和 MMP-2between ligation(LV)and ligation plus denervation(LDV)in 1w.*和#:LDV vs LV (P<0.001)
讨 论
以往的研究表明,外膜的激活和积极的重塑在侧支血管的发育中起着重要的作用,可以确保侧支血管外向性的生长,允许形成更大的侧支动脉[5]。侧支血管外膜的重塑主要包括外膜成纤维细胞的激活和细胞外基质的降解。其中外膜成纤维细胞的激活和增殖是侧支血管外向性生长的重要结构基础,且常伴随着细胞外基质金属蛋白酶的激活,降解细胞外基质如弹性纤维,允许血管壁的外向性扩张生长,从而发育成较大的具有导血功能的动脉血管[6,7]。在本实验中我们观察到单纯股动脉结扎后,Vimentin在外膜以及基质金属蛋白酶的表达明显增强,使得弹性成分和细胞外基质得以降解,有利于侧支血管的向外生长。而在去神经后,侧支血管外膜成纤维细胞和细胞外基质金属蛋白酶在外膜的表达减少,因而可能影响了血管壁外膜的激活和细胞外基质的降解,从而限制了侧支血管外向性的生长。
在动脉生成中,单核细胞/巨噬细胞虽然在血管中膜和内膜也可见,但通常大部分聚集在外膜。它们是动脉生成过程中外膜积极重塑的重要指征,因为它们能分泌生长因子如FGF和PDGF以及基质金属蛋白酶,促进细胞的增殖和降解细胞外基质为细胞迁移提供便利[8,9]。在我们的实验中发现,去神经支配后,外膜单核细胞/巨噬细胞的浸润减少。同时在我们早期的实验中发现在去除神经支配后,细胞增殖率降低[10]。这说明由于血管壁失去了神经支配,外膜成纤维细胞和基质金属蛋白的表达减少,细胞增殖率降低,从而降低了血管外膜的激活,因此限制了侧支血管的外向性生长。
Kacem[11]等的实验发现在去除动脉的神经支配后,Vimentin在SMC的表达增加,这表明神经直接指导着SMC的去分化和迁移。并且,交感神经的切除术会加速股动脉SMCs的迁移和去分化,增加动脉粥样硬化的斑块[12]。在我们的实验中发现,去神经后Vimentin在血管中膜的表达仍然很高,而结合上述的实验结果,在血管外膜的激活受到影响的前提下,中膜的过度激活则会进一步导致血管管壁增厚,管腔变窄,从而呈现一种内向性的生长方式。
本实验结果在发现去除神经支配后侧支血管生长方式变化的前期工作基础上,进一步观察到在后肢血管阻塞的情况下,增加的血流以及同时引起的缺血缺氧等局部微环境刺激了血管壁的神经,影响侧支血管生长过程中血管壁激活的因素,从而参与调节侧支血管的生长,完善了神经调节对侧支血管生长作用的认识,为缺血性疾病的治疗寻找新的促侧支血管生长的途径。
[1]Schaper J and Weihrauch D.Collateral vessel development in the porcine and canine heart.In:Collateral Cir-culation-Heart,Brain,Kidney,Limbs,edited by Schaper W and Schaper J.Boston,MA:Kluwer,1993,65-102
[2]Deindl E,Buschmann I,Hoefer I,et al.Role of ischemia and of hypoxia-inducible genes in arteriogenesis after femoral artery occlusion in the rabbit.Circ Rec,2001,89:779-786
[3]Price RJ,Less JR,Van Gieson EJ,et al.Hemodynamic stresses and structural remodeling of anastomosing arteriolar networks:design principles of collateral arterioles.Microcirculation,2002,9:111-124
[4]罗明英,伍校琼,杨宝林等.去神经支配对鼠后肢缺血诱导侧支血管生长方式的调节.中国临床解剖学杂志,2011,29(6):668-671
[5]Cai WJ,Koltai S,Kocsis E,et al.Remodeling of the adventitia during coronary arteriogenesis.Am J Physiol Heart Circ Physiol,2003,284(1):H31-H40
[6]Cai W,Vosschulte R,Afsah-Hedjri A,et al.Altered balance between extracellular proteolysis and antiproteolysis is associated with adaptive coronary arteriogenesis.J Mol Cell Cardiol,2000,32(6):997-1011
[7]Yang HT,Deschenes MR,Ogilvie RW,et al.Basic fibroblast growth factor increases collateral blood flow in rats with femoral arterial ligation.Circ Res,1996,79(1):62-69
[8]Shimokado K,Raines EW,Madtes DK,et al.A significant part of macrophage-derived growth factor consists of at least two forms of PDGF.Cell,1985,43(1):277-286
[9]Hu JH,Du L,Chu T,et al.Overexpression of urokinase by plaque macrophages causes histological features of plaque rupture and increases vascular matrix metalloproteinase activity in aged apolipoprotein e-null mice.Circulation,2010,121(14):1637-1644
[10]罗明英,伍校琼,杨宝林等.神经因素对缺血诱导的侧枝血管生长过程中Ki67和α-SM-actin表达的影响.中国临床解剖学杂志,2010,28(6):677-679
[11]Kacem K,Seylaz J,Issertial O,et al.Chemical sympathectomy favours vimentin expression in arterial smooth muscle cells of young rats.J Auton Nerv Syst,1995,53(1):57-68
[12]Kacem K,Sercombe C,Hammami M,et al.Sympathectomy causes aggravated lesions and dedifferentiation in large rabbit atherosclerotic arteries without involving nitric oxide.J Vasc Res,2006,43(3):289-305
图 版 说 明
图1 Vimentin免疫荧光染色A:正常;B、C:单纯结扎1w和8w;D、E:结扎加去神经1w和8w(红色:vimentin;绿色:α-SM actin;蓝色:DAPI)(Bar=30μm)
图3 CD11b和 MMP-2免疫荧光染色1wA、B、C:CD11b在正常、单纯结扎和结扎加去神经;D、E、F:MMP-2在正常、单纯结扎和结扎加去神经(绿色:CD11b和MMP-2;蓝色:DAPI)(Bar=20μm)
EXPLANATION OF FIGURES
Fig.1Vimentin immunofluorescence staining A:normal;B、C:Ligation in 1wor 8w;D、E:Ligation plus dennervation in 1wor 8w (red:vimentin;green:α-SM actin;blue for nuclei)
Fig.3CD11band MMP-2immunofluorescence staining in 1wA、B、C:CD11bin normal,LV and LDV;D、E、F:MMP-2in normal,LV and LDV (green:CD11b and MMP-2;blue for nuclei)