Twist1、VE-cadherin 和血管生成拟态在子宫内膜样腺癌侵袭转移中的作用及意义
冯振中 武世伍 俞 岚 蔡兆根 李 楠 吕秀红 陈嘉薇
(蚌埠医学院第一附属医院病理科,蚌埠医学院病理学教研室,蚌埠233030;1上海交通大学附属第一人民医院病理科,上海200080)
子宫内膜样腺癌是最常见的女性生殖道恶性肿瘤之一,侵袭和转移是肿瘤治疗失败、临床预后不良的重要生物学原因[1],探讨肿瘤侵袭转移的相关分子机制,能够为临床子宫内膜癌的诊疗提供有价值的帮助。
Twist1基因是一种在胚胎发育中起关键调控作用的转录因子,同时具有介导肿瘤细胞上皮-间质转化(epithelial mesenchymal transition,EMT)的能力,在多种人类恶性肿瘤中均有高表达[2,3]。血管生成拟态(vasculogenic mimicry,VM)是新近认识的肿瘤微循环模式,即某些高侵袭性肿瘤细胞通过自身变形和细胞外基质重塑,直接形成微循环管道,管腔无内皮细胞衬覆,并可与宿主微血管相通[4]。随后的研究发现,VM与恶性肿瘤的侵袭转移和预后不良等恶性行为密切相关[5]。血管上皮钙粘附素(VE-cadherin)是细胞黏附分子家族中的重要成员,是血管发生及血管内环境稳定过程的重要因素,并直接参与了肿瘤VM的形成和调控[6,7]。
那么,在子宫内膜样腺癌中是否存在VM现象?Twist1、VE-cadherin的过度表达是否和 VM的发生有关?目前关于此类的研究未见报道。本研究采用免疫组化方法,结合组织芯片技术,检测124例子宫内膜样腺癌、28例不典型内膜增生和35例正常内膜组织中Twist1、VE-cadherin和VM的表达,探讨这些指标和子宫内膜样腺癌侵袭转移的关系,为临床肿瘤预防和靶向治疗提供新的思路和实验基础。
材料和方法
1.研究对象
子宫内膜样腺癌124例,来自上海交通大学附属上海市第一人民医院病理科,2005年1月至2009年9月手术切除并经病理诊断证实标本,患者术前均未接受放疗、化疗,具有完整临床资料。年龄27-81岁,平均年龄57岁。根据2000年FIGO标准,临床分期为101例I-II期,23例III-IV期。根据2003年WHO标准,病理分级为高分化57例,中分化41例,低分化26例。肌层浸润>50%者40例,≤50%者84例。有淋巴结转者31例,无转移者93例。子宫内膜不典型增生28例(单纯性不典型增生3例,复杂性不典型增生25例);正常子宫内膜35例(增生期16例,分泌期19例),分别取自妇科活检和子宫平滑肌瘤的内膜组织。
2.方法和试剂
兔抗人多克隆Twist1抗体(工作浓度1∶200,Santa Cruz公司),鼠抗人单克隆 VE-cadherin抗体(工作浓度1∶120,Abcam公司),鼠抗人单克隆CD34抗体(即用型,克隆号 QBEnd/10)、Ultra-Sensitive试剂盒和DAB显色液购自福州迈新生物技术有限公司。过碘酸Schiff(periodicacid-Schiff,PAS)染色液为蚌埠医学院第一附属医院病理科配制。
3.构建组织芯片
选择所需病例存档蜡块,根据HE切片仔细进行形态学观察,确定具有代表性的病变部位并标记,由上海芯超生物有限公司技术支持。
4.免疫组织化学染色
采用SP两步免疫组织化学染色法,操作步骤按试剂盒说明书进行,采用已知阳性片作为对照,以PBS液代替一抗作为空白对照。Twist1和VE-cadherin蛋白检测采用组织芯片结合免疫组化方法,VM检测为便于观察更多病变组织,采用常规切片结合免疫组化方法。
5.CD34和PAS双重染色检测VM[8]
CD34免疫组化染色,DAB显色后,自来水冲洗1min终止显色反应,将切片置于0.5%高碘酸溶液中氧化5-8min,自来水冲洗2min,再用蒸馏水洗1次,于暗处置于Schiff液中染色10-20min,然后用0.5%偏重亚硫酸钠液滴洗2次,每次1min,自来水冲洗2min;此后依次苏木素浅染细胞核、盐酸酒精分化、返蓝、脱水透明以及中性树胶封片。
6.结果判定
采用双盲法阅片并判定结果,若肿瘤染色不均匀,则取其主要部分进行计数。Twist1蛋白主要定位于细胞核,可伴有胞质着色;VE-cadherin阳性表达于细胞质,呈弥漫性棕色颗粒,也可见于血管内皮细胞连接处,呈棕褐色细线状。判断标准以子宫内膜腺上皮细胞内出现定位明确、染色明显的样本为阳性,判定标准[9]:①阳性细胞率:无着色为0,1-10%为1分,11-50%为2分,51-80%为3分,>81%为4分;②染色强度:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。为方便数据统计,两者计分相加,<2分为阴性,≥2分为阳性表达。
7.统计学分析
采用SPSS 16.0统计软件。计数资料率的比较采用卡方检验或Fisher精确检验,相关关系采用Spearman等级相关分析,检验水准取双侧α=0.05。
结 果
1.Twist1、VE-cadherin和VM 在不同内膜组织中的表达
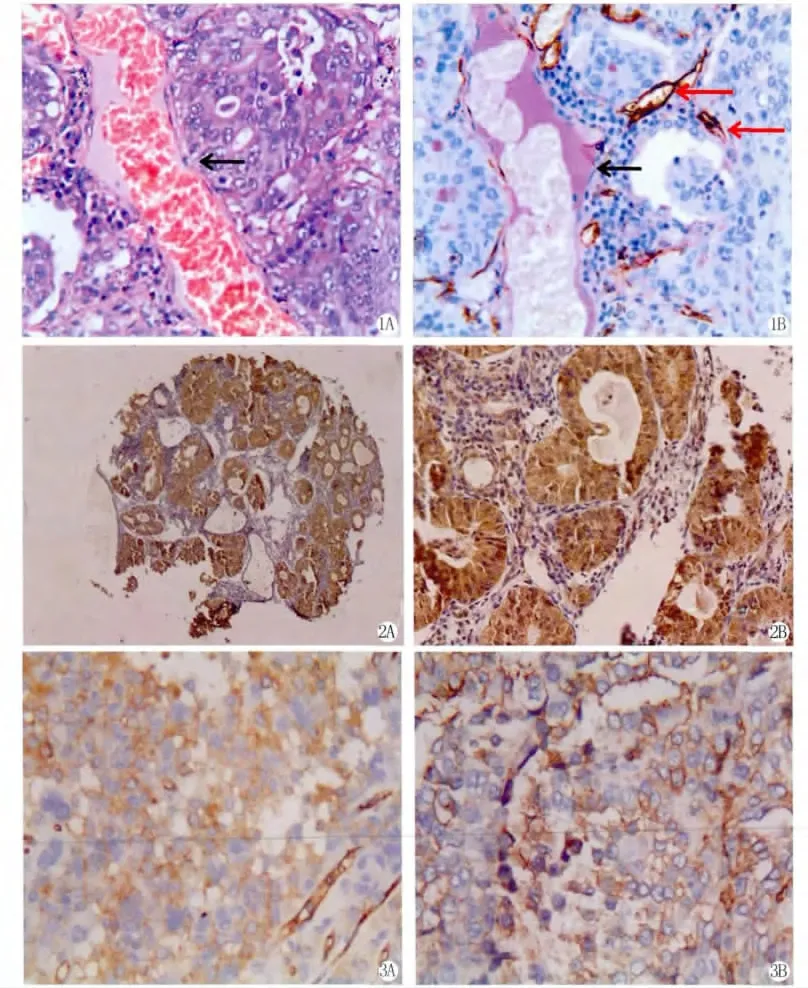
在部分子宫内膜样腺癌中可检测到VM结构(16.9%,21/124),而正常子宫内膜及不典型增生内膜中均未观察到VM(P<0.01)。苏木精-伊红(HE)染色切片中可见由肿瘤细胞围绕形成的管腔样结构,腔内可见红细胞,通过CD34和PAS套染,表现为PAS阳性染色但CD34阴性的管腔样结构(图1),其周围未见坏死的肿瘤细胞。常规血管则表现为CD34及PAS染色均为阳性的管腔样结构。
Twist1、VE-cadherin在子宫内膜样腺癌中的表达率分别为56.5% (70/124)、48.4%(60/124),与不典型增生和正常内膜组织相比,有显著差别(P<0.01)(图2,3)(表1)。

表1 Twist1、VE-cadherin和VM在不同内膜组织中的表达Table 1 Expression of Twist1,VE-cadherin and VM in distinct tissue types
2.子宫内膜样腺癌中Twist1、VE-cadherin和VM的表达与临床病理因素的关系
子宫内膜样腺癌中Twist1表达与病理分级、肿瘤浸润深度和淋巴结转移明显相关(P<0.05)(表2),但与患者年龄、临床分期等指标无明显关系。VE-cadherin蛋白与肌层浸润和淋巴结转移显著相关(P<0.01)(表2)。肿瘤细胞分化越低,VM 形成越多,差异显著(P<0.01),FIGO临床分期I+II期 VM 阳性率为12.9% (13/101),III+IV 期VM 表达率为34.8% (8/23),有明显差异(P<0.05);VM组的患者更易发生肌层浸润及淋巴结转移(P<0.01)(表2)。
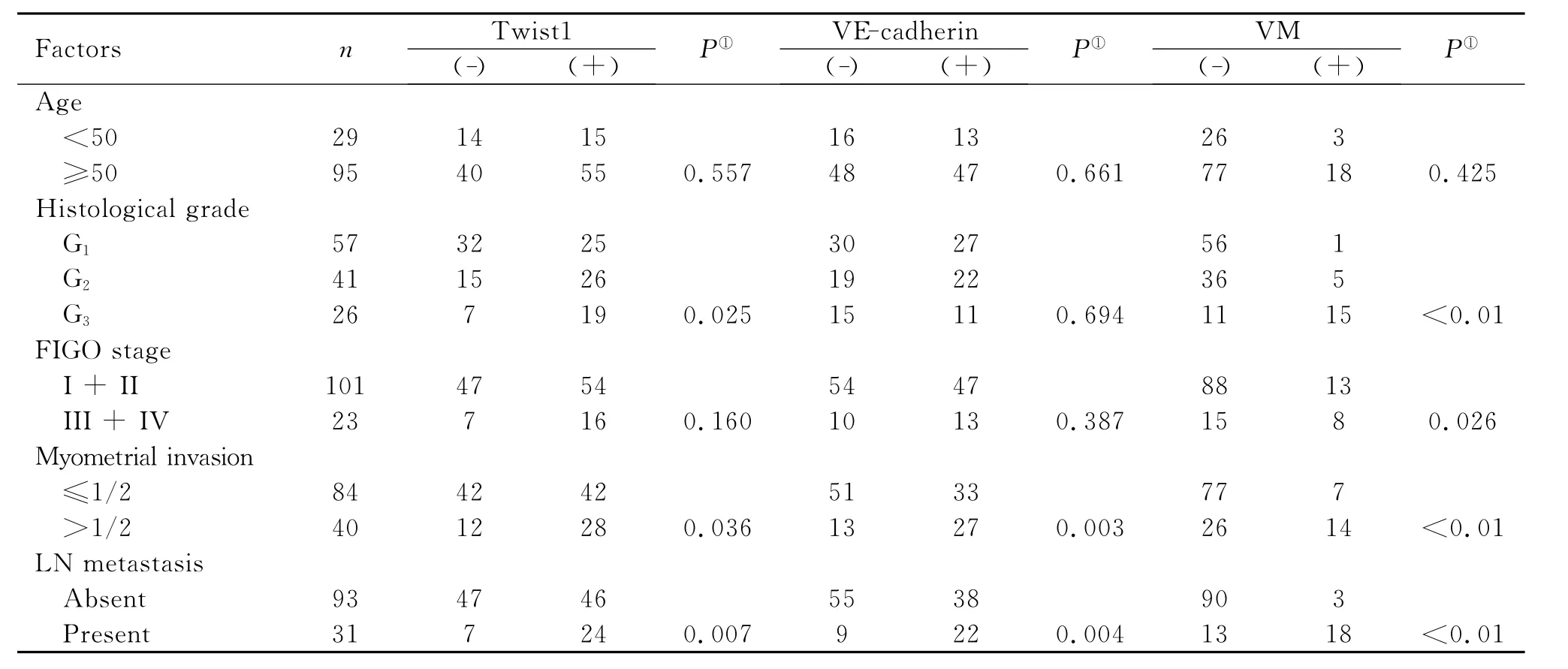
表2 Twist1、VE-cadherin和VM表达与子宫内膜样腺癌临床病理因素的关系Table 2 The association of Twist1,VE-cadherin and VM with clinicopathological factors in EEC
3.子宫内膜样腺癌中Twist1、VE-cadherin和VM的关系
Spearman相关性分析显示,子宫内膜样腺癌中Twist1和VE-cadherin的表达呈正相关(r=0.232,P=0.010),同时VM的形成与VE-cadherin的表达也呈正相关趋势(r=0.251,P=0.005)(表3)。

表3 子宫内膜样腺癌中Twist1、VE-cadherin和VM的相关性Table 3 The correlation between Twist1,VE-cadherin and VM expression in EEC
讨 论
Twist1是一种在进化上高度保守的螺旋-环-螺旋转录因子,可以促进胚层上皮转变为间质细胞并具有迁徙能力,在中胚层形成过程中具有重要作用,同时Twist1也是介导肿瘤细胞发生上皮-间质转化(EMT)并促进侵袭转移的关键调控因子。Li等[10]采用Twist1重组质粒转染MCF7乳腺癌细胞株和Hela宫颈癌细胞株,荧光显微镜观察发现细胞间连接丧失,形态呈纺锤形或成纤维细胞样,间质细胞标记物表达上调,上皮细胞标记物表达下调。Hui等[11]对120例非小细胞性肺癌研究报道,Twist1在38.3%的肺癌组织中过表达,并和淋巴结累及、胸腔转移等密切相关,Twist1阳性患者预后较差,干扰Twist1基因的表达,可以明显降低肺癌细胞的侵袭转移能力。本实验结果与上述报道相似,在子宫内膜组织癌变过程中,Twist1蛋白表达逐渐增高(P<0.01),并与肿瘤细胞分化程度、肌层浸润、淋巴结转移等恶性行为相关(P<0.05),提示Twist1基因的激活在子宫内膜癌的发生、发展中发挥重要作用,可能通过EMT过程,促进子宫内膜癌细胞的运动迁移能力,从而诱导肿瘤细胞侵袭子宫肌层、累犯淋巴结等恶性生物学行为。
血管生成拟态(VM)是一种不同于传统血管形成的全新肿瘤微循环模式,包括三种成分:可塑性的恶性肿瘤细胞、细胞外基质重塑、与宿主微循环系统相通,特殊染色表现为PAS阳性而CD34阴性[12]。由于VM管道直接由肿瘤细胞围成,与血流之间仅有一层PAS阳性的基底膜样物相隔,无血管内皮细胞屏障,因此更有利于肿瘤的侵袭和转移。本研究发现,在分化程度差和FIGO临床晚期子宫内膜癌病例中,VM结构更明显(P<0.05),而肿瘤细胞形成VM后,可能进一步浸润子宫肌层,转移盆腔淋巴结(P<0.05)。本实验结果与国外有关报道基本一致:Shirakawa等[13]研究证明VM是肿瘤组织内的一个功能性微循环,而非出血坏死形成的腔隙,血管造影证实VM腔内有血流通过,同时在7.9%的人乳腺癌组织中存在VM现象,具有VM的患者更易发生肿瘤转移。Liu等[14]对96例前列腺癌患者研究显示,24例标本存在VM结构,并和肿瘤Gleason分级、淋巴结转移、精囊腺侵犯、远处转移等明显相关,多变量统计分析VM阳性患者无瘤生存率和总生存率显著降低。
血管上皮钙粘附素(VE-cadherin)属于钙依赖粘附素家族,主要表达于内皮细胞接合黏附处,在内皮细胞的迁移和存活、血管发生及维持血管完整性等方面中具有重要作用。相关研究报道,VE-cadherin在高侵袭性恶性黑色素瘤细胞中表达,而在低侵袭性肿瘤细胞中几乎检测不到,敲除VE-cadherin的表达,可以导致肿瘤细胞不能形成VM结构[15]。本实验结果显示,64例 VE-cadherin阴性的子宫内膜样腺癌中,59例无VM的形成,而60例VE-cadherin高表达的标本,有16例存在VM 结构,二者在子宫内膜样腺癌中呈正相关关系(r=0.251,P=0.005)。结果说明,在子宫内膜癌的VM形成过程中,VE-cadherin可能发挥关键性作用:随着VE-cadherin表达的增加,能够使肿瘤细胞间黏附变得松散,并促进肿瘤细胞的迁移、变形和重塑,从而诱导VM的形成和肿瘤的侵袭转移。
VM是肿瘤细胞可塑性的一种表现,本质上表现为上皮细胞(内胚层)向内皮细胞(中胚层)的分化并获得间充质细胞的特性,可以推测VM的形成与EMT过程具有相似性[16],而 VE-cadherin可能是其交叉作用位点之一。Sun和Zhao等[17,18]研究发现,在肝癌组织中Twist1介导的EMT和肿瘤远处转移与患者预后密切相关,转染Twist1质粒提高了肝癌细胞的侵袭转移能力,也能够促进VE-cadherin的转录,并诱导肝癌细胞VM的形成。采用荧光素酶报告基因结合ChIP分析发现,Twist1可以直接结合VE-cadherin基因启动子区域并提高其转录活性,两者存在直接调控的分子结构基础。与上述报道相似,本研究结果显示,Twist1的表达从正常内膜到不典型增生和子宫内膜癌的演变过程中不断递增(P<0.01),VE-cadherin蛋白表达与 Twist1的升高趋势一致,二者在子宫内膜样腺癌中呈明显的正相关(r=0.232,P=0.010)。实验结果提示,在子宫内膜样腺癌中,Twist1可能通过调控VE-cadherin的表达,诱导肿瘤细胞形成VM结构,最终促进肿瘤的侵袭和转移。联合检测Twist1、VE-cadherin和VM的表达情况,对于评估子宫内膜癌的进展和预后判断具有重要的临床意义。
[1]Siegel R,Ma J,Zou Z,et al.Cancer statistics 2014.CA Cancer J Clin,2014,64(1):9-29
[2]Khan MA,Chen HC,Zhang D,et al.Twist:a molecular target in cancer therapeutics.Tumour Biol,2013,34(5):2497-2506
[3]Creighton CJ,Gibbons DL,Kurie JM.The role of epithelial-mesenchymal transition programming in invasion and metastasis:a clinical perspective.Cancer Manag Res,2013,5:187-195
[4]Vartanian AA.Signaling pathways in tumor vasculogenic mimicry.Biochemistry (Mosc),2012,77(9):1044-1055
[5]Tang HS,Feng YJ,Yao LQ.Angiogenesis,vasculogenesis,and vasculogenic mimicry in ovarian cancer.Int J Gynecol Cancer,2009,19(4):605-610
[6]Bentley K,Franco CA,Philippides A,et al.The role of differential VE-cadherin dynamics in cell rearrangement during angiogenesis.Nat Cell Biol,2014,16(4):309-321
[7]Monaghan-Benson E,Burridge K.VE-cadherin status as an indicator of microvascular permeability.Methods Mol Biol,2013,1046:335-342
[8]俞 岚,武世伍,宋文庆等.卵巢上皮癌中血管生成拟态和E-钙黏蛋白表达及其临床意义.中国病理生理杂志,2011,27(11):2120-2125
[9]Feng Z,Gan H,Cai Z,et al.Aberrant expression of hypoxia-inducible factor 1α,TWIST and E-cadherin is associated with aggressive tumor phenotypes in endometrioid endometrial carcinoma.Jpn J Clin Oncol,2013,43(4):396-403
[10]Li J and Zhou BP.Activation ofβ-catenin and Akt pathways by Twist1are critical for the maintenance of EMT associated cancer stem cell-like characters.BMC Cancer,2011,11:49
[11]Hui L,Zhang S,Dong X,et al.Prognostic significance of Twist1and N-cadherin expression in NSCLC.PLoS One,2013,8(4):e62171
[12]柴大敏,鲍正齐,冯振中等.管鳞状细胞癌中血管生成拟态及MMP-1蛋白的表达.中国组织化学与细胞化学杂志,2012,21(1):43-47
[13]Shirakawa K,Kobayashi H,Sobajima J,et al.Inflammatory breast cancer:vasculogenic mimicry and its hemodynamics of an inflammatory breast cance rxenograft model.Breast Cancer Res,2003,5(3):136-139
[14]Liu R,Yang K,Meng C,et al.Vasculogenic mimicry is a marker of poor prognosis in prostate cancer.Cancer Biol Ther,2012,13(7):527-533
[15]Hess AR,Seftor EA,Gruman LM,et al.VE-cadherin regulates EphA2in aggressive melanoma cells through a novel signaling pathway:implications for vasculogenic mimicry.Cancer Biol Ther,2006,5:228-233
[16]Fan YL,Zheng M,Tang YL,et al.A new perspective of vasculogenic mimicry:EMT and cancer stem cells(Review).Oncol Lett,2013,6(5):1174-1180
[17]Zhao XL,Sun T,Che N,et al.Promotion of hepatocellular carcinoma metastasis through matrix metalloproteinase activation by epithelial-mesenchymal transition regulator Twist1.J Cell Mol Med,2011,15(3):691-700
[18]Sun T,Zhao N,Zhao XL,et al.Expression and functional significance of Twist11in hepatocellular carcinoma:its role in vasculogenic mimicry.Hepatology,2010,51(2):545-556
图 版 说 明
图1 子宫内膜样腺癌中VM的表达 (A×200,HE法,黑色箭头示VM结构;B×200,CD34和PAS双染,黑色箭头示PAS阳性、CD34阴性的VM结构,红色箭头示PAS和CD34均阳性的血管结构)
图2 Twist1蛋白在子宫内膜样腺癌中的表达(SP法,A×40;B×200)
图3 VE-cadherin蛋白在子宫内膜样腺癌中的表达(SP法,A×200;B×400)
EXPLANATION OF FIGURES
Fig.1Presence of VM in EEC(A×200,HE staining,black arrows indicated VM,B×200,CD34and PAS double staining,black arrows indicated VM with PAS positive and CD34negative staining,red arrows indicated capillary,with positive staining of CD34and PAS)
Fig.2Expression of Twist1in EEC(SP,A×40;B×200)
Fig.3Expression of VE-cadherin in EEC(SP,A×200;B×400)