一种高效的灵芝菌丝体总蛋白的提取方法
唐奕诗 马楚莹 周玉萍 陈琼华 田长恩
(广州大学生命科学学院植物抗逆基因功能研究广州市重点实验室 广东广州 510006)
2012年中国科学家利用最新的高通量测序技术和光学图谱技术,自主完成了染色体水平灵芝基因组精细图谱,首次实现了中药研究在基因组尺度寻找新的代谢功能基因及调控元件,为代谢网络重构及灵芝种质保护与创新奠定了基础,推动灵芝成为第一个“模式药用真菌”[1-2]。近年灵芝遗传转化体系已逐步建立[3-4],今后可以通过代谢工程来改造或研究细胞代谢途径的关键酶,从而提高灵芝免疫调节蛋白的产量[5],或以灵芝菌丝作为外源基因的表达系统,使用转基因灵芝发酵生产珍贵稀有的药物蛋白等等,这些研究必将需要确定灵芝菌丝细胞中蛋白质表达的定量变化。
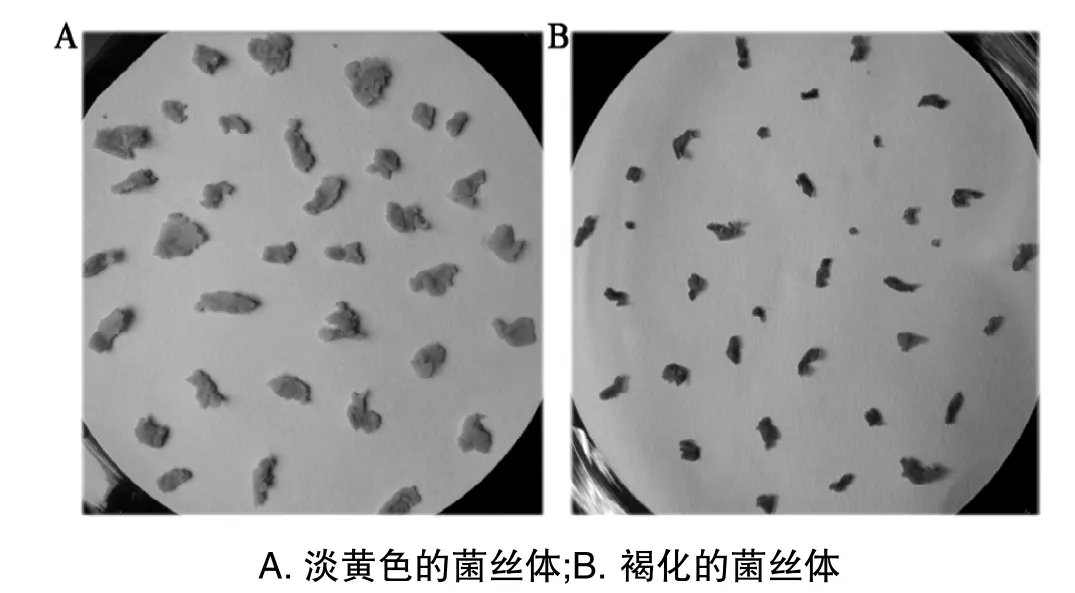
图1 灵芝菌丝体的制备
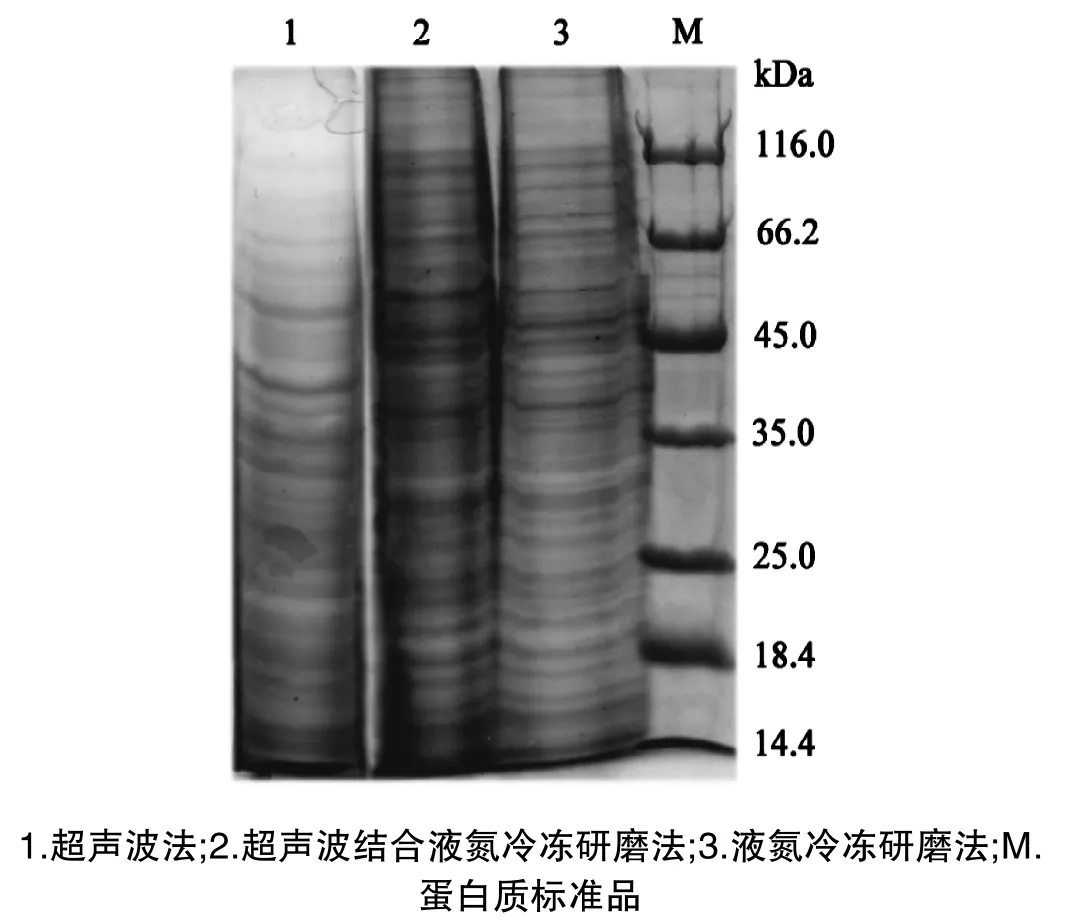
图2 不同方法制备的蛋白质样品SDS-PAGE电泳图谱
蛋白质组学研究通过对生物体内表达的各种蛋白质进行识别和定量分析,确定它们在细胞内外的定位、修饰、相互作用和功能,以期获得对生命本质和活动规律的全景式认识[6]。蛋白质的提取是蛋白质组学研究的首要步骤,其质量的好坏直接影响蛋白质表达分析研究的开展及其结果的准确性。因此,在灵芝蛋白质组学研究中,获取相关胞内蛋白质,并保持其完整性是研究的首要问题。目前仅有灵芝子实体原基和破壁孢子粉中提取蛋白质方法的报道[7-8]。本文以韦伯灵芝发酵菌丝为研究对象,在前人工作的基础上选用了超声波法、液氮冷冻研磨法和超声波联合液氮冷冻研磨法来破碎细胞壁,采用高浓度尿素-硫脲溶解胞内蛋白质的方法提取菌丝总蛋白,并分析不同蛋白酶抑制剂对胞内蛋白酶的抑制作用。本研究旨在建立一种高效灵芝菌丝体总蛋白的提取方法。
1 材料与方法
1.1 实验材料
1.1.1 菌种及培养基
韦伯灵芝(Ganoderma weberianum)采自广州花都芙蓉彰,由本研究组分离纯化得韦伯灵芝菌株TZC-1[9-10]。
综合PDA培养基:马铃薯200g/L、葡萄糖20g/L、KH2PO43g/L、MgSO4·7H2O 1.5g/L、VB12mg/L、琼脂15g/L,pH值自然。
发酵培养基:综合PDA培养基中去掉琼脂,加入酵母膏5g/L,pH=4.8。
1.1.2 主要生化试剂
尿素、硫脲、苯甲基磺酰氟(PMSF)、蛋白酶抑制剂混合物、3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)、十二烷基磺酸钠(SDS)、二硫苏糖醇(DTT)、乙二胺四乙酸(EDTA)、Tris碱等均购自生工生物工程(上海)股份有限公司;蛋白分子量标准品购自Fermentas。
1.2 实验方法
1.2.1 菌丝体制备
韦伯灵芝菌丝经斜面活化后,转接到综合PDA平板上,26℃培养5d,用无菌打孔器将平板菌种制成直径10mm,厚2mm的菌种塞,将菌种塞接种到装有100mL发酵培养基的300mL锥形瓶中,每瓶接入3个菌塞,在26℃、160r/min条件下恒温震荡5d,用蒸馏水反复清洗菌丝球5次,最后用滤纸反复吸干菌丝体水份,获得新鲜菌丝球。
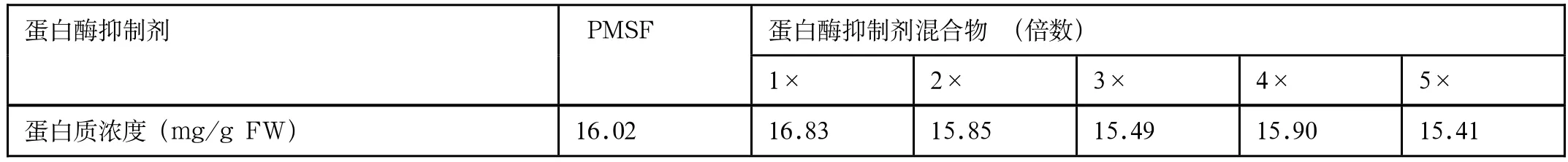
表1 含不同蛋白酶抑制剂提取的样品中蛋白质浓度
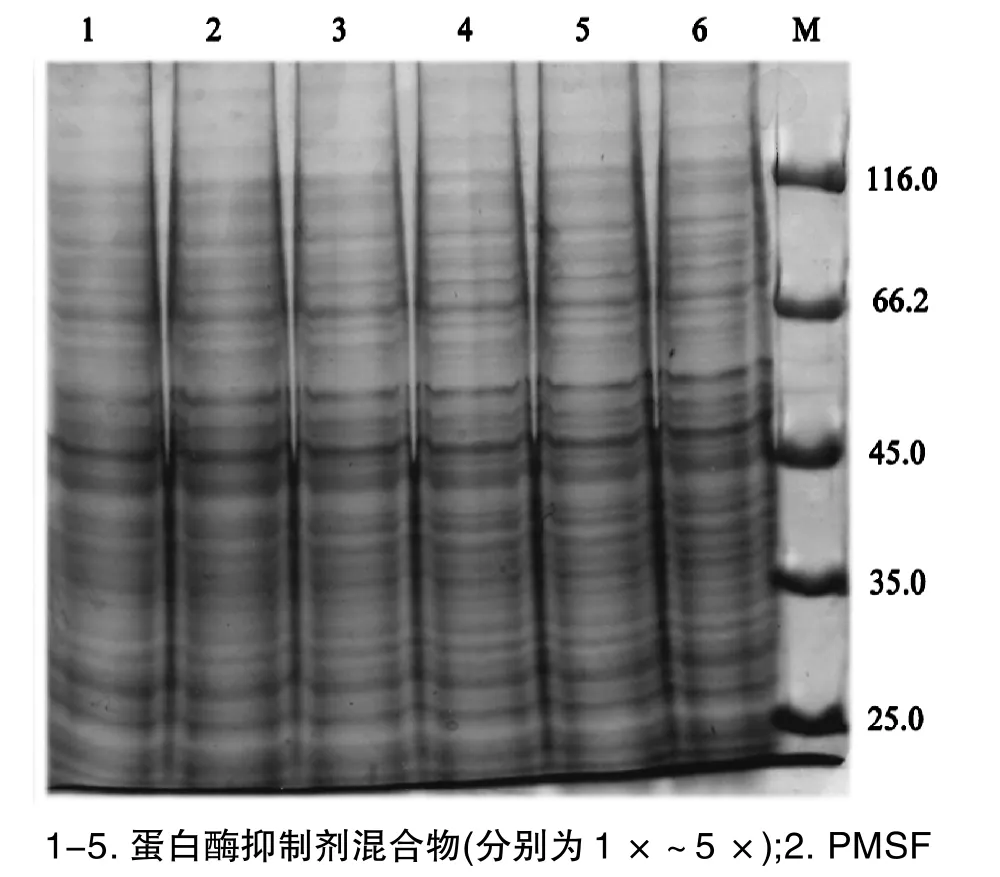
图3 蛋白酶抑制剂对蛋白样品的影响
1.2.2 蛋白质提取方法
参考胡斌斌发表的真菌总蛋白质提取方法[11],但有所改进,详细步骤为:
方法1:向预冷的研钵中加入适量的菌丝体,研钵置于冰上,将菌丝体研磨成粉末;称取100mg菌丝粉末,加入750μL裂解液(8mol/L尿素,2.5mol/L硫脲,1.5mmol/LEDTA,10mmol/LTris,20mmol/LPMSF)悬浮起菌丝粉末;4℃冰浴30min,期间每隔5min混匀一次;用超声波细胞破碎仪在冰浴中破碎菌体(750W,超声6s,间隔1s,超声20次);4℃12000r/min离心10min,弃沉淀保留上清液。
方法2:向装有液氮的研钵中加入适量的菌丝体,研钵置于冰上,在液氮中将菌丝体研磨成粉末,接着按方法Ⅰ完成。
方法3:向装有液氮的研钵中加入适量的菌丝体,研钵置于冰上,在液氮中将菌丝体研磨成粉末;加入750μL提取液Ⅰ(8mol/L尿素,2.5mol/L硫脲,1.5mmol/LEDTA,10mmol/LTris,20mmol/LPMSF或不同浓度的蛋白酶抑制剂混合物)。4℃冰浴60min;加250 μL提取液Ⅱ(4%CHAPS,4%DTT,0.5%SDS),涡旋30s×6次,间隔1min置于冰上;4℃10000r/min离心10min,弃沉淀保留上清液。
1.2.3 蛋白质浓度测定
蛋白质浓度按Bradford法[12]测定:根据测定不同浓度的标准牛血清白蛋白(BSA)在595nm处的吸光值(A),绘出标准曲线,BSA浓度为横座标,A595值为纵座标,其方程为:Y=0.894X+0.0164,R2=0.9968。样品中的蛋白质浓度根据样品的吸光值、稀释倍数和菌丝体重量算出,其单位为mg/g菌丝。
1.2.4 SDS-PAGE凝胶电泳
采用等体积上样的方法,取提取的蛋白质溶液15μL加3.7μL上样缓冲液,混匀后取12μl进行上样,电泳结束后凝胶用考马斯亮蓝进行染色处理。
2 结果与分析
2.1 菌丝体的制备
灵芝菌丝经发酵后,收集的菌丝球用蒸馏水反复洗涤可防止培养基中蛋白组分的污染;洗涤过的菌丝体含大量水分,需要用滤纸吸干,有利于在液氮中研磨成粉末。制备菌丝体时,需要控制好时间,菌丝样品正常呈淡黄色(图1A),如果菌丝干燥后暴露在空气中时间过长,菌丝将会变成褐色(图1B)。实验结果显示:在相同提取条件下,以褐色菌丝体为材料提取的蛋白质浓度明显低于淡黄色菌丝体。
2.2 不同方法提取蛋白质的比较
实验通过超声波、超声波联合液氮冷冻研磨和液氮冷冻研磨等三种方法破碎灵芝菌丝细胞壁,采用高浓度尿素-硫脲法来溶解细胞蛋白质组,所制备蛋白样品经SDS-PAGE凝胶电泳和按Bradford法测定蛋白质浓度,根据电泳图谱及蛋白质浓度来评估不同方法的效果。
从电泳图谱(图2)分析,超声波法所得到的样品中蛋白质数量较其他两种方法少,蛋白条带不清晰,分布不均匀,主要集中在低分子量14.4~45.0kDa范围;超声波联合液氮冷冻研磨法提取的样品中蛋白质条带丰富,分布均匀,但条带不很清晰,泳道两侧拖带严重,推测可能是部分降解所致;液氮冷冻研磨法提取的样品中蛋白质数量与超声波联合液氮冷冻研磨法提取的蛋白质数量基本一致,蛋白条带丰富,分布均匀,条带清晰。三种方法提取样品的蛋白质浓度分别为:9.95±0.41、17.47±0.39和15.85±0.54mg/g菌丝。根据电泳图谱和蛋白质浓度来比较,认为方法Ⅲ的提取方法适合灵芝菌丝体蛋白质组的制备。
为了优化方法Ⅲ,提取液I中使用不同种类和不同浓度的蛋白酶抑制剂,分析所提蛋白质的质量,其结果表明(图3):5种浓度的蛋白酶抑制剂混合物和20mmol/L PMSF所提取的蛋白质样品的电泳图谱没有明显差异,蛋白质条带都比较清晰且条带的丰富性较好,条带分布均匀;所有样品的蛋白质浓度均不存在显著性差异(表1)。从结果可以判断,PMSF和蛋白酶抑制剂混合物均能很好地抑制灵芝菌丝内源的蛋白酶,防止所提取蛋白质降解,且与蛋白酶抑制剂混合物的浓度无关。
3 讨论
在灵芝蛋白质组学及灵芝转基因菌株生产重组蛋白的研究中,获取菌丝胞内蛋白质,并保持其完整性是研究的首要问题,其质量的好坏直接影响蛋白质表达分析研究的开展及其结果的准确性。因此,建立一种高效的菌丝体总蛋白的提取方法对作为“模式药用真菌”灵芝生物学研究具有十分重要的作用。
真菌的细胞壁破碎是提取蛋白质效果好坏的关键。已知灵芝细胞壁具有坚固的双层结构,由肽聚糖骨架组成,聚糖链上所存在的肽键数量多、交联程度紧密,结构十分致密坚韧,不易破碎[13]。据文献介绍,破碎灵芝孢子及子实体的方法有液氮研磨法[7]、超声波法[14]及机械粉碎法[8,15]等三种。超声波破壁法操作简单,但耗时较长且操作过程中产生的热量可能造成蛋白质降解;液氮冷冻研磨法,成本低且低温条件可避免蛋白质降解[16];机械粉碎法即采用万能粉碎机将烘干的子实体及孢子粉碎成细小粉末,适合制药业生产[15]。本研究采用超声波法、超声波联合液氮冷冻研磨法及液氮研磨法等三种不同细胞壁破碎的方法,其结果表明,三种方法均能破碎灵芝菌丝细胞,得到胞内蛋白质(图2),但是超声波法提取的样品中蛋白质数量较少,有部分蛋白质降解现象;超声波联合液氮冷冻研磨法提取的样品虽然蛋白质数量较多,同样有部分蛋白质降解。在实验设计时,已考虑到超声波发热引起蛋白质降解的问题,实验样品处于冰浴,但结果还是出现一定程度蛋白损伤。因此,今后使用超声波法破碎灵芝菌丝细胞时需要优化超声波功率、超声波工作时间及间隔时间,以保证所提蛋白质的数量及完整性[17]。与刘晓云[7]用液氮冷冻研磨法提取灵芝子实体原基的报道相似,本文发现液氮冷冻研磨法提取的蛋白质样品条带丰富,分布均匀,在分子量14.4~116.0kDa区间内分布大量的清晰蛋白带,且蛋白浓度达到15.85±0.54mg/g。因此,认为液氮冷冻研磨法比其它两种方法更适合于灵芝菌丝蛋白质组的制备。
蛋白质提取常使用含变性剂、表面活性剂和还原剂等成分的提取液,其中常用于真菌总蛋白质提取的方法有尿素-硫脲法[11,18]。变性剂如尿素可以使蛋白质变性,形成完全随机的构象并暴露所有离子基团于溶液中,因此可增加蛋白质的溶解度;硫脲则可辅助尿素对蛋白质进行变性,同时增加膜蛋白的溶解度,以制备包含更完整蛋白质组的样品,提高蛋白质组的完整性[18]。因此,本文参考胡斌斌[11]报道的方法,在提取液Ⅰ中使用高浓度的尿素结合硫脲对灵芝菌丝蛋白质进行4℃低温60min的溶解,最大限度提高总蛋白的数量;随后在提取液Ⅱ中进一步使用表面活性剂CHAPS和SDS来促进蛋白质溶解、还原剂DTT则可保持二硫键处于还原状态,增加蛋白质溶解度。另外,为了防止蛋白质降解、保持蛋白质完整性,实验中比较了PMSF和不同浓度的蛋白酶抑制剂混合物对增加蛋白质稳定性的作用,实验结果表明(图3和表1),两种蛋白酶抑制剂均能很好地抑制灵芝菌丝内源的蛋白酶,有效地阻止了蛋白质降解,且不同浓度的蛋白酶抑制剂混合物作用相同。
综上所述,本文建立了一种稳定高效的灵芝菌丝体总蛋白的提取方法,可满足灵芝蛋白质组学的定量分析的需要。
[1]Chen S,Xu J,Liu C,et al.Genome sequence of the model medicinal mushroom Ganoderma lucidum.Nature Communications,2012(3):913.
[2]Liu DB,Gong J,Dai WK,et al..The genome of Ganoderma lucidum provides insights into triterpenes biosynthesis and wood degradation.PloS one,2012,7(5):e36146.
[3]Kim S,Song J,Choi HT. Genetic transformation and mutant isolation in Ganoderma lucidum by restriction enzyme-mediated integration. FEMS Microbiology Letters,2004(233):201-204.
[4]Shi L,Fang X,Li MJ,et al..Development of a simple and efficient transformation system for the basidiomycetous medicinal fungus Ganoderma lucidum.World Journal Microbiology &Biotechnology,2012(28):283-291.
[5]周选围,林娟,李奇璋,等.灵芝蛋白类活性成分的研究进展.天然产物研究与开发,2007(19):917-924.
[6]耿伟平,吴晨紫,杨志伟.蛋白质组学分析技术在微生物研究中的应用.生物技术通报,2008(6):60-64.
[7]刘晓云,苏明声,杨俊璋,等.灵芝子实体原基双向电泳和总蛋白质提取方法的建立.菌物学报,2009,28(6):802-805.
[8]姜沅彤,赵岩,蔡恩博,等.灵芝水溶性蛋白提取工艺优化.食品安全质量检测学报,2014,5(5):1340-1348.
[9]陈琼华,周玉萍,陈晓,等.韦伯灵芝漆酶的分离纯化及其性质.食品科学,2010,31(5):201-205.
[10]Zhou Y P,Chen QH, Xiao YN,et al..Gene cloning and characterization of a novel laccase from the tropical white-rot fungus Ganoderma weberianum TZC-1.Applied Biochemistry and Microbiology, 2014,50(5):500-507.
[11]胡彬彬,林连兵,魏云林,等.一种高效的真菌总蛋白质提取方法.中国生物工程杂志,2013,33(9):53-58.
[12]Bradford MM. Rapid and sensitive method for quantitation of microgram quantities of protein utilizing principle of protein-dye binding. Analytical Biochemistry,1976 (72):248-254.
[13]杨 珣 ,冯俊明,龚国洪,等.破壁灵芝孢子细胞的微观结构.贵阳中医学院学报,2004,26(4):47-48.
[14]叶波平,王庆华,周书进,等.灵芝蛋白质的分离及其免疫活性研究,药物生物技术,2002,9(3):150-152.
[15]高歌,包海鹰,图力古尔.纳米级灵芝子实体粉末和破壁灵芝孢子粉体外抗肿瘤活性研究.菌物学报,2013,32(1):114-127.
[16]黄碧芳,朱鸿萍,李彩斌,等.虎奶菇菌丝体自溶蛋白质制备方法比较.中国食用菌,2010,29(1):52-54.
[17]王爽,姜兰香,张宇,等.真菌胞内蛋白质提取方法的建立.吉林大学学报(医学版),2012,38(3):590-594.
[18]翁瑜,曾群力,姜槐,等.双向凝胶电泳比较三种常用蛋白质提取方法.中国生物化学与分子生物学报,2005,21(5):691-694.