植物乳杆菌增殖培养及其浓缩型冻干发酵剂的制备*
吴满刚,庄涛,王小兰,吴雪燕,陈洋洋,于海,葛庆丰,汪志君
(扬州大学食品科学与工程学院,江苏扬州,225127)
真空冷冻干燥法制备冻干发酵剂是将需要保藏的微生物细胞悬浮液冻结后,在真空条件下使冰升华,最终达到干燥的目的[1]。此方法主要是根据微生物生理、生化特点,干燥后微生物的代谢缓慢、生长繁殖受到抑制,达到休眠状态,从而保持菌株原有特性。冻干发酵剂主要优点是:活菌含量高、保藏期长、发酵性能稳定、易于运输等,在西方发达国家已得到广泛应用[2]。冻干发酵剂的制备工艺大致可分为3步:增殖培养、收集浓缩和冷冻干燥[3]。
现有报道[4]发酵香肠中的乳酸菌以弯曲乳杆菌、植物乳杆菌、清酒乳杆菌和短小乳杆菌为主。Stahnke[5]报道,植物乳杆菌大多情况下为优势菌,少数情况下清酒乳杆菌占优势,乳酸菌生长不一致可能与香肠配方和发酵条件不同有关。戊糖片球菌、清酒乳杆菌最能适应发酵香肠的制作环境,短小乳杆菌不能适应特定的环境,后期生长较慢,植物乳杆菌最适宜作为乳酸菌发酵剂用于香肠生产。本试验以植物乳杆菌为目标菌株,通过增殖培养,再浓缩收集后筛选冻干保护剂,从而最大限度地提高菌体存活率,旨在为研制高效冻干发酵剂提供依据。
1 材料和方法
1.1 材料和设备
1.1.1 主要材料
脱脂乳、番茄、胡萝卜、平菇,均为市售优质产品。
浓H2SO2、硼酸、甲基红、溴甲酚绿、碘化汞、硫酸铵、磺基水杨酸等均为分析纯;酵母膏、牛肉膏、蛋白胨、葡萄糖等均为生化试剂。
菌种:L2植物乳杆菌(Lactobacillus plantarum)。
1.1.2 培养基
(1)MRS 液体培养基[6]。
(2)脱脂乳培养基:脱脂奶粉加蒸馏水制成浓度为14%的脱脂乳液,115℃,灭菌10 min,冷却后使用。
(3)各种增殖培养基:在MRS液体培养基基础上添加不同生长因子。
番茄汁:新鲜番茄→清洗→热烫(90~95℃,3~5 min)→榨汁→过滤→定容(500 g制成1 L番茄汁)→调pH 6.4→过滤除菌备用。
玉米汁:玉米粉→称重→加水煮沸10 min→过滤→定容(500 g制成1 L玉米汁)→调pH 6.4→过滤除菌备用。
胡萝卜汁:新鲜胡萝卜→洗净→去皮及根梢→称重→切片→加水煮沸10 min→榨汁→过滤→定容(500 g制成1 L胡萝卜汁)→调pH 6.4→过滤除菌备用。
平菇汁:新鲜平菇→洗净→去根→称重→切片→加水煮沸10 min→榨汁→过滤→定容(500 g制成1 L平菇汁)→调pH 6.4→过滤除菌备用[7-8]。
1.1.3 仪器和设备
EPS300电泳仪,上海UNICO公司;高速冷冻离心机:5804R,北京艾泽信科技有限公司;KDN-04A蛋白质测定仪,上海贝特仪电设备厂;WFJ2000分光光度计,尤尼柯(上海)仪器有限公司;75 μm Car/PDMS复合式萃取头,美国Supelco公司;Trace气相色谱-质谱联用仪(GC-MS),美国Finnigan公司;755S紫外-可见分光光度计,上海棱光技术有限公司。
1.2 实验方法
1.2.1 菌种的活化
将植物乳杆菌活化2次,以3%接种量将活化液接入装有100 mL MRS液体培养基的250 mL三角瓶中,35℃摇床培养24 h备用。
1.2.2 植物乳杆菌增殖因子的单因素试验
获得乳酸菌大量生长的培养基是制备浓缩型冻干发酵剂的前提,乳酸菌发酵剂的理论活菌数要求在109~1010CFU/mL,乳酸菌在MRS液体培养基上的活菌浓度并未达到理想水平,所以还必须在基础培养基上进行营养强化,以便获取较高的菌体生物量[9]。
针对乳酸菌生长的营养需求,在基础培养基配方上添加不同的增殖因子,将MRS液体培养基活化过的植物乳杆菌按3%接种于添加增殖因子的培养基中,培养24 h后测定活菌数。初步筛选出番茄汁(8%)、胡萝卜汁(8%)、香菇汁(8%)、玉米汁(8%)、CaCO3(0.5%)、卵磷脂(1%)、大豆低聚糖(1%)、甘露糖(1%)等进行单因素实验,选择增菌效果较为显著的增殖因子进行下一步实验。
1.2.3 植物乳杆菌增殖因子的正交试验
在MRS液体培养基中添加初步筛选出的对植物乳杆菌增殖作用明显的增殖因子,采用L9(34)正交试验设计配制培养基,通过分析正交试验结果,确定各成分的最佳浓度,获得优化增菌培养基配方。菌株经过活化后,以3%接种量分别接种于上述增菌培养基中,35℃恒温培养24 h,检测培养后的活菌数。
1.2.4 菌体细胞浓缩分离条件的选择
参照山丽杰[10]的方法,计算离心损失率、存活率和收得率,每组实验做3个平行,统计分析并检验处理组之间差异显著性,从而选择最佳的离心参数。


由(1)、(2)、(3)式得出:
离心收得率/%=离心存活率/% ×(1-离心损失率/%)
1.2.5 菌体悬浮液浓度及冻干厚度的选择
参照邓鹏超[11]方法选择最佳浓度的悬浮基质以及最佳冻干厚度。
1.2.6 冻干时间和含水量的关系研究
在无菌操作条件下,将冻干菌粉转移到无菌恒重的小培养皿中,精确称重,然后将样品置于105℃烘干至恒重,计算冻干菌粉的含水量:

1.2.7 冻干保护剂及其复合配方的优化筛选
将植物乳杆菌活化2次,以3%接种量接入增殖培养基中,35℃培养24 h,离心收集菌体,将菌体悬浮于等体积的10%脱脂乳中,混匀,计数。将不同保护剂配成一定浓度的溶液,分别取1 mL脱脂乳的菌悬液和1 mL冻干保护剂到冻干瓶中(厚度为0.5 cm),真空冷冻干燥,冻干后加入1 mL无菌水复溶,稀释涂布,计算活菌数,分别选取海藻糖、蔗糖、麦芽糖、乳糖、明胶、L-谷氨酸钠、半胱氨酸、抗坏血酸、甘油、山梨醇、蛋白胨等保护剂进行单因素多水平实验[14],筛选出冻干保护效果好的单个保护剂,进一步研究保护剂的复配效果。
保护剂的复配试验:先配制10%脱脂乳,每10 mL体积分装试管,分别将初筛出的4种保护剂加入脱脂乳中,配制成不同浓度组合的复合保护剂,混匀,等量溶解离心后的菌体,充分混匀,按2 mL(冻干厚度0.5 cm)的量加入冻干瓶中,进行真空冷冻干燥。
1.2.8 植物乳杆菌冻干存活率的计算
按照熊泽[6]的方法对冻干菌粉复水处理,再参照韩德权[15]方法计算冻干存活率:

式中:C1为冻干前1 mL菌液的活菌数,CFU/mL;C2为冻干后1 mL复水菌液的活菌数,CFU/mL。
1.2.9 浓缩型冻干菌粉成品特性研究
将增殖培养液4 000 r/min离心10 min收获菌体,用生理盐水洗涤,重复2次,加入原菌液体积1/10的复合保护剂(浓缩倍数按实际需要而定),混合均匀,以2 mL分装冻干瓶中,预冻,真空冷冻干燥36 h,得浓缩型冻干菌粉,4℃保藏。精确称取1.000 0 g冻干菌粉,溶于10 mL无菌生理盐水中,取1 mL稀释平板计数,从而换算出1 g冻干菌粉的含菌量。
2 结果与分析
2.1 植物乳杆菌增殖因子的单因素试验
根据植物乳杆菌的营养需要,在MRS液体培养基的基础上,添加各增殖因子后,35℃培养24 h,测定菌液的活菌数,单因素试验结果见图1。
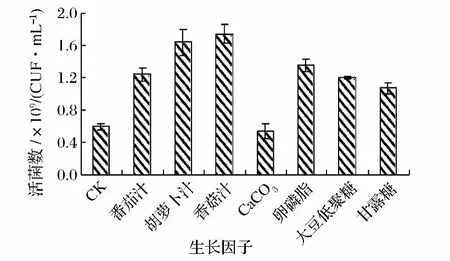
图1 不同生长因子对菌体增殖的影响Fig.1 Effect of different growth factors on the cell growth
由图1可以看出,在基础培养基中添加生长因子能提高植物乳杆菌活菌数(CaCO3除外)。由LSD均值多重比较分析可得,添加CaCO3的实验组活菌数与CK组相比无显著性差异(P>0.05)。但有报道认为菌体在富钙培养基中能够增强其抗冻性[16-17],因此选择CaCO3作为增菌盐类,其余实验组与CK组相比活菌数增加显著(P<0.05)。添加胡萝卜汁和香菇汁的实验组增菌效果显著大于(P<0.05)其他实验组,这是由于香菇汁中含有大量的真菌多糖及丰富的维生素,胡萝卜汁中含有大量的维生素、胡萝卜素和矿物质离子,能很好地满足植物乳杆菌的生长。但添加胡萝卜汁和香菇汁的两组处理组之间差异不显著(P>0.05),考虑到香菇汁成本相对较高,所以选择胡萝卜汁为增菌因子。其次,番茄汁实验组增菌效果和卵磷脂、大豆低聚糖、甘露糖实验组均无显著性差异(P>0.05),考虑材料价格和来源故选择番茄汁。综合考虑最终选择胡萝卜汁、番茄汁和CaCO3进行下一步实验。
2.2 乳酸菌增殖因子的正交试验
通过上述的单因素试验,选用胡萝卜汁、番茄汁和CaCO3为试验因素,设计L9(34)正交试验,以获得培养基最佳配方,其因素及水平如表1所示。

表1 增菌培养基各物质的正交因素水平表L9(34)Table 1 Factors and levels of L9(34)orthogonal experiment
按照表1设计的增菌因子的正交因素水平表进行L9(34)正交分析实验,吸取0.2 mL活化后的菌液涂布在添加增殖因子的培养基中,35℃培养48 h,计数,试验重复3次,取平均数,结果如表2。方差分析结果见表3。

表2 增菌培养基的L9(34)正交分析实验结果Table 2 Results of L9(34)orthogonal experiment

表3 方差分析表Table 3 Test of analysis of variance
从表2看出,以活菌数为直观分析指标,通过比较R值,各因素对目标值影响顺序为A>C>B。表3显示,A因素水平的不同对活菌数有显著性影响(P<0.05),B和C因素水平的不同对活菌数无显著性影响(P>0.05)。因此,从表2中选择平均数大的最佳水平 A2、B2、C3组合成最优组合 A2B2C3,与实验组最佳吻合,即胡萝卜汁(8%)、番茄汁(8%)和CaCO3(0.75%),活菌数为2.68×109CFU/mL。
2.3 菌体细胞浓缩分离条件的选择
为了得到较高的含菌量,通过离心浓缩使菌体与代谢产物分开,形成适于冷冻干燥的悬浮液,从而提高冷冻干燥存活率。在离心分离过程中[18],一方面,离心力机械作用以及温度和基质pH值等因素的影响,会造成部分菌体死亡;另一方面,部分菌体必然残留在上清液中造成损失。若离心工艺掌握不当,将直接导致发酵剂的活菌含量下降。为此,本实验研究离心力、离心时间对菌体存活率的影响,其结果如表4。
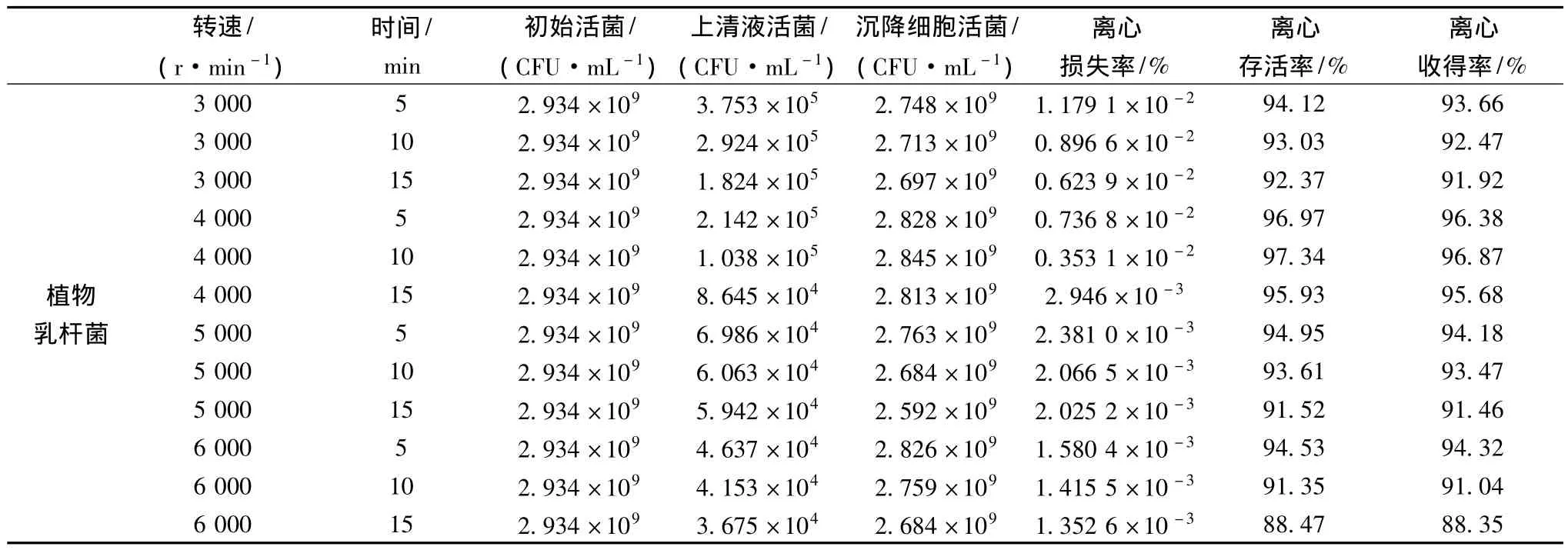
表4 不同离心条件对植物乳杆菌离心收得率的影响Table 4 Effect of different centrifugal conditions on harvesting rate of L.plantarum
表4结果表明,随着转数的增加和时间的延长,离心损失率总体呈现减小的趋势,离心损失率最大的是3 000 r/min离心5 min,损失率最小的是6 000 r/min,15 min。这表明离心力越小、离心时间越短,损失率越高;增大离心力和延长离心时间,均可显著降低损失率。由离心存活率可见,6 000 r/min,15 min离心存活率最低,离心存活率最高的是4 000 r/min,10 min。离心收得率是衡量离心效果的最终体现,它与离心存活率成正比,而与离心损失率成反比。从经济角度出发,尽量选取较小离心力和较短离心时间,离心收得率最高的是4 000r/min,10 min。
2.4 菌体悬浮基质和冻干厚度的选择
脱脂乳属于大分子蛋白质类,方便易得,是广泛使用的菌体悬浮基质,对菌体起到冻干保护作用。冻干发酵剂物料层厚度(即冻干厚度)也会影响冻干时间和冻干效果[19]。将增殖培养后的菌液按最佳离心参数离心收集菌体,添加等量的不同浓度(8%、10%、12%、14%)的脱脂乳作为菌体悬浮基质且分装成不同厚度的冻干瓶,真空冷冻干燥后,测其冻干存活率,选择最佳悬浮基质的浓度和冻干厚度,每组实验做3个平行,取平均值,结果如表5所示。

表5 脱脂乳的不同浓度和冻干厚度对菌体冻干存活率的影响Table 5 Effect on livability of cell by different consistency and thickness of skim milk after freezing-drying
从表5可知,添加脱脂乳基础保护剂与无菌水的对照组相比,脱脂乳浓度的不同对菌体冻干存活率有极显著性影响(P<0.01),冻干厚度的不同对菌体冻干存活率无显著性影响(P>0.05),不加脱脂乳的无菌水对照组的菌体存活率仅为20%以内,绝大多数菌体在冻干过程中死亡,而添加脱脂乳保护剂的冻干存活率最低为36.728%,最高达到56.173%,保护效果明显,通过LSD均值多重比较分析可得,脱脂乳浓度为8%、10%、12%、14%的实验组冻干存活率与对照组均有极显著性差异(P<0.01),脱脂乳浓度为10%的实验组冻干存活率与8%和12%的实验组有显著性差异(P<0.05),而脱脂乳浓度为12%和14%的实验组冻干存活率之间差异不显著(P>0.05),综合分析得出,保护效果最好的脱脂乳浓度为10%,其次为12%的浓度,最差为14%的浓度,分析原因可能是14%的脱脂乳浓度较大,固形物较多,溶液相对较黏稠,冻干过程中不利于水分的挥发,导致较多冰晶的形成,从而增大菌体的死亡率。从冻干厚度来看,10%和12%脱脂乳浓度的不同冻干厚度中,均为0.5 cm的厚度冻干存活率最高,而且通过直观观察,相同的冻干时间,冻干厚度为0.25 cm的冻干菌粉空隙较大,结构疏松,黏壁严重,冻干厚度为0.75 cm的冻干菌粉较为湿润,冻干不完全。所以初步选择0.5 cm进行下一步冻干时间的研究。
2.5 冻干时间和含水量的关系研究
冻干时间和含水量的关系见表6。

表6 不同冻干阶段的菌粉含水量Table 6 The moisture content of powder of different stages of freeze-dried
利用真空冷冻干燥技术生产活菌制剂有利于菌种的保藏。研究表明,冻干发酵剂的含水量为1.5%~3.0%为宜[20]。如果含水量>3.0%,发酵剂贮藏稳定性降低;而含水量<1.5%,细胞的冻干死亡率提高[21]。因此,保证冻干发酵剂的含水量,必须严格掌握真空干燥时间。如表6所示,菌粉冻干前32 h含水量显著性降低(P<0.05),冻干处理36 h后,含水量降到3%以下,随后下降趋势变缓,所以在本实验室冻干设备条件下,冻干处理时间选定为36 h左右。
2.6 冻干保护剂及其复合配方的优化筛选
冷冻和干燥两个过程会造成部分微生物细胞的损伤、死亡及某些酶蛋白分子的钝化[22]。冻干保护剂是影响冻干发酵剂活力最重要的外部因素,也是采用冻干法制备高效浓缩发酵剂研究的技术关键。选择海藻糖、蔗糖、麦芽糊精、明胶、谷氨酸钠、抗坏血酸、甘油、山梨醇等食品级生化材料作为单因子保护剂,采用质量分数为10%脱脂乳为悬浮基质进行单因素实验,每组做3个平行,取平均值,结果如表7所示。
由表7中冻干后活菌数的相关数据进行方差分析得,各种保护剂对冻干后活菌数应有显著性差别,糖类物质对菌体冻干保护效果最佳,其中10%海藻糖实验组冻干后活菌数显著高于(P<0.05)其他实验组,存活率达66.67%,从动力学角度看,海藻糖能有效促进非晶形或玻璃状固体形成[23],从而减少冰晶的形成,起到防止细胞损伤的作用,海藻糖通过氢键与脂质双分子层的脂类或蛋白质表面的水分子相连,降低了脂类由液晶向凝胶相转移的温度,从而起到保护作用,其次为麦芽糖,存活率为63.17%,谷氨酸钠处理组的存活率也较高为61.32%,而半胱氨酸、甘油以及抗坏血酸实验组与CK组之间无显著性差异(P>0.05),对菌体的冻干保护效果不佳。

表7 冻干保护剂的单因素实验结果Table 7 Results of different cryoprotectant factors
不同的保护剂对不同菌种的保护效果不同,单一的保护剂并不能满足冷冻干燥的要求,所以抗冻保护剂一般都是按一定配方混合使用。复配保护剂中的各种成分在冷冻干燥中均发挥着各自的作用,相互间又具有协同效应,同时微生物细胞结构和大小存在差异性,只有复配保护剂中各保护剂的比例及浓度达到协调时,才能达到最佳的保护效果。在上述单因素保护剂的研究基础上选用海藻糖(A)、麦芽糖(B)、谷氨酸钠(C)进行优化,设计L9(34)正交试验,其因素及水平如表8。以10%脱脂乳作为菌体悬浮基质,在这基础上添加各种浓度的保护剂,测定冻干前后的活菌数,每组实验做3个平行,计算菌体冻干存活率,结果见表9。方差分析结果见表10。

表8 复合冻干保护剂的正交因素水平Table 8 Factors and levels of L9(34)orthogonal experiment

表9 复合冻干保护剂正交分析实验结果(L934)Table 9 Results of L9(34)orthogonal experiment in cryoprotectant

表10 方差分析表Table 10 Test of analysis of variance
从表9的实验数据和分析结果可以看出,以冻干后菌体存活率为测试指标,通过比较R值大小,各因素对目标值影响大小顺序为A>B>C。表10方差分析结果表明,A和B因素水平的不同,其冻干存活率差异显著(P<0.05),因此选择平均数大的最佳水平A2和B2。但C(谷氨酸钠)因素水平不同,其冻干存活率差异不显著(P>0.05),综合考虑节约成本,C(谷氨酸钠)选择浓度最低的水平即8%。则最优组合为A2B2C1,该组合在试验方案中不存在,因此,将最优水平A2B2C1与试验方案中冻干存活率最高的第6号试验的水平组合A2B3C1进行验证试验,结果见表11。

表11 两种组合保护剂对冷冻干燥的保护效果Table 11 The protective effects of two combinations of protective agent for freeze-drying
由表11可以看出,A2B3C1组合的保护剂用于植物乳杆菌冷冻干燥,活菌数为3.71×109CFU/mL,菌体存活率达到75.43%,综合得到保护剂的最佳组合为:海藻糖(10%)、麦芽糖(12%)、谷氨酸钠(8%)。
2.7 浓缩型冻干菌粉成品特性研究
对最终冻干菌粉成品进行分析,1 mL复水菌液的活菌数为5.93×1010CFU/mL,则10 mL菌液的活菌数为5.93×1011CFU/mL,因为1 g冻干粉溶解于10 mL无菌水中,即冻干菌粉成品浓度为5.93×1011CFU/g。
3 结论
本实验以植物乳杆菌为发酵菌株,优化出植物乳杆菌增殖培养基的组成为:在MRS液体培养基的基础上添加8%胡萝卜汁、8%番茄汁、0.75%CaCO3,在此增殖培养基上活菌数能达2.68×109CFU/mL以上。采用离心法收集菌体,研究离心条件对菌体收得率的影响,主要考虑离心力和离心时间这2个因素,对离心前菌悬液、离心后上清液以及离心后菌体进行菌落计数,最终得出菌体最佳收集条件为4 000 r/min离心10 min。选用脱脂乳做为菌体悬浮基质可有效提高冻干存活率,研究脱脂乳浓度以及冻干厚度2个因素对冻干存活率的影响,结果表明,脱脂乳最佳浓度为10%,最佳冻干厚度为0.5 cm,且菌体冻干36 h后,其水分含量可满足储藏要求。本实验通过单因子筛选和正交实验优化,最终得到复合冻干保护剂为:海藻糖(10%)、麦芽糖(12%)、谷氨酸钠(8%),活菌数为3.71×109CFU/mL,冻干存活率可达75.43%。浓缩10倍冻干成品浓度为5.93×1011CFU/g。本研究探索了发酵肉制品冻干发酵剂的制备条件,提高了菌体冻干存活率,为冻干肉品发酵剂在我国的推广应用提供了理论基础。
[1] Carvalho A S,Silva J,Ho P,et al.Relevant factors for the preparation of freeze-dried lactic acid bacteria[J].International Dairy,2004,14(10):835-847.
[2] Wang Y C,Yu R C,Chou C C.Viability of lactic acid bacteria and bifidobacteria in fermented soymilk after drying,subsequent rehydration and storage[J].International Journal of Food Microbiology,2004,93(2):209-217.
[3] 山丽杰,田洪涛,贾英民,等.浓缩型乳酸菌发酵剂制备中几个技术关键问题的探讨[J].中国乳品工业,2002,30(5):66-69.
[4] 王永霞.肉品发酵剂的菌种筛选及在香肠发酵中的应用[D].北京:中国农业大学,2004:11-13.
[5] Stahnke L H,Holck A,Jensen A.Maturity Acceleration of Italian Dried sausage by Staphylococcus carnosus-Relationship between Maturity and Flavor Compounds[J].Journal of Food Science,2002,67(5):1 914-1 921.
[6] 熊泽,仇敏,邵伟,等.瑞士乳杆菌冻干发酵剂制备中保护剂的选择[J].冷饮与速冻食品工业,2006,12(3):20-22.
[7] 吕加平,梁占东.乳酸菌增菌培养基的优化设计[J].中国乳品工业,1999,27(3):12-15.
[8] 李用芳,李学梅,单英芳,等.嗜热链球菌和乳杆菌最佳促生长剂的选择[J].食品与发酵工业,1998,24(3):50-52;65.
[9] 陈声明,吕琴.微生物冷冻干燥的抗性机理[J].微生物学通报,1996,23(4):236-238.
[10] 山丽杰.利用真空冷冻干燥技术制备高效浓缩型酸奶发酵剂的研究[D].保定:河北农业大学,2004:13.
[11] 邓鹏超.乳酸菌的高密度培养及酸奶冻干发酵剂的研究[D].武汉:华中农业大学,2008:20.
[12] 赵瑞香,李刚,于涛.嗜酸乳杆菌冷冻干燥过程中保护剂的选择[J].食品科学,2004,25(11):147-151.
[13] 田洪涛,贾英民.海藻糖在双歧杆菌冻干菌粉制备和保藏种生物保护作用的初探[J].河北农业大学学报,2000,23(2):62-65.
[14] 吕加平,骆承庠.乳酸菌发酵剂冻干保护剂筛选及应用的研究[J].东北农业大学学报,1998,29(4):371-379
[15] 韩德权,杨丽娟,孙庆申,等.响应面法优化植物乳杆菌冻干保护剂[J].食品科学,2010,31(5):219-224.
[16] Abraham A,de Antoni G L,Arion M C.Effect of calcium on the cryopreservation of lactobacillus in different freezing media[J].Cryobiology,1990,27(3):336-342.
[17] de Valdez G F,de Giori G S,Oliver G,et al.Comparative study of the efficiency of some additives in protecting lactic acid bacteria against freeze-drying [J].Cryobiology,1983,20(5):560-566.
[18] Carvalho A S,Silva J,Ho P,et a1.Relevant factors for the preparation of freeze-dried lactic acidbacteria[J].International Dairy Journal,2004,14(10):835-847.
[19] 徐成海,邹惠芬,张世伟.真空冷冻干燥技术的现状与发展趋势[J].真空与低温,2000,6(2):71-74.
[20] Sheu.T Y,Marshall R T,Heymann H,et al.Improving survival of culture bacteria in frozen desserts by microentrapment[J].Dairy Science,1993,76(7):1 902-1 907.
[21] 吕为群,骆承库,刘书臣.乳酸菌在冷冻干燥过程中存活率影响因素探讨[J].中国乳品工业,1993(5):217-220.
[22] Conrad P B,Miller D P,Cielenski P R,et al.Stabilization and preservation of Lactobacillus acidophilus in saccharide matrices[J].Cryobiology,2000,41(1):17-24.
[23] Scannell A G M,Schwarz G,Hill C,et al.Pre-inoeulation enrichment proeedure enhances the performance of baeteriocinogenic Lactococcus lactis meat starter culture[J].International Journal of Food Mierobiology,2001,64(1/2):151-159.

