海红果多糖水提醇沉工艺及其抑菌活性研究*
吴敬,王英丽,宝冠媛,郭海燕,李丽杰,王越男
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特,010018)
海红果,学名西府海棠(Malus micromalus Makino)又名海红、海红子、子母海棠、小果海棠,属于蔷薇科(Rosaceae)梨亚科(Pomoideae)苹果属[1-2],主要分布在我国的蒙晋陕三(区)省交界的黄土丘陵沟壑地区[3]。海红果营养丰富,除含有基本的营养成分外,还含有16种氨基酸,其中富含缬氨酸、亮氨酸、苯丙氨酸、赖氨酸及婴幼儿生长必要的组氨酸、精氨酸,且钙的含量居于水果之冠,素有“钙王”之美誉[3-4]。近年来市场上出现的以海红果为主要原料的保健制品,已被证明在补钙、补锌、促进大脑发育、软化血管、降低血脂有较好作用,有些地区甚至以海红代替山楂入药[3-4],这些都为其开发奠定了良好理论基础。
近些年,植物多糖的多种生物活性包括抗肿瘤、抗病毒、抗衰老、抗辐射、抗突变、降血糖、增强免疫等[6-7]已被证实。郝志鹏等研究表明海红果多糖(PFM)有较强的抗氧化能力[8]。为了进一步研究海红果多糖的功效,本文对海红果多糖的醇沉工艺进行研究,并探讨其对蜡样芽孢杆菌CGMCC1.1686、沙门氏菌、单核细胞增生李斯特氏菌的抑菌效果,以期为海红果的综合利用提供了理论依据。
1 材料与方法
1.1 试验材料与试剂
海红果:秋季摘果,洗净、阴干、粉碎后过60目筛,干燥贮存,备用;苯酚,葡萄糖,浓硫酸,无水乙醇,均为分析纯;营养肉汤培养基,YPD培养基,胰酪胨蛋白胨培养基,参照文献配制[9-10]。
蜡样芽孢杆菌(Bacillus cerecus CGMCC1.1686)、嗜热脂肪芽孢杆菌(Geobacillus stearothermophilus GMCC1.1923)、金黄色葡萄球菌(Staphylococcus aureus CMCC(B)26112)、藤黄微球菌(Micrococcus luteus CMCC(B)28001)、大 肠 杆 菌 (Escherichiacoli ATCC25922)、沙门氏菌(Salmonella typhimuniuns)、单核细胞增生李斯特氏菌(Listeria monocytogenes CMCC54002)、金黄色葡萄球菌(Staphylococcus aureus ATCC25923)、啤酒酵母(Saccharomyces cerevisiae)由内蒙古农业大学食品科学与工程学院实验室提供。
1.2 试验仪器与设备
T6-新锐可见分光光度计,美国惠普公司;AL204型电子分析天平(十万分之一),梅特勒-托利多仪器公司;TG-16-WS型台式高速离心机,湖南湘仪实验室仪器开发有限公司;HH.S 1-Ni型电热恒温水浴锅,北京长安科学仪器厂;DHG-9075A型真空干燥箱,上海-恒科学有限公司;LTI-601SD型恒温培养箱,东京理化器械株式会社;XC189-HY-08小型高速粉碎机,西化仪(北京)科技有限公司HY-08。
1.3 实验方法
1.3.1 水提醇沉法提取海红果多糖(PFM)
精确称取样品粉末1.00 g,加入10倍体积的无水乙醇浸泡24 h后,离心,滤渣加入一定体积的蒸馏水,回流提取2次,抽滤,合并滤液后再离心(10 000 r/min,15 min),加入95%的乙醇,使多糖液的含醇量为80%,在冰箱中醇沉12 h。将沉淀溶液在20℃下以10 000 r/min离心15 min,离心后弃上清液,沉淀再分别用无水乙醇和80%的乙醇洗涤2次,离心后弃去上清液,即得海红果粗多糖粗品,备用。
1.3.2 PFM提取的单因素和正交试验
利用回流提取技术,分别考察提取温度、料液比、提取时间及醇沉比对提取样品中多糖含量的影响。试验料液比选取 1∶10、1∶15、1∶20、1∶25、1∶30 五个水平,提取时间选取 30、60、90、120、150 min 五个水平,提取温度选取 75、80、85、90、95℃ 五个水平,醇沉浓度选取60%、70%、80%、90%、99.9%四个水平,分别进行单因素试验,重复3次。在单因素试验基础上,选出适宜的提取温度、提取时间、料液比和乙醇浓度进行正交试验。
1.3.3 PFM 含量测定
以葡萄糖为对照品,采用改良的苯酚-硫酸显色法测定总多糖含量[8,11]。
具体方法:精密吸取葡萄糖工作液(0.1 mg/mL)0.2,0.4,0.6,0.8,1.0 mL,各加蒸馏水至 2.0 mL,再加入5%苯酚溶液1.0 mL,摇匀,迅速滴加浓硫酸5.0 mL,混合摇匀,室温放置10 min,然后置沸水浴加热15 min,取出冷却至室温。在波长490 nm处测吸光度,空白对照是以蒸馏水代替葡萄糖溶液。以葡萄糖质量浓度为横坐标、吸光度为纵坐标制作标准曲线。葡萄糖标准曲线方程:y=0.1556x-0.0362(R2=0.9966)。根据标准曲线计算粗多糖含量:
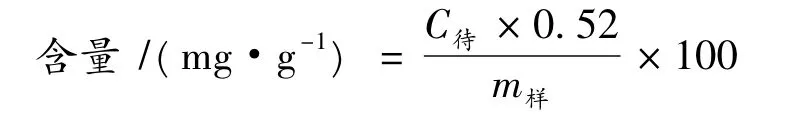
式中:C待为待测样的浓度,mg/mL;m样为待测样的质量,g。
1.3.4 PFM 的抑菌试验
(1)菌悬液的制备[12-14]:将实验细菌分别接种于营养肉汤液体液体培养基中,37℃培养箱中培养18~24 h后,以2%的接种量再活化1代,用0.85%无菌生理盐水梯度稀释,制成106CFU/mL菌悬液,冰箱4℃保存待用。
(2)抑菌试验:称取PFM 7.5 g,用无菌水配制成质量浓度为75 mg/mL的PFM溶液。将此多糖溶液分别稀释成 50、25、12.5、6.25、3.125 mg/mL 系列质量浓度溶液。
采用双层琼脂平板扩散法检测抑菌活性。即在灭菌平皿内倒入10 mL的灭菌水琼脂,使其铺满平板底部。待平板内培养基冷却凝固后,放入牛津杯;取含菌约106CFU/mL的指示菌悬液200 μL加入到软琼脂培养基中,混匀后倾注到灭菌的平皿内,待培养基凝固后,取出牛津杯,在孔中加200 μL海红果多糖溶液,室温扩散3~5 h,37℃培养18 h,同时以无菌水为阴性对照,每种质量浓度做3次重复。用游标卡尺测量抑菌圈的直径,读数精确至0.01 mm。判定标准抑菌环直径大于8.1 mm者判为有抑菌作用,抑菌环小于或等于8 mm者判为无抑菌作用[13]。阴性对照组应无抑菌环产生,否则试验无效。
2 结果与分析
2.1 海红果粗多糖回流提取的单因素试验结果
2.1.1 料液比对多糖提取的影响
在提取时间60 min,提取温度90℃的条件下,考察料液比为 1∶10、1∶15、1∶20、1∶25、1∶30 对多糖提取效果的影响,结果如图1。

图1 料液比对多糖提取效果的影响Fig.1 Effect of solid-to-liquid ratio on extraction yield of PFM
由图1可看出,在料液比1∶10~1∶30范围内,随着料液比的增加,多糖提取量明显上升,这是由于料液比越大,海红果细胞内外的多糖浓度差就越大,溶质的扩散动力增加,传质推动力大则利于多糖的浸出;当料液比达1∶25时,多糖已基本溶出,继续增加料液比,多糖含量增加不明显,且会增加杂质的浸出率,也会增加后续加工成本。综合考虑各方因素,提取以料液比1∶20 ~1∶30 为宜。
2.1.2 提取时间对多糖提取的影响
在料液比为1∶30,提取温度90℃的条件下,分别考察提取时间为30、60、90、120、150 min 对多糖提取效果的影响,结果如图2。
由图2可以看出,提取时间为30~90 min时,多糖提取量随时间延长而增大,但90 min后随着提取时间的延长而降低。这是因为随着提取时间的延长,部分多糖降解为单糖、寡糖或低聚糖,它们可溶于乙醇,在醇沉过程中有所损失,故提取率下降。因此,提取时间以30 min为宜。
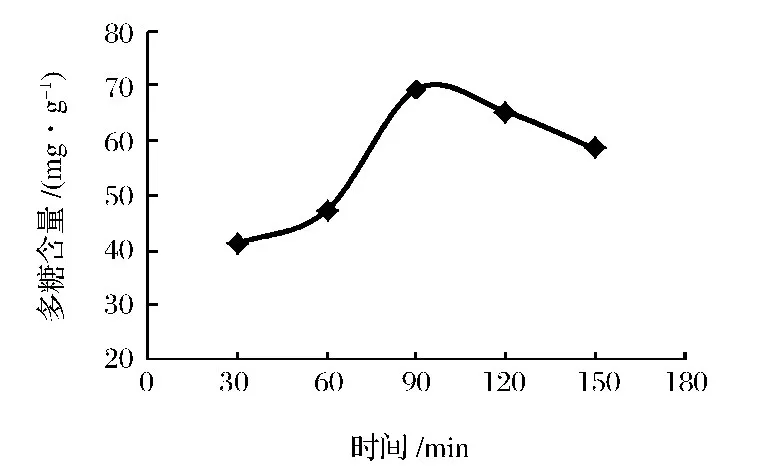
图2 提取时间对多糖提取效果的影响Fig.2 Effect of extraction time on extraction yield of PFM
2.1.3 提取温度对多糖提取的影响
在料液比为1∶30,提取30 min,分别考察温度为75、80、85、90、95 ℃ 对多糖提取效果的影响,结果如图3。

图3 提取温度对多糖提取效果的影响Fig.3 Effect of extraction temperature on extraction yield of PFM
由图3可以看出,温度是影响多糖提取的关键因素之一,在75~85℃,海红果多糖含量随温度的升高而增加。这是因为随着提取温度的升高,样液黏度降低,组织中的多糖向提取液中的传质速率增加,有利于组织中的多糖浸出。当温度高于85℃,海红果多糖含量开始下降,这是因为多糖的热稳定性下降,导致多糖分解。因此,将提取温度确定为80~90℃。
2.1.4 乙醇体积分数对多糖提取的影响
在提取次数为1次,料液比为1∶30,提取时间为30 min,提取温度为85℃的条件下,分别考察乙醇体积分数分别为60%、70%、80%、90%、99.9%对多糖提取效果的影响,结果如图4。
由图4可以看出,海红果多糖提取量随乙醇体积分数的增加而增加,在使用60%体积分数的乙醇沉淀时,多糖的得率相对较低;用70%体积分数的乙醇沉淀时,多糖的提取量有所提高;而用80%体积分数以上的乙醇沉淀时,样品中的多糖提取量显著增加。其原因可能是在低浓度乙醇沉淀时,沉淀下来的可能主要是高分子量的多糖;中等体积分数乙醇沉淀下来的可能是中等分子量的多糖[15]。综合考虑多种因素,选择最适乙醇体积分数为80% ~99.9%。

图4 乙醇体积分数对多糖提取的影响Fig.4 Effect of alcohol concentration on extraction yield of PFM
2.2 海红果多糖提取的正交试验结果与分析
根据上述单因素的试验结果进行正交试验,各因素水平的选取及结果见表1。

表1 海红果多糖的L9(34)正交试验结果Table 1 The results of the orthogonal experiment of PFM
根据极差分析法,由表1中的试验结果可知,本试验中4个影响因素(料液比,时间,温度,醇沉浓度)对多糖含量影响的顺序为:RA>RC>RB>RD,即A因素(料液比)为最重要的因素,其次为C因素(提取温度)和B因素(提取时间),D因素(乙醇浓度)影响最小。最优试验条件的组合是A2C3B2D1,即料液比1∶25,提取温度为90℃,提取时间60 min,乙醇体积分数80%。与单一影响因素相比,使用复合影响因素(A2C3B2D1)所得多糖的提取量较高。以正交试验所确定的最优水平组合做验证试验,PFM含量为105.15 mg/g。
2.3 海红果多糖抑菌试验结果
采用双层琼脂平板扩散法研究海红果多糖对B.cerecus CGMCC1.1686、Geobacillus stearothermophilus GMCC1.1923、S.aureus CMCC(B)26112、Micrococcus luteus CMCC(B)28001、E.coli ATCC25922)、Saccharomyces cerevisiae、L.monocytogenes CMCC54002、S.aureus ATCC25923八种试验菌的抑制效果,以抑菌圈直径的大小为衡量指标,试验结果见表2。
由表2可知,海红果多糖在浓度75 mg/mL和50 mg/mL 时对 B.cerecus CGMCC1.1686、Saccharomyces cerevisiae、L.monocytogenes CMCC54002 均有抑菌作用,在浓度25 mg/mL时仅对Saccharomyces cerevisiae、L.monocytogenes CMCC54002有抑菌性,而且,多糖浓度越小,抑菌效果越弱。除上述菌外,海红果多糖浓度在75 mg/mL以下时,均对Geobacillus stearothermophilus GMCC1.1923、S.aureus CMCC(B)26112、MicrococcusluteusCMCC(B)28001、 E. coli ATCC25922、S.aureus ATCC25923、Saccharomyces cerevisiae无抑菌作用。
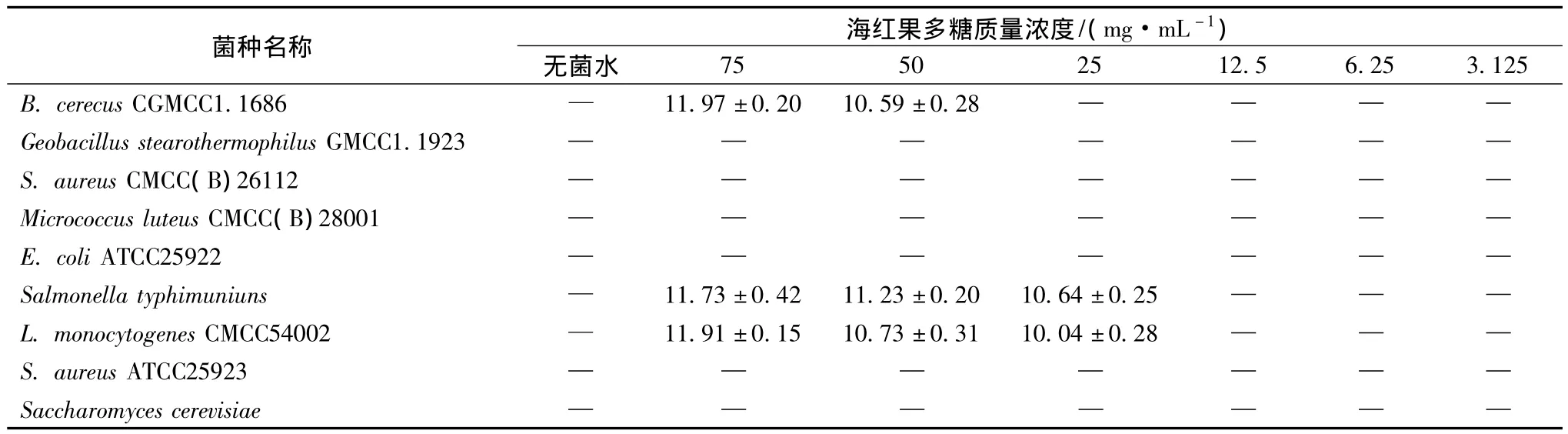
表2 海红果多糖抑菌结果Table 2 Antimicrobial results of PFM
3 结论
本实验通过3水平4因素正交试验,确定了提取海红果多糖的最佳工艺条件,即为:料液比1∶25(g∶mL),提取温度90℃,提取时间 60 min,乙醇浓度80%,在此条件下多糖含量105.15 mg/g。4个单因素对多糖含量的影响顺序为:料液比>提取温度>提取时间>乙醇浓度。
通过抑菌试验表明,海红果多糖仅对B.cerecus CGMCC1.1686、Salmonella typhimuniuns、L.monocytogenes CMCC54002有良好的抑菌作用,且对3株菌的最低抑菌质量浓度分别为50 mg/mL、25 mg/mL、25 mg/mL;对 Geobacillus stearothermophilus GMCC1.1923、S.aureus CMCC(B)26112、Micrococcus luteus CMCC(B)28001、E.coli ATCC25922、S.aureus ATCC25923、Saccharomyces cerevisiae无抑菌作用。其具体原因和作用机制需要在今后的研究中继续探索。
[1] 赵亮,李青山.紫外分光光度法测定海红果中总黄酮的含量[J].山西医科大学学报,2006(2):169-171.
[2] 王玮.海红果醋加工技术的研究[D].呼和浩特:内蒙古农业大学,2011:1.
[3] 吴彩萍,罗茂珍,等.偏关海红果[J].山西果树,2003(3):21-23.
[4] 王永熙,白与年.府谷海红子[J].果树科学,1995,12(增刊):153-154.
[5] 李尔春.天然植物多糖的结构及活性研究进展[J].食品与药品,2007,9(4):51-52.
[6] GANG Xiang,DAN Wang,ZOU Gui-Hua.Optimized Ultrasonic-Assisted Extraction of Polysaccharides from Chinese Traditional Medicinal Plant Paris fargesii Using Orthogonal Design[J].Journal of Applied Pharmaceutical Science,2013,3(5):110-113.
[7] 谢明勇,聂少平.天然产物活性多糖结构与功能研究进展[J].中国食品学报,2010,10(2):1-9.
[8] 郝志鹏,马丽杰,吴敬.海红果多糖提取工艺及体外抗氧化活性研究[J].食品科学,2012,33(18):88-92.
[9] 陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995:234.
[10] 沈萍,范秀容,李光武.微生物学实验[M].3版.北京:高等教育出版社,1999:49-97.
[11] 董群,郑丽伊,方积年.改良的苯酚-硫酸法测定多糖和寡糖含量的研究[J].中国药学杂志,1996,31(9):550-553.
[12] 刘安军,王玥玮,朱振元,等.核桃仁种皮多糖的提取及抑菌作用的研究[J].现代食品科技,2010,6(4):362-369.
[13] 吴敬.酸马奶中屎肠球菌MKB64细菌素特性及其相关基因的研究[D].内蒙古农业大学,2011:29.
[14] 张百刚,钟旭美,刘晓风.甘草多糖的提取及其抑菌试验的研究[J].粮油加工,2010(8):137-140.
[15] 金丽梅,刘伟,汤一哲.水提醇沉法玉米须多糖提取工艺研究[J].黑龙江八一农垦大学学报,2007,19(5):62-66.

