Ⅰ型跨膜蛋白α亚型缺失突变体对人牙周膜成纤维细胞周期的影响
李苹苹 罗俊 彭志庆 初颜兵 王燕
1.重庆医科大学附属口腔医院牙体牙髓科,重庆 400015;2.重庆医科大学附属永川医院口腔科,重庆 402160;3.第三军医大学附属西南医院口腔科,重庆 400038;4. 重庆医科大学附属口腔医院预防与儿童牙病科,重庆 400015
人牙周膜成纤维细胞(human periodontal ligament fibroblasts,hPDLFs)是牙周膜中主要的感受性和效应性细胞,其增殖活性直接反映了牙周组织的状态。牙周炎症或创伤时牙周膜再生细胞数量的减少及生物学功能的降低,阻碍了牙周组织的完全再生。目前国内外对通过使用药物、外源性生长因子、激素等促进hPDLFs增殖等方面的报道较多[1-3],但探讨内质网信号通路I型跨膜蛋白α亚型(type Ⅰtransmembrane protein,IRE1α)对该种细胞增殖情况影响的文献极少。
需肌醇酶IRE1α(type Ⅰ transmembrane protein kinase/endoribonuclease,IRE1/ERN1)是一种不规则的Ⅰ型跨膜蛋白。正常的生理情况下,IREIα氨基端和结合免疫球蛋白(immunoglobulin binding protein,Bip)结合处于无活性状态。当内质网腔中有未折叠蛋白或错误折叠蛋白蓄积时,Bip与IRElα分离,可诱导IRE1α的内质网腔的结构域发生二聚化,激活胞质的蛋白激酶域,进而发生自身磷酸化作用[4],进一步激活特定位点羧基末端具有核糖核酸内切酶活性的RNase结构域,从而剪切一种重要的转录因子X-盒结合蛋白1(X-box binding protein 1,XBP1),产生另外一种活性更高的形式,即剪接型XBP1(X-box binding protein 1 splicing,XBP1S)[5-6]。XBP1S与各种细胞的存活与凋亡密切相关。本实验构建了IRE1α的两个主要功能域的缺失突变体,并观察其对hPDLFs细胞增殖的影响,为牙周组织疾病病因和治疗的研究机理提供一定的理论基础。
1 材料和方法
1.1 分子生物学试剂和仪器
大肠杆菌DH5α和pcDNA3.1-空载体均由重庆医科大学生命科学院提供。重组质粒测序由华大基因公司提供服务。脂质体Lipofectamine 2000(Invitrogen公司,美国),抗体(Santa cruz公司,美国),酶标仪、凝胶成像分析仪(Bio-Rad公司,美国)。
1.2 方法
1.2.1 细胞培养 hPDLFs细胞株由重庆医科大学钟晓波教授惠赠。细胞用含10%胎牛血清的DMEM(Hyclone)培养基于37 ℃、5%CO2培养箱内常规培养。待细胞密度在80%时传代,选取5~8代的细胞进行实验。
1.2.2 IRE1α两个缺失体重组质粒的构建 以人pcDNA3.1-IRE1α[7]全长质粒为模板,采用重叠聚合酶链反应(overlapping polymerase chain reaction,Overlapping PCR)方法分别构建IRE1α两个缺失功能域Kinase(aa544-827)和Rnase(aa828-977)的突变体(pD-Kinase,pD-Rnase)。PCR1:pD-Kinase上游引物5’-GGAATTCCATGCCGGCCCGGC-3’,下游引物5’-CGGGTGTTTGTACGGGCCAGACGTG-3’;pD-Rnase上游引物5’-GGCCCGTACAAACACCCGTTCTTCTGG-3’,下游引物5’-CAAGCTTGGAGGGCGTCTGGAGTCAC -3’。PCR2:pD-Kinase上游引物5’-GGAATTCCATGCCGGCCCGGC-3’,下游引物5’-CAAGCTTGGAGGGCGTCTGGAGTCAC-3’;pDRnase上游引物5’-GGAATTCCATGCCGGCCCGGC-3’,下游引物5’-CAAGCTTGGAGCACATGCTTCGCTGAG-3’。
1.2.3 Western blot分析IRE1α及缺失体重组质粒的表达 hPDLFs细胞分别转染pcDNA3.1、pIRE1α及缺失体pD-Kinase、pD-Rnase,并设立未处理的阴性对照组(NC),24 h后收集细胞提取蛋白,Western blot检测IRE1α全长及缺失体D-Kinase、D-Rnase重组质粒在真核细胞中的表达。
1.2.4 流式细胞仪检测IRE1α及缺失体对hPDLFs细胞周期的影响 取对数生长期hPDLFs细胞接种于6孔板,待细胞融合率达60%~80%时分别转染pcDNA3.1、IRE1α全长及缺失体D-Kinase、D-Rnase重组质粒,每个实验组设2个复孔。24 h后采用终质量浓度为5 μg·mL-1衣霉素(tunicamycin,TM)处理24 h,并设立未处理组(NC)作为阴性对照组,收集各组细胞,在用1 mL预冷70%乙醇溶液4 ℃固定18~24 h后,加入等体积的50 mg·L-1碘化丙啶(propidine iodide,PI)染液染色,采用流式细胞仪(flow cytometry,FCM)标准程序进行细胞周期分析。实验重复3次。
1.3 统计学分析
采用SPSS 10.0软件对多组数据间比较采用单因素方差分析,2组间差异比较用成组t检验,P<0.05为差异有统计学意义。
2 结果
2.1 IRE1α及两个缺失体重组质粒的构建和鉴定
将扩增得到的IRE1α全长重组质粒和本实验构建的两个缺失突变体(pD-Kinase、pD-Rnase)经XhoⅠ和HindⅢ酶切鉴定,分别得到约2 944、2 008和2 497bp的外源DNA插入片段(图1),说明克隆成功,送华大基因公司测序。重组质粒序列测定结果经NTI软件比对证明,IRE1α全长重组质粒和两个缺失突变体编码区序列与目的基因序列完全一致,说明各重组质粒构建正确。
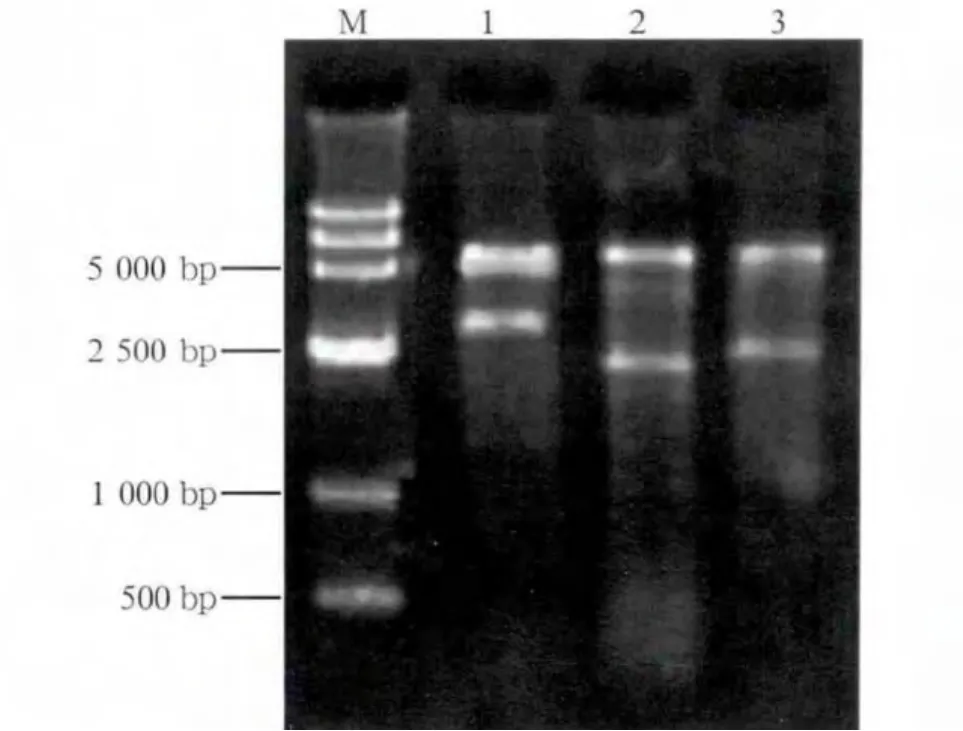
图1 IRE1α基因全长及两个缺失突变体重组质粒XhoⅠ和HindⅢ双酶切琼脂糖电泳图Fig 1 The agarose electropherogram ofiRE1α full-length and two recombinant plasmids digested with XhoⅠand Hind Ⅲ
2.2 IRE1α全长与缺失突变重组质粒在hPDLFs细胞中的表达
Western blot检测结果显示,瞬时转染的IRE1α全长及两个缺失突变体的重组质粒(pD-Kinase、pD-Rnase)均可以在hPDLFs细胞内正确表达(图2),其中转染组有少量内源性IRE1α,可能原因是脂质体转染处理引起的轻微内质网应激(endoplasmic reticulum stress,ERS)环境。
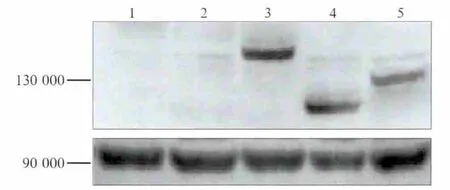
图2 Western blot检测IRE1α全长及两个缺失体重组质粒在hPDLFs细胞中的表达Fig 2 The expression ofiRE1α full-length and two recombinant plasmids in hPDLFs cells by Western blot analysis
2.3 FCM检测IRE1α全长及缺失体重组质粒对hPDLFs细胞周期的影响
FCM检测结果显示,在TM刺激诱导ERS条件下,对照组、IRE1α全长及缺失体D-Kinase、D-Rnase重组质粒48 h后,处于S期的hPDLFs细胞分别为27.05%、39.23%、23.39%、14.45%。IRE1α实验组S期细胞比例明显增多(P<0.05),而G1期细胞比例(42.15%)低于TM组(60.72%)(P<0.05)。D-Kinase突变体组G1期细胞比例(66.19%)与TM组比较差异无统计学意义(P>0.05)(图3)。
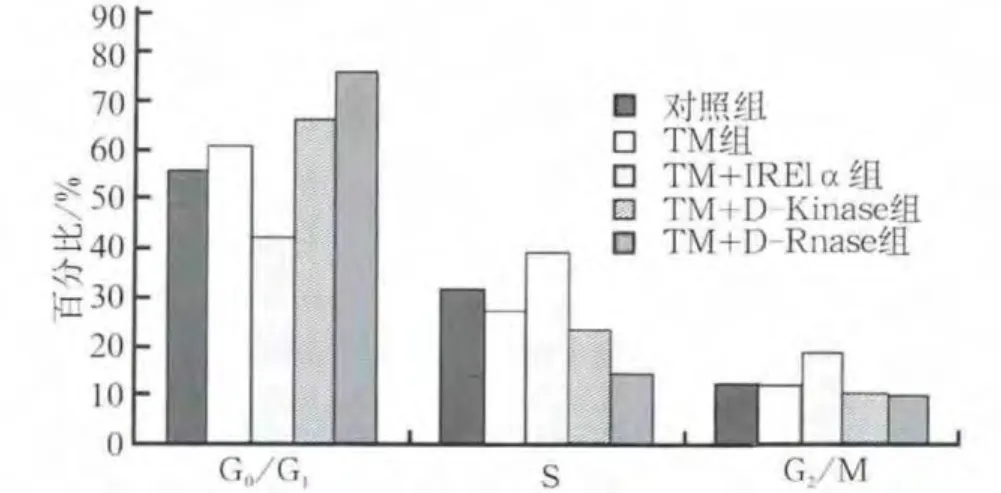
图3 IRE1α全长及两个缺失体重组质粒对hPDLFs细胞周期的分析Fig 3 Analysis of the cell growth of hPDLFs after transfected with IRE1α full-length and two recombinant plasmids
3 讨论
近年来,一些研究[8-9]表明ERS与慢性牙周炎的形成和进展有关。因此在ERS引起牙周炎的机制中,如果人工处理某一环节使诱导牙周炎的机制中断,则可望控制疾病的发展。本实验通过IRE1α两个主要功能域Kinase和Rnase的缺失突变体对细胞增殖周期的研究,探讨IRE1α对hPDLFs作用的功能区域,为治疗牙周疾病提供一条新途径。
ERS激活的一系列信号通路统称为折叠蛋白反应,其3个分支(IRE1,PERK,ATF6)促进细胞的存活,减少错误折叠的蛋白水平。IRE1有IRE1α和IRE1β两个同源体,IRE1α是目前研究最多的一条通路,在体内广泛存在。IRE1α包含N端的可以感受内质网腔的异常蛋白刺激的跨膜结构域、C端的具有激酶活性的Kinase结构域及核酸内切酶活性的Rnase结构域[10]。多项研究已证实IRE1α在未折叠蛋白积聚引起的ERS条件下对细胞的生存起到关键作用,对细胞在折叠蛋白反应中存活起决定性作用[11],对胎盘的发育和胚胎的生长是必不可少的[12]。Drogat等[13]研究发现,IRE1信号通路在对局部缺血的反应中起关键作用,认为这个蛋白有利于血管生成和肿瘤的生长。
TM刺激hPDLFs细胞后,通过FCM法检测ERS条件下IRE1α及两个功能域的缺失突变体重组质粒对hPDLFs细胞的各周期比率,结果显示,IRE1α实验组hPDLFs细胞处于S期的比例高于TM对照组(P<0.05),G1期细胞比例低于TM组(P<0.05),表明IRE1α可在ERS状态下促进hPDLFS细胞从G1期进入S期,加速细胞周期的进程,从而促进细胞的增殖。而D-Rnase突变体组,hPDLFs细胞处于S期的比例低于TM对照组(P<0.05),G1期细胞比例高于TM组(P<0.05),表明缺失Rnase功能域的IRE1α(DRnase突变体)在ERS状态下干扰hPDLFS细胞周期分布,导致hPDLFS细胞生长阻滞于G1期,延长细胞周期的进程,从而抑制细胞的增殖。D-Kinase突变体组对hPDLFs细胞的各周期与TM对照组相比无显著差异(P>0.05)。
IRE1α缺失突变体分析表明,IRE1α具有激酶(Kinase)和核糖核酸酶(Rnase)活性的两个结构域部分重叠[14]。本实验构建的缺失突变D-Kinase缺少Kinase功能域,使得IRE1α在TM刺激下没有激酶活性,不能有效地发挥自身磷酸化作用,从而也就不能有效地发挥其生物学特性,对细胞增殖无明显影响;而缺失突变体D-Rnase缺少Rnase功能域,使得IRE1α在TM刺激下不能有效地对XBP1进行剪切。这也许是由于Rnase功能域与IRE1α其他结构域间的相互作用或是与其他蛋白之间还有目前未被发现的共同调节细胞生长的生物学功能。这些都还有待于进一步的实验验证。通过本文的实验可以猜测:通过增进Rnase功能域结构稳定或许可以促进IRE1α的表达,提高hPDLFs细胞增殖率,从而达到减少牙周损伤治疗牙周疾病的目的。
[1]黄美香, 闫福华, 姚丽艳, 等. 环孢素A联合脂多糖对牙周膜成纤维细胞增殖的影响[J]. 中华口腔医学研究杂志:电子版, 2011, 5(5):11-15.
[2]Kreisler M, Christoffers AB, Willershausen B, et al. Effect of low-level GaAlAs laser irradiation on the proliferation rate of human periodontal ligament fibroblasts: anin vitrostudy[J]. J Clin Periodontol, 2003, 30(4):353-358.
[3]Emecen P, Akman AC, Hakki SS, et al. ABM/P-15 modulates proliferation and mRNA synthesis of growth factors of periodontal ligament cells[J]. Acta Odontol Scand, 2009,67(2):65-73.
[4]Yoshida H. Unconventional splicing of XBP-1 mRNA in the unfolded protein response[J]. Antioxid Redox Signal,2007, 9(12):2323-2333.
[5]Gomez BP, Riggins RB, Shajahan AN, et al. Human X-box binding protein-1 confers both estrogen independence and antiestrogen resistance in breast cancer cell lines[J]. FASEB J, 2007, 21(14):4013-4027.
[6]Yoshida H, Nadanaka S, Sato R, et al. XBP1 is critical to protect cells from endoplasmic reticulum stress: evidence from Site-2 protease-deficient Chinese hamster ovary cells[J].Cell Struct Funct, 2006, 31(2):117-125.
[7]Nagai A, Kadowaki H, Maruyama T, et al. USP14 inhibits ER-associated degradation via interaction with IRE1alpha[J].Biochem Biophys Res Commun, 2009, 379(4):995-1000.[8]Domon H, Takahashi N, Honda T, et al. Up-regulation of the endoplasmic reticulum stress-response in periodontal disease[J]. Clin Chim Acta, 2009, 401(1/2):134-140.
[9]聂敏, 何健民, 冯利, 等. 内质网应激诱导的细胞凋亡在慢性牙周炎中的作用初探[J]. 口腔医学研究, 2012, 28(2):152-154.
[10]Lee KP, Dey M, Neculai D, et al. Structure of the dual enzyme Ire1 reveals the basis for catalysis and regulation in nonconventional RNA splicing[J]. Cell, 2008, 132(1):89-100.
[11]Lin JH, Li H, Yasumura D, et al. IRE1 signaling affects cell fate during the unfolded protein response[J]. Science,2007, 318(5852):944-949.
[12]Iwawaki T, Akai R, Yamanaka S, et al. Function ofiRE1 alpha in the placenta is essential for placental development and embryonic viability[J]. Proc Natl Acad Sci U S A, 2009,106(39):16657-16662.
[13]Drogat B, Auguste P, Nguyen DT, et al. IRE1 signaling is essential for ischemia-induced vascular endothelial growth factor-A expression and contributes to angiogenesis and tumor growthin vivo[J]. Cancer Res, 2007, 67(14):6700-6707.
[14]Oikawa D, Kimata Y, Kohno K, et al. Activation of mammalian IRE1alpha upon ER stress depends on dissociation of BiP rather than on direct interaction with unfolded proteins[J]. Exp Cell Res, 2009, 315(15):2496-2504.

