两种牛乳κ-酪蛋白的间接ELISA定量检测研究
薛海燕,秦婧,宋宏新,韩芳,潘洁
(陕西科技大学 生命科学与工程学院,西安 710021)
0 引 言
牛乳κ-酪蛋白(κ-CN)占总酪蛋白的13%,仅由169个氨基酸组成[1],主要分布在在酪蛋白胶束外部,起稳定胶束作用[2],是牛乳保持乳浊液状态的重要因子。它还是凝乳酶的特异性底物,所以乳中κ-CN的质量浓度会影响凝乳时间和强度,同时乳中κ-酪蛋白质量浓度较少受季节、饲料等的影响[3-4],相对比较稳定,因此定量检测κ-酪蛋白质量浓度对牛乳原料及乳酪生产质量控制等乳品加工过程具有重要意义。κ-CN抗原专一性较强,热处理对其抗原性影响较小,因此可用免疫学技术进行特异性检测。鸡IgY属IgG类抗体,是卵黄中唯一的Ig[5-6],具有不与补体结合,易对保守抗原产生应答,收集方便,产量大等特点,在免疫检测方面应用前景广阔[7-9]。本研究针对牛乳κ-酪蛋白制备了IgG与IgY两种抗体,将经免疫吸收后的抗体用于间接ELISA检测κ-CN,实现了κ-CN的定量检测,为牛乳原料及产品控制提供技术支持。
1 实 验
1.1 材料与仪器
实验动物:新西兰大白兔3只,雄性,17~18周龄,2~3 kg/只,无前期病史。免疫用鸡为3个月临产蛋母鸡(状态良好,生长整齐,重约1.2 kg,前期无病史)。
牛乳κ-酪蛋白(κ-CN)标准品,弗式完全佐剂及不完全佐剂,标准兔IgG,标准鸡IgY,HRP酶联羊抗兔IgG及HRP酶联兔抗鸡IgG,其他试剂均为优级纯或分析纯。
仪器:Multiskan MK3酶标仪,ÄKTA purifier 10快速纯化系统,HiTrapTM IgY Purification HP(柱体积5 mL),亲和色谱HiTrap rProtein A FF(柱体积1 mL),96孔酶标板孔,混合纤维素酯微孔滤膜 (0.45 μm,Φ50 mm)。
1.2 方法
1.2.1 抗牛κ-CN特异性IgG和IgY的制备
抗牛κ-CN特异性兔血清抗体IgG参照文献[10],标准κ-CN加等体积完全弗氏佐剂乳化,免疫新西兰大白兔3只,每间隔12天加强免疫1次,加强免疫时,κ-CN与等体积不完全弗氏佐剂乳化,共加强3次,检测血清效价,最终ELISA效价达到1:10 000,采血收集分离血清。采用硫酸铵分级沉淀及蛋白A亲和色谱柱进一步纯化,获得anti-κ-CN-IgG,冷冻干燥备用。抗牛κ-CN特异性卵黄抗体IgY制备,免疫方法与IgG制备方法类似,纯化方法参照文献[11],采用水稀释-冻融-微滤-超滤-硫酸铵盐析-IgY亲和色谱的方法进行,获得anti-κ-CN-IgY,冷冻干燥备用。
1.2.2 两种anti--κ-CN抗体的交叉反应性
通过间接ELISA法分别检测两种抗体与乳中常见成分的交叉反应性,分别用κ-CN、β-酪蛋白、α-乳白蛋白(α-LA)和乳清粉作抗原包被酶标板,加入待测IgG或IgY (或免疫吸收后抗体),HRP酶联羊抗兔IgG或HRP酶联兔抗鸡IgG为二抗,设置阴性对照包括空白孔和阴性血清(卵黄)孔,间接ELISA法测定A450nm值,分析各蛋白与所制备的anti-κ-CN抗体交叉反应性的强弱。
1.2.3 两种anti--κ-CN抗体的免疫吸收
为提高检测的特异性,抗体在用于定量检测前进行抗体免疫吸收,步骤如下:①用PBST将anti-κ-CN-IgG及anti-κ-CN-IgY稀释至质量浓度为1 g/L;②牛乳β-酪蛋白 (β-CN质量浓度为1 g/L)、α-乳白蛋白(α-LA质量浓度为1 g/L)及乳清粉(质量浓度10 g/L)等体积混合后,再与步骤①所得液体等体积混合,37℃孵育2 h后,4℃过夜放置,得到修饰的抗体(blocked anti-β-CN-IgG)。由于ELISA检测中有较多的的洗涤步骤,形成的免疫复合为不必去除,直接用于定量检测中。比较吸收前后IgG与IgY抗体特异性。
1.2.4 牛乳κ-酪蛋白间接ELISA检测标准曲线的建立
参见文献[12],分别用包被稀释液(浓度为0.05 mol/L,pH值为9.6碳酸盐缓冲液)将标准κ-CN梯度稀释(质量浓度50~1.5625 mg/L)包被酶标板,采用棋盘滴定法,间接ELISA测试确定最佳检测条件后,建立标准曲线。检测样品时,用样品稀释替代标准κ-CN。
根据A450 nm值,以IgG和IgY为检测抗体时,κ-CN最佳抗原包被质量浓度分别为6.25 μg/mL和25 μg/mL。抗体起始质量浓度为1g/L时,免疫吸收后的anti-κ-CN-IgG及anti-κ-CN-IgY工作质量浓度均分别为1:20和1:10。
2 结果与分析
2.1 抗κ-CN特异性抗体IgG和IgY纯化与制备
2.1.1 两种抗体纯化结果的SDS-PAGE分析
经不同方法分离,最后经不同亲和色谱柱纯化后anti-κ-CN IgG及IgY用8%的分离胶进行SDS-PAGE(不加β-巯基乙醇)电泳图谱如图1所示。图1中,分别以标准兔IgG和鸡IgG为对照品,采用凝胶成像仪分析可见经亲和色谱纯化的IgG与IgY电泳纯度可达90%。IgG (起始质量浓度1 g/L)的ELISA效价在1:5120,IgY效价1:12800,可用于免疫检测。
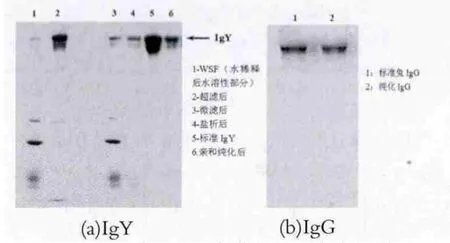
图1 IgY与IgG分离纯化效果电泳图谱
2.1.2 两种抗体的特异性与免疫吸收效果
抗体用于检测不仅要求蛋白纯度高,更重要的不与乳样品中其他成分发生交叉反应,即具有较高的特异性。检测两种抗体对κ-CN的特异性,并比较免疫吸收前后两者特异性的变化。由图2a和图2b可知,antiκ-CN-IgG抗体在未封闭前虽与κ-CN结合性较强,远大于与β-CN、α-LA和乳清粉的结合能力,与乳清粉的交叉反应性最强,可能因为κ-酪蛋白分子较小不易沉淀,在乳清粉中存在微量小分子片段的缘故。未免疫吸收前,两种抗体与其他三种非特异性抗原反应后的A450nm值较高,大于阴性对照吸收值的2.1倍,在检测中易出现假阳性现象。Anti-κ-CN-IgG抗体经免疫吸收后,与乳清粉交叉反应A450nm值从0.6左右降至0.3以下,而β-CN和α-LA的A450nm吸收值与阴性对照更为接近,大大提高了与κ-酪蛋白反应的特异性。由图2c和2d可知,anti-κ-CN-IgY抗体经免疫吸收后,对κ-CN的特异性也大大增强,减低了非特异性反应,可用于乳中κ-CN的检测。
2.2 间接ELISA定量检测牛乳κ-酪蛋白的标准曲线
2.2.1 κ-CN检测的标准曲线
将标准κ-酪蛋白(质量浓度25 mg/L)按2n稀释包被酶标板并封闭,分别采用免疫吸收后的IgG和IgY进行间接ELISA检测。结果如图3所示。用anti-κ-CNIgG建立的间接ELISA法,当标准κ-CN质量浓度在0.098~3.125 mg/L时,A450 nm值与κ-CN的质量浓度具有较好线性相关性,线性系数R2为0.9992;用antiκ-CN-IgY建立的间接ELISA法,当标准κ-CN质量浓度在0.098~6.25 mg/L时,A450 nm值与κ-CN的质量浓度成良好的线性关系,线性系数R2为0.9987。
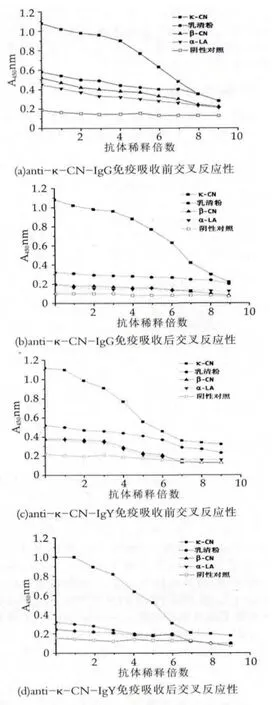
图2 IgG和IgY抗体的交叉反应及抗体封闭效果
2.2.2 κ-CN检测方法的稳定性
按间接ELISA操作程序重复检测同浓度梯度κ-酪蛋白,用工作曲线计算κ-酪蛋白值,比较验检结果的重复性,IgG及IgY所建立标准曲线测量结果分别如表1和2所示。
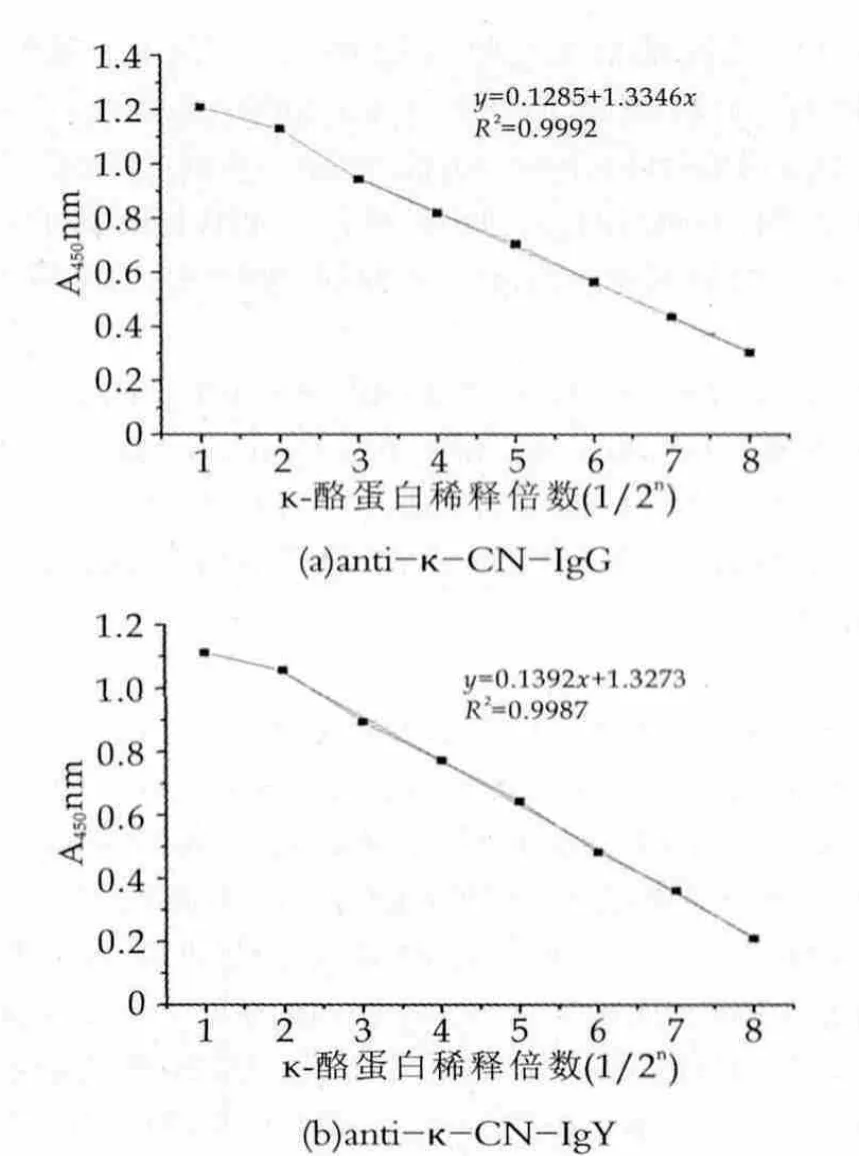
图3 κ-酪蛋白间接ELISA标准曲线
由表1可以看出,应用anti-κ-CN-IgG建立间接ELISA法板内检测的A450 nm值的变异系数小于1%,回收率在99.10%~101.1%之间;由表2可以看出,应用anti-κ-CN-IgY建立间接ELISA法板内检测的A450 nm值的变异系数小于2%,回收率在98%~100.8%之间,说明两种κ-CN抗体建立的间接法板内检测都有较好重复性,系统稳定。免疫吸收后的anti-κ-CNIgY建立的间接ELISA法具有相似的重复性和稳定性,可替代IgG用于乳品中κ-CN蛋白的检测。所建立的方法能够用于κ-CN定量,为以κ-CN为目标的蛋白质检测及乳品的的质量检测提供快捷手段。
2.2.3 牛乳样品三聚氰胺掺假检测
以三聚氰胺为模拟掺假物将本方法用于牛乳掺假检验中。 三聚氰胺按梯度0,5%,8%,10%,15%,20%,30%,40%掺入原料乳中作为待测样品,建立间接ELISA试验。应用IgG间接ELISA法检测时,当三聚氰胺掺入量在0~20%的范围时,线性回归方程为:y=-0.0013x+0.7218,R2=0.9993;应用IgY间接ELISA法检测时,当三聚氰胺掺入量在0~20%的范围时,其呈线性回归方程为:y=-0.0031x+0.698, R2=0.9946。
用两种抗体建立的间接ELISA法检测牛乳样品结果如表3所示。由表3可以看出,相对误差分别在-0.9%~1.3%和-4.0%~2.7%范围内,变异系数均小于5%;建立的各ELISA体系测定牛乳蛋白含量的准确性及精密性均符合要求,可实现对牛乳含量的定性定量检测。IgG抗体与IgY抗体建立间接ELISA法相比,在用于牛乳样品检测中,相对误差较小,变异系数及回收率指标均表明该系统稳定性更好。
3 结 论
通过免疫动物所制备的anti-κ-CN-IgG和anti-κ-CN-IgY抗体对牛乳κ-CN有一定特异性,但两者均与牛乳β-CN、α-LA和乳清粉有交叉反应性,通过免疫吸收能成功封闭其中交叉反应成分,提高反应特异性,且免疫吸收后的抗体用于ELISA检测无须去除产生的免疫复合物,操作简便。利用吸收后抗体建立以κ-CN为目标蛋白检测牛乳蛋白的定量间接ELISA方法,IgG和IgY分别在κ-CN质量浓度 0.098~3.125 mg/L和0.098~6.25 mg/L范围内有良好线性关系,建立的定量间接法板内检测样品变异系数小,有较好重复性,系统稳定。IgY可作为IgG的检测替代抗体。所建立的定量间接ELISA方法可用于κ-CN快速检测与乳品质量及掺假检测控制中。
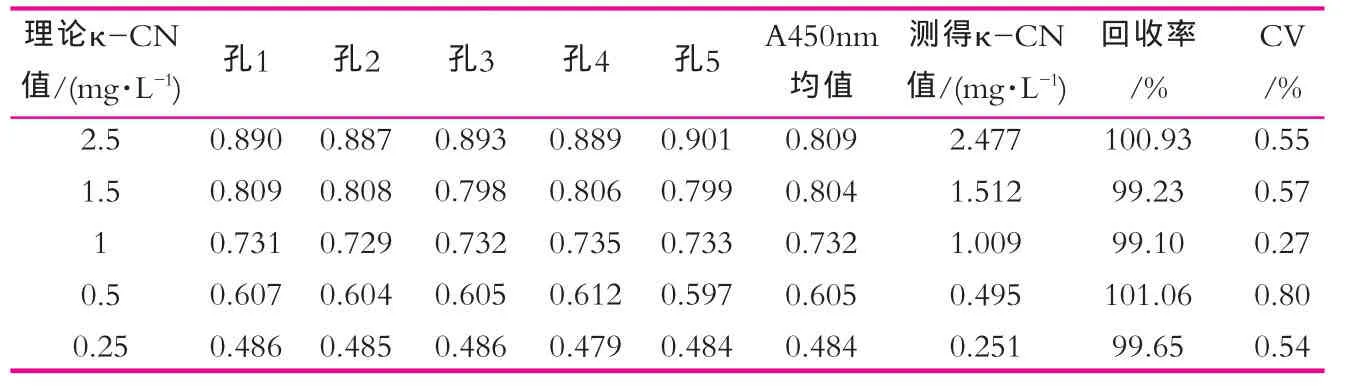
表1 基于IgG的κ-CN间接ELISA检测重复性
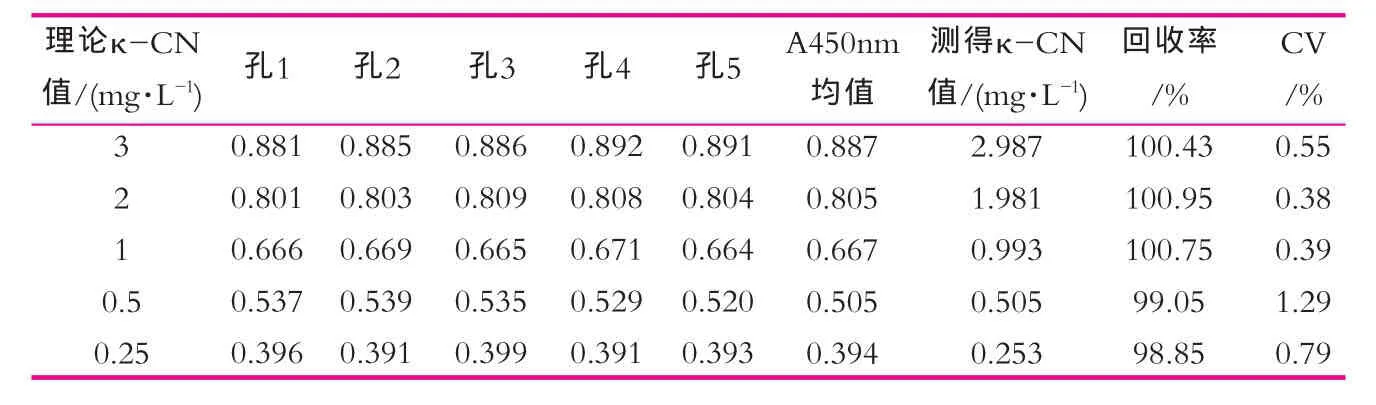
表2 基于IgY的κ-CN间接ELISA检测重复性
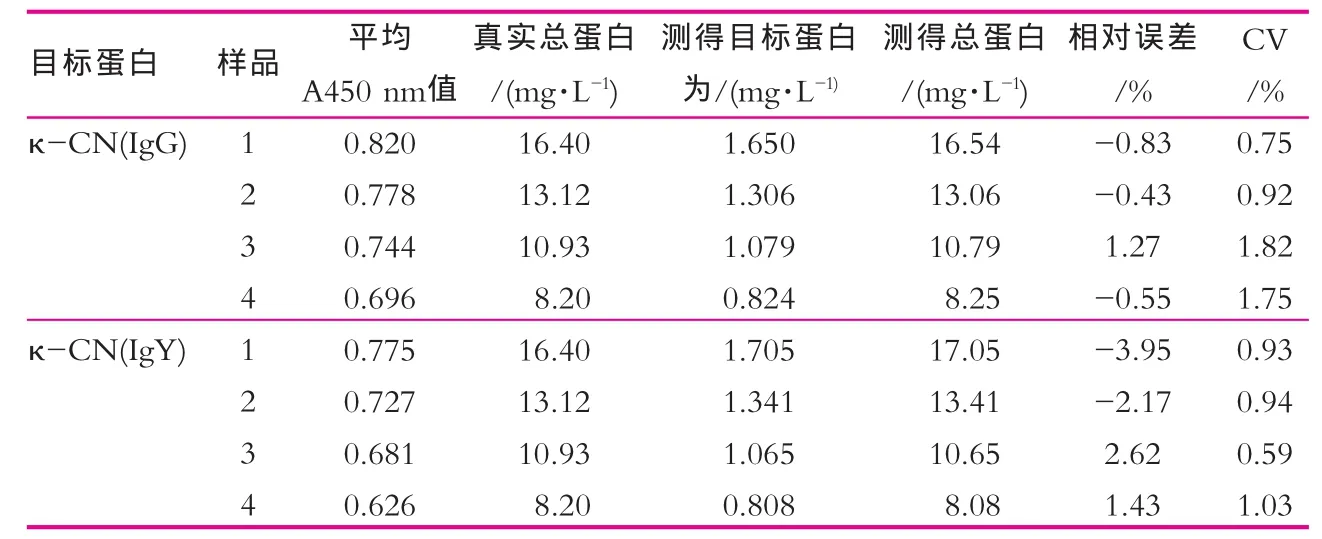
表3 牛乳三聚氰胺掺假样品蛋白含量检测
[1]任大喜,陈有亮,缪淑颖,等.K-酪蛋白基因多态性与牛乳加工性能的关联[J].中国食品学报,2012,(6):66-70.
[2]李子超,王丽娜,李昀锴,等.3种乳源酪蛋白粒径及胶束结构的差异性[J].食品科学,2012,(5):58-41.
[3]SUMMER A,SANTUS E,CASANOVA L,et al.Short Communication:Characterization of a Monoclonal Antibody for κ -casein of Cow’s Milk[J].Journal of Dairy Science,2010,93(2):796-800.
[4]张涛,庞广昌.酶联免疫快速测定原料乳中κ-酪蛋白的含量[J].中国乳品工业.2006,27(11):179-181.
[5]DUAN Z H,LIN Z S,YAO H R,et al.Preparation of Artificial Antigen and Egg Yolk-Derived Immunoglobulin (IgY)of Citrinin for Enzyme-Linked Immunosorbent Assay[J].Biomedical And Environment Sciences,2009,22(3):237-243.
[6]DIAS DA SILVA W,TAMBOURGI DV.IgY:A Promising Antibody for Use in Immunodiagnostic and in Immunotherapy [J].Vet.Immunol.Immunop.,2010,135(3-4):173-180.
[7]CHEN C C,TAI Y C,SHEN S C,et al.Detection of Alkaline Phosphatase by Competitive Indirect ELISA Using Immuno-globulin in yolk(IgY)Specific against Bovine Milk Alkaline Phosphatase[J].Food Chemistry,2006,95(2):213-220.
[8]WARR G W,MAGOR K E,HIGGINS D A.IgY:Clue to the Origins of Modern Antibodies[J].Immunology Today,1995,16(8):392.
[9]DAVALOS-PANTOJA L,ORTEGA-VINUESA J L,BASTOSGONZALEZ D,et al.A Comparative Study Between the Adsorption of IgY and IgG on Latex Particles[J].Journal of Biomaterials Science--Polymer Edition.2000(11):657-673.
[10]王廷华,李官成,Xin-Fu Zhou.抗体理论与技术[M].北京:科学出版社,2005:28-30.
[11]宋宏新,柏红梅,薛海燕等.酪蛋白和乳球蛋白的抗体及酶标物制备研究[J].食品科学,2008,29(12):486-489.
[12]SONG H X,XUE H Y,HAN Y.Detection of cow’s milk in Shaanxi goat’s milk with an ELISA assay[J].Food Control,2011,22(6):883-887.

