不同提取方法对槐米多糖抗氧化活性的影响
范巧宁,赵 珮,高晓梅,段玉峰
(陕西师范大学食品工程与营养科学学院,陕西西安710062)

1 材料与方法
1.1 材料与仪器
槐米 产自山东省临沂市费县。
1,1-二苯基-2-苦苯肼自由基(DPPH·) 分析纯,美国 Sigma公司产品;三羟基甲基氨基甲烷(Tris)、邻苯三酚(焦性没食子酸)、三氯化铁(FeCl3)、六氰合铁化钾([K3Fe(CN)6])、三氯乙酸(TCA)、苯酚、浓硫酸、乙醇(95%)、抗坏血酸(VC)、磷酸二氢钠、磷酸氢二双氧水、硫酸亚铁、水杨酸、盐酸、FeCl3、CuSO4.5H2O、NaOH、NaOOC(CHOH)2COOK·4H2O、CCl4、异戊醇 均为国产分析纯。
AL 204型电子天平 梅特勒-托利多仪器(上海)有限公司;RE52-3旋转蒸发器 上海沪西分析仪器有限公司;722型可见分光光度计 上海光谱仪器有限公司;KQ 3200DE型超声波清洗器 昆山市超声波仪器有限公司;TU 1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;HH-8B型数显恒温水浴锅 国华电器有限公司;HHW-21CU-600型电热恒温水槽 上海福玛实验设备有限公司;800B型离心机 上海安亭科学仪器厂;FD-1冷冻干燥机 北京博医康技术公司;SHA-e型恒温振荡器 金坛市富华仪器有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 槐米多糖提取工艺流程 原料处理:槐米烘干(60℃)→粉碎→过筛(60目)→脱脂(80%乙醇)
提取方法:超声提取→抽滤→浓缩→醇沉(过夜)→离心(3000r/min,10min)得沉淀→溶解、脱蛋白(sevag法)→透析→冷冻干燥。
热水浸提:取处理后的干槐米粉5g,置于锥形瓶中,按文献[8]得到的最佳条件下提取,之后按超声波提取工艺中的步骤进行处理。
1.2.2 提取分离 参考文献[9]的方法。液料比30∶1(v/m),提取时间 42.60min,提取温度 65.78℃。由于以往文献没有介绍超声功率的影响,本实验采用单因素实验法,取5g搓碎槐米,按照上述条件进行超声波提取醇沉法提取多糖,超声功率分别为160、240、320、400W,三次平行实验,苯酚硫酸法[19]测多糖含量,考查超声功率对槐米多糖得率的影响情况。
1.2.3 多糖含量测定及得率计算 多糖含量的测定采用苯酚-硫酸法[10]。精确称取粗多糖10.0mg溶解,定容至100mL容量瓶中,吸取该溶液1.0mL于试管中,依次加入5%苯酚溶液1.0、5.0mL浓硫酸,静置30min,在490nm条件下测其吸光度值。重复三次,求其平均值。得率计算公式为:

式中,C:溶液中粗多糖浓度;V:溶液总体积;M:脱脂后槐米质量。
1.2.4 定性测定
1.2.4.1 紫外光谱分析 蛋白质、多肽、核酸等物质在260~280nm处有明显吸收峰,通过紫外扫描鉴别多糖经过四次sevag法脱蛋白前后溶液中是否含有蛋白质类杂质。
1.2.4.2 酚类物质检测 参考文献[11]的方法。
沈老七是河口最富有的庄园主,这垸里肥得流油的河沙地大多是他置下的。沈家大院有三进四十八大间,是这方圆百里最气派的庄园。那时时局很乱,常常有兵队路过河口,他家就成了不折不扣的兵站。虽然折了些钱财但沈家也还算平安无事。不过,那年日本人打过长江驻进沈家大院以后却引来了血光之灾。
1.2.4.3 还原性检测 将干燥后的槐米粗多糖溶解于适量的蒸馏水中,得粗多糖溶液。取该溶液2mL,加入新配制的斐林试剂2mL,煮沸2min,观察反应中颜色的变化。
取粗多糖溶液2mL,加入新配制的双缩脲2mL(先加A试剂2mL,再加B试剂3~4滴),在沸水浴中反应2min,观察反应中颜色的变化[11]。
1.2.5 抗氧化活性测定 总还原能力测定:采用普鲁士蓝法[12],于1mL不同质量浓度的粗多糖(0.125、0.25、0.5、1.0、2.0mg/mL)的样品溶液分别依次加入为2.5mL的磷酸盐缓冲液(pH=6.6)和2.5mL的铁氰化钾溶液(1%),混匀,50℃ 水浴20min后,再加入2.5mL、10% 的三氯乙酸溶液,然后以3000r/min离心分离10min,取上层清液2.5mL,依次加2.5mL蒸馏水和0.1%FeCl3溶液1mL,在700nm处测定吸光度值,吸光度越高,还原能力越强,三次平行,求其平均值,以VC和BHT作为阳性对照。
(DPPH·)清除能力的测定 于0.5mL不同质量浓度的粗多糖(0.125、0.25、0.5、1.0、2.0mg/mL)的样品溶液依次分别加入0.5mL蒸馏水、2mL 2×10-4mol/L DPPH溶液(用95%乙醇配制),充分摇匀,室温避光反应30min后在517nm处测定吸光度。以95%乙醇代替样品液作为空白组;以95%乙醇代替DPPH·溶液作为对照组,并以VC和BHT作为阳性对照。按下式计算清除率:

式中,A1:加入样品后的吸光值;A2:对照组吸光值;A0:空白组吸光值。
羟基自由基(·OH)清除能力的测定 采用芬顿(Fenton)体系邻二氮菲-Fe2+氧化法进行测定[13]于10mL试管中依次加入2mL FeS04溶液(6mmol/L)、2mL 不同质量浓度的粗多糖(0.125、0.25、0.5、1.0、2.0mg/mL)的样品溶液、2mL H2O2(6mmol/L)溶液,充分摇匀,静置10min。再加入6mmol/L的水杨酸溶液2mL,充分摇匀,静置30min,在510nm处测定其吸光度值。阴性对照不加样,以蒸馏水代替。以VC、BHT作阳性对照,每个处理试样均做三个平行实验。
计算公式:

式中,A1:加入样品后的吸光值;A2:样品本底吸光值;A0:空白吸光值。

式中:A0-邻苯三酚的自氧化速率;A-加入多糖样品后邻苯三酚的自氧化速率。
2 结果与分析
2.1 提取分离条件选择
超声功率对多糖得率的影响结果如下:
由图1知,超声功率的大小对槐米多糖得率影响不大,超声功率为320W时,得率最大,得率为1.2%,每个水平进行三次平行实验(p=0.009<0.01),但超声功率过高会导致多糖降解,因此,选择320W为较理想。

图1 超声功率对多糖得率的影响Fig.1 Effect of ultrasonic power on the yield of polysaccharides
2.2 葡萄糖标准曲线的绘制
测定葡萄糖标准曲线如图2,线性回归方程为:Y=0.0922X+0.0171,相关系数 R2=0.9998。
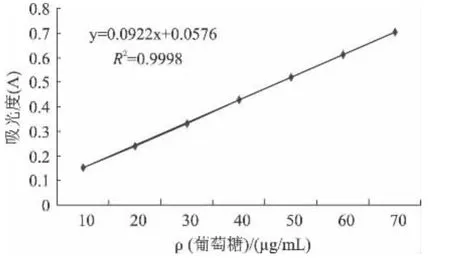
图2 葡萄糖含量标准曲线Fig.2 Standard curve of polysaccharide
2.3 不同提取方法得到的槐米粗多糖的含量
超声提取:最佳工艺为液料比30.00mL·g-1,提取时间42.60min,提取温度65.78℃,超声功率320W,该条件下槐米多糖得率为1.52%;热水浸提:最佳工艺为提取温度90℃,料水质量比15mL·g-1,提取时间90min,所得槐米粗多糖的得率为1.25%,超声波提取法比热水浸提法得率提高了21.6%。由于经过了四次脱蛋白,多糖有所损失,因此,测得的槐米多糖得率比以前文献报道的低一些。
2.4 紫外光谱扫描结果
图3所示:在波长260nm无吸收峰,280nm有吸收峰。说明多糖中不含核酸,但含有蛋白质(图3a);四次脱蛋白后,280nm吸收峰消失,说明已将蛋白清除(图3b)。
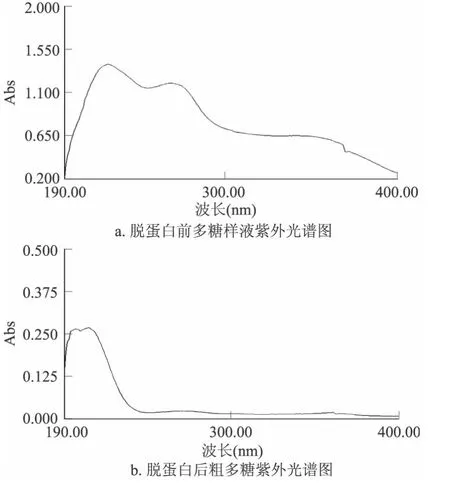
图3 紫外光谱图Fig.3 The ultraviolet spectrogram
2.5 定性反应结果
由表1知:槐米多糖经过sevag脱蛋白后,定性反应均为阴性,即槐米多糖中无可溶性还原性多糖、游离的蛋白质、酚类物质。

表1 定性实验结果Table 1 The qualitative reaction
2.6 抗氧化活性的测定
2.6.1 总还原能力 抗氧化物质的抗氧化活性与其还原力存在直接的联系,还原力越强,抗氧化性越强。通常采用铁氰化钾氧化样品来表征还原力,体系中Fe3+在抗氧化剂的促进下变成 Fe2+,形成的Fe2+在700nm处有吸收峰检出。最终测定的吸光值越大,还原力越强[14]。由图4可知,超声提取槐米多糖与水提多糖的还原力与粗多糖质量浓度成正相关,与VC还原力相差较大,说明槐米粗多糖的还原力较弱,明显低于 VC和BHT的还原力。另外,超声提取所得槐米多糖的还原力略强于水提多糖,当质量浓度高于1mg/mL时,超声提取多糖增加幅度较水提多糖高一些。dps软件对实验数据分析表明:超声提取槐米多糖与水提多糖的还原力相比较p=0.0034<0.01。各个水平进行三次平行实验,Duncan新复极差法分析:BHT的还原力(p=0.009)达到极显著水平,VC、超声提取槐米多糖、水提多糖的还原力(p<0.05)为显著。

图4 槐米多糖的总还原能力Fig.4 Reducing power of Flos Sophora polysaccharides
2.6.2 对DPPH自由基的清除作用 DPPH法是评价抗氧化活性的常用方法,抗氧化物质可直接作用于DPPH自由基,使其颜色变浅,根据吸光度的变化可测定物质的抗氧化活性[15]。图5所示,超声提取所得槐米多糖清除DPPH自由基的能力优于水提槐米多糖,但两者的清除能力都高于BHT,低于VC。随着质量浓度成倍增加,VC、超声提取多糖对DPPH·清除作用趋于平缓,相比之下,超声提取多糖的清除作用变化较大。在质量浓度低于0.25mg/mL时,超声提取多糖与水提多糖对DPPH自由基的清除能力接近,而当质量浓度高于0.25mg/mL时,与水提多糖相比,超声提取多糖上升较快。但在所选质量浓度范围内,其清除能力低于60%。dps软件对实验数据分析表明:超声提取槐米多糖与水提多糖清除DPPH自由基的能力相比较p=0.0432<0.05。各个水平进行三次平行实验,Duncan新复极差法分析知:BHT、水提多糖、超声提取槐米多糖、VC对DPPH·清除能力(0.01≤p<0.05)均在显著水平范围。

图5 槐米粗多糖对DPPH自由基的清除效果Fig.5 Scavenging effect of crude polysaccharides from Flos Sophora on DPPH radicals
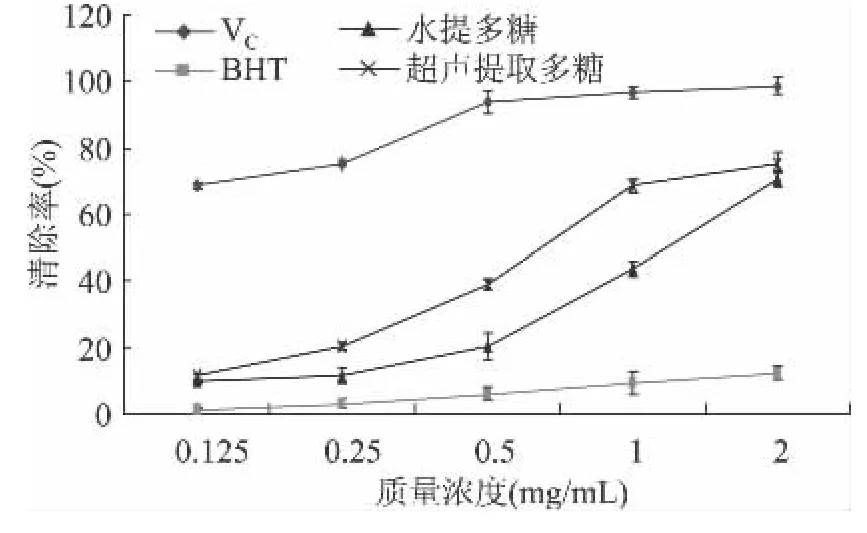
图6 槐米粗多糖对羟基自由基的清除效果Fig.6 Scavenging activity of crude polysaccharides from Flos Sophora on hydroxyl radical
2.6.3 对·OH的清除作用 多糖分子上具有还原性的半缩醛羟基,可将自由基还原,达到阻止自由基连锁反应的目的,图6所示,槐米粗多糖的清除·OH的能力与其质量浓度正相关。在浓度达到2mg/mL时,VC对·OH的清除可达到98.4%,说明超声提取粗多糖和水提多糖对·OH的清除作用都与多糖浓度有着较大的依赖关系,随着粗多糖浓度的增加,·OH清除效果也随之增加,超声提取粗多糖比水提多糖的增加幅度大,但当浓度达到2mg/mL时,两者的清除能力相当,清除率达到75.4%。说明高浓度的槐米粗多糖对·OH也有着明显的清除作用,能够有效的抗氧化。dps软件分析表明:超声提取槐米多糖与水提多糖清除·OH的能力相比较p=0.0392<0.05。各个水平进行三次平行实验,结果表明:Duncan新复极差法分析p值大小为:BHT(p<0.001)<水提多糖(p<0.01)<超声提取槐米多糖(p<0.01)<VC(p<0.01),即BHT对·OH的清除能力呈极高显著,其余三个处理均达到了极显著水平。
在相同质量浓度下,超声提取所得槐米多糖的抗氧化活性优于水提槐米多糖,其原因可能有:超声提取法大大缩短了提取时间,而且提取过程中无化学反应,使得在短时间内多糖生物活性没有损失[18];两种多糖的抗氧化活性的差异还可能与不同提取方式所导致多糖分子的单糖组成及糖苷键型不同有关[19]。

图7 槐米粗多糖对·的清除效果Fig.7 Scavenging effect of crude polysaccharides from Flos Sophora on superoxide anion radicals
2.6.5 半数清除质量浓度(EC50)测定结果 作为评价抗氧化能力的指标EC50,指清除率为50%时所需样品的质量浓度。所需质量浓度越低,表明半清除率越高,清除效果越好。由表2知,对自由基清除的EC50值排序为:BHT>水提多糖>超声提取多糖>VC,这说明在相同质量浓度下,超声提取所得槐米多糖的自由基清除能力要明显高于水提多糖。因此,超声提取所得槐米多糖具有较好的抗氧化活性。
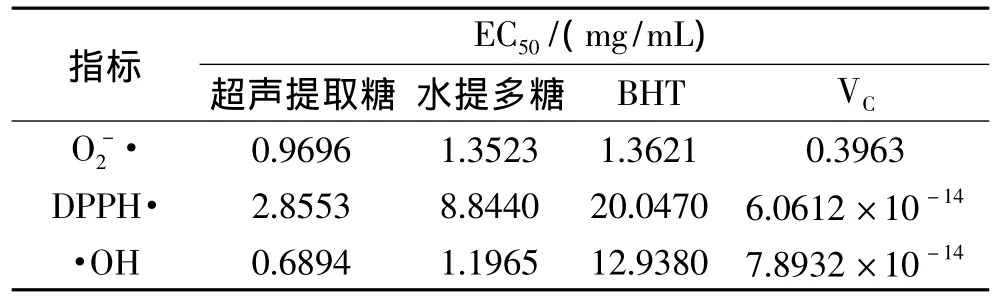
表2 多糖和 VC的EC50值Table 2 The value of EC50on polysaccharides and VC
3 结论
[1]吴笳笛.多糖的作用及其研究进展[J].沈阳师范大学学报:自然科学版,2008,26(2):221-223.
[2]Nakashima H,Kido Y,Kobayashi N,et al.Antiretroviral activity in a marine red alga:reverse transcriptase inhibition by an aqueous extract of Schizymenia pacifica[J].J Cancer Res Clin Oncol,1987,113(5):413.
[3]张昕,张强,梁彦龙.香菇多糖的抗肿瘤和降糖作用机制的研究进展[J].中国药事,2008,22(2):149-154.
[4]Philip H,Clifford T,Lynnette R F.Effects of two contrasting dietary fiberson starch digestion,short-chain fatty acid production and transit time in rats[J].Journal of the Science of Food and Agriculture,2000,80:2089-2095.
[5]Marguerite R.Main properties and current applications of some polysaccharides as biomaterials[J].Polym Int,2008,57:397-430.
[6]刘芳,郑育声,尹学琼.灰叶马尾藻多糖的提取及其生物活性[J].食品科学,2013,34(3):93-96.
[7]龚涛,王晓辉,赵靓,等.枸杞多糖抗氧化作用的研究[J].生物技术,2010,20(1):84-86.
[8]周颖,夏新奎.槐米多糖的提取和纯化工艺研究[J].湖北农业科学,2011,50(15):3161-3163.
[9]李纳新.星点设计-响应面法优化超声波提取槐米多糖的工艺[J].中国药师,2013,16(12):1809-1811.
[10]江 培,何杏,王金宏.槐米中多糖的提取和含量测定[J].黑龙江医药,2013,26(2):166-168.
[11]孙宇婧,韩涛,卞科,等.山药蛋白纯化条件及其理化方法鉴定[J].中国粮油学报,2011,26(3):81-85.
[12]Oyaizu M.Antioxidative activities of browning products of glucosamine fractionated by organicsolventand thin layer chromatography[J].Nippon Shokuhin Kogyo Gakkaishi,1988,35:771-775.
[13]张娥珍,辛明.铁皮石斛超微粉体外抗氧化性研究[J].食品科技,2014,39(1):84-88.
[14]Isabel C F R Ferreira,Maria-Joao R P Queiroz,Miguel Vilas-Boas,et al.Evaluation of the antioxidant properties of diarylamines in the benzo[b]thiophene series by free radical scavenging activity and reducing power[J].Bioorganic &Medicinal Chemistry Letters,2006,1384-1387.
[15]崔丽霞,张莹,郑义,等.绣球菌多糖的提取工艺优化及其抗氧化作用[J].食品工业,2013,34(6):24-28.
[16]赵玉红,金秀明,韩睿,等.鹿茸多糖分离纯化及抗氧化活性研究[J].食品工业科技,2012,33(12):155-158.
[17]李朝阳,李珊,刘魁,等.蒜多糖的分离纯化及抗氧化性的研究[J].河北科技大学学报,2007,28(3):243-346.
[18]金迪,梁英,孙工兵,等.植物多糖提取技术的研究进展[J].黑龙江八一农垦大学学报,2011,23(5):76-79.
[19]涂宗财,寇玉,王辉,等.荷叶多糖的超声波辅助提取和抗氧化活性[J].食品科学,2013,34(16):108-112.

