大肠杆菌抗氧化基因突变对内源过氧化氢的影响
李 欣,杨丽鹏,杜 琳,乔家驹,尤晓颜,刘云宏,张 敏,张玉先,王利平
(河南科技大学食品与生物工程学院,河南洛阳471023)
H2O2是国标允许在食品中应用的食品漂白剂和抗菌剂,主要应用于小麦粉、食用油、蛋白等[1]。同时,H2O2在食品中也广泛存在,如在水果的成熟、衰老和果皮褐变作用过程中,H2O2扮演重要角色[2]。特别是在农产品储藏过程中,H2O2对其储藏品质有着重要影响,直接涉及到食品的自身酸败和褐变问题程度[3-7]。那么如何控制食品H2O2水平便成为一急需解决的问题。本实验室的研究发现,H2O2与很多相关酶作用有关,我们可以通过加强对H2O2的了解,进而尝试寻找控制H2O2产生机制的更为有效的手段,为食品品质保证提供基础参考数据。
H2O2是活性氧的一种,是细胞有氧代谢的产物[8-9]。H2O2作为机体对外界胁迫反应的调节因子,它可选择性的诱导许多相关基因的表达,以提高其自身的免疫能力[10]。但是,H2O2含量过多机体出现生理功能失衡、代谢紊乱等中毒症状,机体就会遭受极大威胁[11-12]。活性氧快速、短暂的积累的意义在于引发局部坏死,构建自身的防御体系[13-16]。因此,细胞内源H2O2的调控及其机制的研究具有重要的意义。
大肠杆菌(Escherichia coli,E.coli)胞内通过生物膜电子传递链以及多种氧化还原酶系调控H2O2等活性氧的释放[17]。已有研究证明OxyR可以识别细胞内高水平的H2O2,是细菌抗氧化代谢系统主要的转录调控蛋白[18];烷基过氧化物酶基因ahpC/F的转录受到OxyR的正调控[19-20];单功能的过氧化氢酶KatE和超氧化物歧化酶SodS作为重要的抗氧化酶在排毒方面发挥了至关重要的作用[21-22]。因此,为了阐明离体条件下抗氧化基因 ahpC/F、katE/G、oxyR ahpC/F、sodA/B在降解H2O2方面的作用,揭示E.coli抗氧化系统的作用机制,本研究选用E.coli抗氧化基因的突变体菌株为实验材料,能够为其它细菌内源H2O2的调控机制提供指导性的作用。
1 材料与方法
1.1 菌株
E.coli双基因(ahpC/F)缺失突变体菌株JI370、双基因(katE/G)缺失突变体菌株 JI367、三基因(oxyRahpC/F)缺失突变体菌株LC74、双基因(sodA/B)缺失突变体菌株AS240以及野生型菌株MG1655美国伊利诺伊大学微生物系James A.Imlay教授馈赠。将冻干保存的上述菌株取干粉接种到无菌水中混匀,静置30min后取20μL移接到LB液体培养基中,37℃振荡培养至菌液混浊,用终浓度为30%的甘油保存菌种,备用[22]。
LB液体培养基配方:胰蛋白胨10g/L,酵母提取物5g/L,氯化钠10g/L。
1.2 主要试剂和仪器
30%(V/V)的H2O2、磷酸钾、辣根过氧化物酶、溴酚红 洛阳市奥科化玻仪器公司;氯化铈 Sigma公司,UK;透射电子显微镜 TEM100C,JEOL,Tokyo;Hitachi F-4500荧光分光光度计 深圳市昊光机电科技应用有限公司;UV-2800AH紫外分光光度计 杭州汇尔仪器设备有限公司。
1.3 实验方法
1.3.1 E.coli抗氧化基因突变株过氧化氢酶活性测定 用紫外分光光度法测定酶活。有氧条件下,大肠杆菌生长到至少四代,取对数期的菌悬液稀释至109CFU·mL-1,然后接种于固定体积的液体培养基中,保证初始菌株生长状态一致,取不同生长时间的菌悬液离心收集菌体,用室温50mmol/L的磷酸盐缓冲液(PBS)(pH7.4)重悬菌体沉淀,用上述缓冲液洗两次,重悬至菌体至420nm处OD值为0.1。在磷酸盐缓冲体系中外加H2O2至终浓度为2mmol/L,一定时间间隔(30s)检测A240变化,每分钟A240降低值为过氧化氢酶活性[23]。
1.3.2 E.coli抗氧化基因突变株内源H2O2水平检测 采用荧光法:按照Seaver和Imlay的[15]方法进行H2O2浓度定量测定。实验中取对数期的菌悬液稀释至109CFU·mL-1,然后接种于固定体积的液体培养基中,特定时间取同等量的菌液测H2O2释放量。
1.3.3 过氧化氢的电镜组织化学法定位(氯化铈-CeCl3法) 采用组织化学的方法对E.coli的内源H2O2积累进行检测[24]。37℃培养至对数期,离心收集菌体,用含5mol/L氯化铈(CeCl3)的磷酸盐缓冲液(PBS)重悬并在37℃下预处理温育1.5h。细胞中的H2O2积累可以被CeCl3(Sigma,UK)特异染色,并且按照Bestwick等[25]的方法通过检测铈过氧化物的沉积物判断过氧化氢的积累位点。过氧化氢特异染色后离心收集菌体,弃去含残余CeCl3的上清液,3%戊二醛重悬细胞4h以上,离心沉淀菌体。经OsO4后固定、环氧树脂包埋后切片,用透射电子显微镜在80kV电压下观察(TEM100C,JEOL,Tokyo)。处理对照细胞时,不加入CeCl3对细胞中的过氧化氢染色,后续处理与染色细胞相同。对铈过氧化物沉积密度设定了4个等级:0,无特定部位的沉积;1,微弱并不连续的沉积;2,从不连续到连续的清晰沉积;3,大量的沉积。
1.3.4 E.coli抗氧化基因突变株生长曲线绘制 参照文献[26-27]的方法,测定细菌培养液的光吸收值(OD420),分析细菌的离体生长动态。实验中取对数期的菌悬液稀释至109CFU·mL-1,然后接种于固定体积的液体培养基中,保证初始菌株生长状态一致。
1.3.5 统计学分析 用SPSS11.5进行统计学分析。独立样本间的差异显著性分析用Nonparametric Tests,包括 Mann-Whitney Test、Moses Test、Two-Sample Kolmogorov-Smirnov Test和Wald-Wolfowitz Test。不同基因突变造成的差异显著性用pairedsample T test分析。结果分为显著(p<0.05)和极显著(p<0.01)。
2 结果与分析
2.1 抗氧化基因突变对过氧化氢酶活性的影响
为了明确抗氧化基因突变对过氧化氢酶活性的影响,检测了大肠杆菌不同突变体菌株8~40h过氧化氢酶活性的变化。结果显示,所有菌株过氧化氢酶活性随着接种时间的延长不断升高。突变株LC74的过氧化氢酶活性一直低于野生型;8h时,突变株AS240过氧化氢酶活性低于野生型,8h之后,过氧化氢酶活性高于野生型;8h及之后,突变株JI367和JI370的过氧化氢酶活性高于野生型;16h之后,各菌株过氧化氢酶活性呈现一个规律性的变化,即JI367>AS240>JI370>MG1655>LC74。
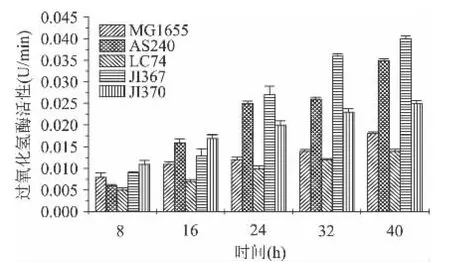
图1 大肠杆菌突变体菌株的酶活曲线Fig.1 The enzyme activity change cures of E.coli strains JI370,JI367,LC74,AS240 and MG1655
内源H2O2变化曲线显示,在细菌的整个生长周期中内源H2O2的浓度随着生长时间的延长不断增加,抗氧化基因katE/G、ahpC/F、sodA/B分别缺失的突变株 JI367、AS240、JI370,其内源 H2O2水平均低于野生型,而抗氧化基因oxyRahpC/F缺失的突变株LC74在生长到20h以后内源H2O2水平显著高于野生型(p<0.05)。不同的抗氧化基因突变株内源H2O2水平相差较大,突变株LC74内源H2O2产生水平最高,可达到30μmol/L,与野生型相比差异极显著(p<0.01),突变株JI370次之,JI367和AS240突变株内源H2O2水平浓度最高时可达到15μmol/L,与野生型相比差异显著(p<0.05)。

图2 大肠杆菌突变体菌株H2O2产生曲线Fig.2 Hydrogen peroxide production curves of E.coli strains JI370,JI367,LC74 and AS240
2.2 组织化学染色法定位细菌内源H2O2
透射电子显微镜下观察结果显示5个被检菌株的H2O2水平有显著差异。图3结果显示:MG1655细胞经过染色后H2O2主要积累在细胞壁上且连续清晰(等级2),质膜和胞质等其它位点没有检测到H2O2的积累;突变株LC74内源H2O2在细胞壁上大量积累,细胞质上也能明显的观察到H2O2的积累,水平远远高于其它菌株(等级3);JI370可清晰观察到细胞壁上连续的H2O2积累(等级2);AS240中可观察到H2O2在细胞壁上微弱不连续的沉积(等级1);JI367内源H2O2积累较少,不能明显的观察到(等级0)。
2.3 抗氧化基因突变对E.coli生长的影响
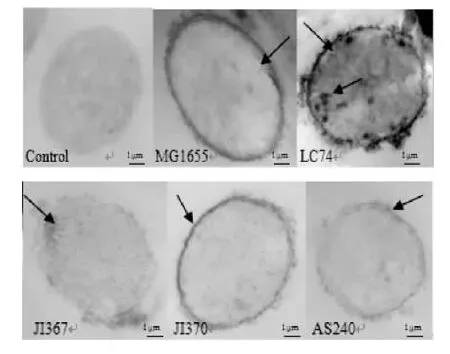
图3 大肠杆菌內源过氧化氢的沉积Fig.3 Endogenous hydrogen peroxide accumulation in wild type and mutant strains of E.coli
E.coli抗氧化基因突变对细菌生长的影响如图4所示,通过图表可以看出,E.coli突变株的生长曲线与野生型相比差异较大。突变株LC74与野生型一样有较明显的迟缓期、对数期、稳定期和衰亡期,但是突变体在对数期后期菌量高于野生型,可以推断出此时胞内H2O2的浓度(约5.4μmol/L)就是促进细菌生长的临界最低浓度,而当其到达稳定期时菌体量大约是野生型的1.2倍,说明突变株的生长速度受到促进或者裂解速度比野生型慢;其它三种突变株则都没有明显的稳定期,对数期过后直接进入衰亡期,说明这些突变株在衰亡期的裂解速度非常快,JI367生长周期最短,其次是AS240,再次是JI370。
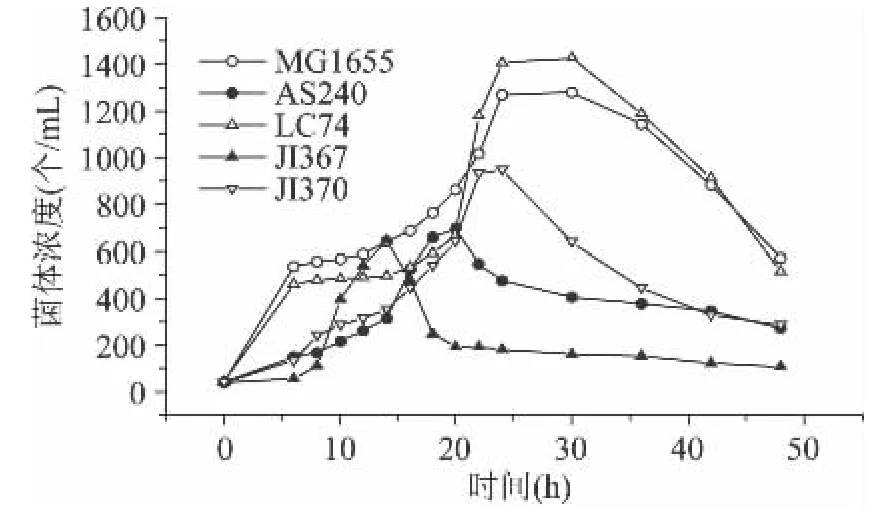
图4 大肠杆菌突变体的生长曲线Fig.4 The growth curves of E.coli strains JI370,JI367,LC74,AS240 and MG1655
3 结论与讨论
烷基过氧化物还原酶(alkylhydroperoxide reductase,Ahp)、过氧化氢酶(CAT)以及超氧化物歧化酶(SOD)是细胞内活性氧清除系统中的重要酶类,胞内的H2O2水平由上述三种酶相互协调作用,共同调控[28]。结果显示,与野生型相比,大肠杆菌突变株JI367、JI370和AS240的过氧化氢酶活性升高,内源H2O2的浓度降低;而突变株LC74过氧化氢酶活性降低,内源H2O2的浓度升高(图1和图2)。推测ahpC/F、katE/G基因突变后直接影响到Ahp和CAT酶的活性,内源H2O2的浓度本应下降,但是在OxyR调控子的作用下,其他酶活性补偿性的升高,因此造成内源H2O2的浓度降低;而当oxyR基因突变时,直接导致下游的CAT活性降低,H2O2浓度降低;sod基因突变导致SOD酶不能正常歧化超氧阴离子,对应产生的H2O2含量就会降低。Imlay教授等研究者的结论也与此相符[28-29]。由此可说明OxyR作为一个全局性的转录调控因子在调控细胞内抗氧化酶之间的补偿性表达中起到了至关重要的作用。不同细菌中不同抗氧化酶的作用是不同的,在E.coli中抗氧化酶Kat、Ahp和Sod在降解内源H2O2能力方面所起的作用不同,Ahp起主要作用,Sod次之,Kat最小。
正常生理条件下,细胞内H2O2的浓度维持在一定范围内,并且随着生长时间的延长H2O2的浓度也会不断的增加(图2)。荧光法及组织化学染色法均检测到内源H2O2的产生(图2和图3),无论透射电子显微镜的观察结果还是荧光法的定量检测结果均显示,H2O2在细胞中普遍存在,不同菌株内源H2O2的水平有所差别。E.coli细胞中H2O2的积累主要定位在细胞壁,当胞内H2O2量足够多时也会在细胞质中积累(图3)。
E.coli抗氧化基因 katE/G、ahpC/F、sodA/B可能与延滞期氧化物质的降解有关,它们缺失后使细菌总量在延滞期下降,从而导致后期细菌的生长缓慢;而抗氧化基因oxyRahpC/F缺失使细菌总量在指数生长期后期升高,从而促进了后期细菌的生长(图4),当oxyRahpC/F三突变株LC74中内源H2O2的浓度大于约5.4μmol/L时能促进细菌生长(图4和图2)。可见,细胞内适量H2O2的积累对于细菌生长是有积极作用的。本实验探讨OxyR与其调控的katE/G、ahpC/F、sodA/B基因之间的协同作用,为深入研究细菌内源H2O2的代谢及其调控机制提供了科学依据,也为进一步阐明动植物细胞中活性氧代谢机制奠定基础。
[1]范华锋,张忠义,刘振林.分光光度法测定食品中过氧化氢[J].中国卫生检验杂志,2006,16(9):1079-1080.
[2]张福平,刘燕菁.火龙果过氧化氢酶活性的研究[J].食品工业科技,2008,(11):128-129.
[3]黄永洪,花慧,沈国强,等.猪肝过氧化氢酶提取条件的研究[J].生物加工过程,2004,2(4):61-63.
[4]张烨,王克建,郝艳宾,等.影响核桃贮藏品质因素的分析[J].保鲜与加工,2005,5(3):4-5.
[5]王静,徐为民,诸永志,等.贮藏温度对鲜切牛蒡褐变的影响[J].江苏农业学报,2008,24(4):492-496.
[6]周显青,张玉荣,等.稻谷储藏中细胞膜透性,膜脂过氧化及体内抗氧化酶活性变化[J].中国粮油学报,2009,23(2):159-162.
[7]张玉荣,周显青,张勇.储存玉米膜脂过氧化与生理指标的研究[J].中国农业科学,2008,41(10):3410-3414.
[8]庞新跃,李欣,王娜,等.植物病原黄单胞菌毒性相关基因对内源过氧化氢的上游调控作用研究[J].植物病理学报,2011,41(4):379-384.
[9]李欣,李鑫玲,庞新跃,等.水稻白叶枯病菌内源过氧化氢在细胞分裂周期中的时空定位变化[J].中国农业科学,2012,45(8):1499-1504.
[10]周建波,吴茂森,胡俊,等.H2O2对水稻白叶枯病菌过氧化氢酶相关基因 crg表达的诱导作用[J].植物病理学报,2009,39(4):399-404.
[11]Barth C,Moeder W,Klessig D F,et al.The timing of senescence and response to pathogens is altered in the ascorbatedeficient Arabidopsis mutant vitamin c-l[J].Plant Physiol,2004,134(4):1784-1792.
[12]Turpaev K T.Reactive oxygen species and regulation of gene expression[J].Biochemistry-US,2002,67(3):281-292.
[13]Huycke M M,Moore D,Joyce W,et al.Extracellular superoxide production by Enterococcus faecalis requires demethylmenaquinone and is attenuated by functional terminal quinol oxidases[J].Mol Microbiol,2001,42(3):729-740.
[14]Yankovskaya V,Horsefield R,Törnroth S,et al.Architecture of succinate dehydrogenase and reactive oxygen species generation[J].Science(New York,N.Y.),2003,299(5607):700-704.
[15]Seaver L C,Imlay J A.Are respiratory enzymes the primary sources of intracellular hydrogen peroxide?[J].J Biol Chem,2004,279(47):48742-48750.
[16]Thannickal V J,Fanburg B L.Reactive oxygen species in cell signaling[J].Am J Physiol-Lung C,2000,279(6):1005-1028.
[17]李耀文,柳参奎.水稻CAT与逆境应答关系及酶活性分析[J].基因组学与应用生物学,2009,28(3):509-514.
[18]张建堂,高洁,吴茂森,等.转录调控因子OxyRxoo对水稻白叶枯病菌 H2O2降解途径的调控作用[J].微生物学报,2009,49(7):874-879.
[19]王艳丽,吴茂森,田芳,等.水稻白叶枯病菌ahpC基因的转录单元分析和原核表达[J].生物技术通报,2012,12:115-119.
[20]Panmanee W,Hassett D J.Differential roles of OxyR-controlled antioxidant enzymes alkyl hydroperoxide reductase(AhpCF)and catalase(KatB)in the protection of Pseudomonas aeruginosa against hydrogen peroxide in biofilm vs.planktonic culture[J].Fems Microbiol Lett,2009,295(2):238-244.
[21]Guo M,Block A,Bryan C D,et al.Pseudomonas syringae catalases are collectively required for plant pathogenesis[J].J Bacteriol,2012,194(18):5054-5064.
[22]Heo Y J,Chung I Y,Cho W J,et al.The major catalase gene(katA)of Pseudomonas aeruginosa PA14 is under both positive and negative control of the global transactivator OxyR in response to hydrogen peroxide[J].J Bacteriol,2010,192(2):381-390.
[23]王华芳,展海军.过氧化氢酶活性测定方法的研究进展[J].科技咨询导报,2009,19:7-8.
[24]Able A J,Guest D I,Sutherland M W.Hydrogen peroxide yields during the incompatible interaction of tobacco suspension cells inoculated with Phytophthora nicotianae[J].Plant Physiol,2000,124(2):899-910.
[25]Bestwick C S,Brown I R,Bennett M H,et al.Localization of hydrogen peroxide accumulation during the hypersensitive reaction of lettuce cells to Pseudomonas syringae pv.Phaseolicola[J].Plant Cell,1997,9(2):209-221.
[26]齐放军,高世强,吴茂森,等.一氧化氮和过氧化氢诱导水稻细胞过敏反应的协同作用分析[J].中国农业科学,2006,39(1):61-65.
[27]Gnanamanickam S S,Brindha P V,Narayanan N N,et al.An overview of bacterial blight disease of rice and strategies for its management[J].Curr Sci India,1999,77:1435-1443.
[28]Lauren C S,James A I.Alkyl Hydroperoxide Reductase Is the Primary Scavenger of Endogenous Hydrogen Peroxide in Escherichia coli[J].J Bacteriol,2001,183(24):7173-7181.
[29]Lauren C S,James A I.Hydrogen peroxide fluxes and compartmentalization inside growing Escherichia coli[J].J Bacteriol,2001,183(24):7182-7189.

