影响枯草芽孢杆菌B-1发酵南极磷虾壳的因素研究
陈雪姣,姜启兴,许艳顺,刘富俊,肖成立,许兆滨,夏文水,*
(1.江南大学食品学院,江苏无锡214122;2.辽宁省大连海洋渔业集团公司,辽宁大连116113)
南极磷虾(Euphausia superba),又名大磷虾或南极大磷虾。南极磷虾的生物量为6.5~10亿吨[1],资源蕴藏量巨大,是可供人类利用的海洋动物资源中蕴藏量最为丰富的一种,也是人类重要的后备蛋白库[2],除富含蛋白外,还含有人体所必需的全部氨基酸,富含亚油酸、亚麻酸等不饱和脂肪酸及钙、钾、镁、锶等多种矿物质元素,且类胡萝卜素色素含量高[3-4]。目前,国内研究更多关注南极磷虾肉中蛋白、脂溶性成分等的分离和应用[5],国外则侧重于对酶、脂肪酸等的分离纯化及其性质分析[6-7],对磷虾壳资源的研究较少。虾壳大多作为废弃物丢弃,亟需有效的开发利用,例如甲壳素。
目前利用虾壳废弃物制备甲壳素的技术存在明显不足:如一般采用强酸(HCl)脱钙和强碱(NaOH)脱蛋白,不仅这两种化学品对甲壳素的分子链都有一定的破坏,能耗高,废弃物对环境污染较严重,而且其中的蛋白、钙质等矿物质均作为杂质被除去,无法回收[8]。国外已有利用微生物发酵,对虾蟹等废弃物进行生物发酵制备甲壳素的研究,Zakaria[9]使用副干酪乳杆菌发酵虾壳,蛋白质去除率为77.5%。Jung[10]使用了副干酪乳杆菌发酵蟹壳,5d后使用另外一株灵杆菌继续发酵,最终脱蛋白率达到52%。该技术与传统的酸碱法相较反应更温和、甲壳素结构更稳定,成本低、是一种节能环保的清洁生产方法,发酵残渣即为粗甲壳素,经简单处理即可得到食用级甲壳素,可以实现对资源全面有效的利用,并且易于实现工业化生产[11]。
基于上述背景,本研究以筛选出的高产蛋白酶的枯草芽孢杆菌B-1水解磷虾加工下脚料中的蛋白质,研究发酵过程中枯草芽孢杆菌B-1产蛋白酶活力的变化,同时优化发酵脱蛋白条件。
1 材料与方法
1.1 材料与仪器
南极磷虾(Euphausia superb) 辽宁省大连海洋渔业集团公司提供,于-18℃冻藏,冷冻南极磷虾自然解冻,经采肉机采肉三次后得南极磷虾壳,于-18℃冻藏备用;枯草芽孢杆菌(Bacillus subtilis) 江南大学生物工程学院发酵实验室保藏菌种,活化后备用。
JB 5374-91电子天平 梅特勒-托利多仪器(上海)有限公司;FE20实验室pH计 梅特勒-托利多(上海)有限公司;YCR-180采肉机 上海华夏渔业机械仪器工贸公司;501型超级恒温器 上海市实验仪器厂;90-2恒温磁力搅拌器 上海亚荣生化仪器厂;电热恒温水槽 上海一恒科学仪器有限公司;电热恒温鼓风干燥箱 上海跃进医疗器械厂;UV1000紫外-可见分光光度计 上海天美科学仪器有限公司;4K-15高速冷冻离心机 Sigma公司;THZ-D恒温振荡器 太仓市豪诚实验仪器制造有限公司。
1.2 实验方法
1.2.1 外加碳源对枯草芽孢杆菌发酵虾壳产酶活力和虾壳蛋白去除率的影响 分别准确称取25g南极磷虾壳经121℃高温灭菌处理,装于250mL的玻璃瓶中,料液比1∶3,接种量 6%(1 ×108cfu/mL),37℃下120r/min摇床发酵36h,以不添加碳源为对照,分别添加葡萄糖、乳糖、蔗糖、果糖、可溶性淀粉作为碳源,添加量均为10%;测定发酵液蛋白酶活力及虾壳蛋白去除率,每个样品平行3次。
1.2.2 发酵时间对枯草芽孢杆菌发酵虾壳产酶活力和蛋白去除率的影响 分别准确称取25g南极磷虾壳经121℃高温灭菌处理,装于250mL的玻璃瓶中,料液比1∶3,接种量6%,37℃下摇床发酵,转速 120r/min,每隔12h取样测定,每个样品平行3次。
1.2.3 料液比对枯草芽孢杆菌发酵虾壳产酶活力和蛋白去除率的影响 分别准确称取25g南极磷虾壳经121℃高温灭菌处理,装于250mL容量的玻璃瓶中,料液比分别为 1∶1、1∶2、1∶3、1∶4、1∶5 接种量 6%,37℃下转速120r/min摇床发酵36h,每个样品平行3次。
1.2.4 接种量对枯草芽孢杆菌发酵虾壳产酶活力和蛋白去除率的影响 分别准确称取25g南极磷虾壳经121℃高温灭菌处理,装于250mL玻璃瓶中,接种量分别 1%、2%、4%、6%、8%,料液比 1∶3,37℃ 下120r/min摇床发酵36h,每个样品平行3次。
1.2.5 发酵温度对枯草芽孢杆菌发酵虾壳产酶活力和蛋白去除率的影响 分别准确称取25g南极磷虾壳经121℃高温灭菌处理,装于250mL的玻璃瓶中,料液比 1∶3,接种量 4%,分别于 30、35、37、40 和 45℃下摇床发酵36h,转速120r/min,每个样品平行3次。
1.2.6 转速对枯草芽孢杆菌发酵虾壳产酶活力和蛋白去除率的影响 分别准确称取25g南极磷虾壳经121℃高温灭菌处理,装于250mL的玻璃瓶中,料液比1∶3,接种量4%,37℃下摇床发酵36h,转速分别为0、60、120、180、240、300r/min,每个样品平行3 次。
1.2.7 起始pH对枯草芽孢杆菌发酵虾壳产酶活力和蛋白去除率的影响 分别准确称取25g南极磷虾壳经121℃高温灭菌处理,装于250mL的玻璃瓶中,起始 pH 分别为6.5、7.5、8.5、9.5 和 10.5,料液比 1∶3,接种量4%,120r/min摇床发酵36h,每个样品平行3次。
1.2.8 发酵工艺条件的优化 在单因素实验结果的基础上选择因素水平,外加碳源、转速、起始pH对枯草芽孢杆菌产酶活力和虾壳蛋白去除率的影响不大,而料液比过大对发酵液中的蛋白质回收不利,料液比过小影响溶氧量和酶活,故选取发酵时间、发酵温度、接种量三因素,以蛋白去除率为指标,采用L9(33)正交实验进行发酵工艺条件优化。实验因素水平见表1。

表1 发酵脱蛋白正交实验因素水平表Table 1 The factors and levels of orthogonal test of deproteinization by fermentation
1.3 分析方法
1.3.1 蛋白酶活力的测定 紫外分光光度法(QB/T1803-1993蛋白酶)。以L-酪氨酸浓度为横坐标,吸光值A275为纵坐标,得到L-酪氨酸标准曲线:以酪氨酸为标准物的工作曲线回归方程为:y=0.0075x-0.0058,相关系数 R2=0.999。
1.3.2 蛋白质去除率的测定 蛋白质去除率的测定参照 Aytekin[12],按照以下公式计算:
蛋白质去除率(%)=(原料中总蛋白质量-滤渣中蛋白质量)/原料中总蛋白质量×100
1.4 数据处理
数据分析采用SPSS(Statistical Product and Service Solutions)软件;数据绘图采用 Origin 8.0软件。
2 结果与分析
2.1 不同单因素对发酵产中性蛋白酶及蛋白去除率的影响
2.1.1 碳源对产酶活力和蛋白去除率的影响 不同的碳源对枯草芽孢杆菌产酶的影响和蛋白去除率结果见图1。
从图1可以看出,与不添加碳源的对照组相比较,添加葡萄糖等碳源的发酵组,其蛋白酶活力略有增加,但在几种糖之间无显著差异。而添加水溶性淀粉组对酶活影响反而无益,对枯草芽孢杆菌的生长无影响,产酶也没有较大的提高,产生这种现象的原因有可能是由于南极磷虾加工下脚料本身即可作为碳源氮源,且富含 Zn、Fe、Cu、Mn 等微量元素,Na、K、Ca、P、Mg 等常量元素[13],均可作为枯草芽孢杆菌的生长因子,综上考虑及成本的控制,下面的实验均不另外加入碳源。
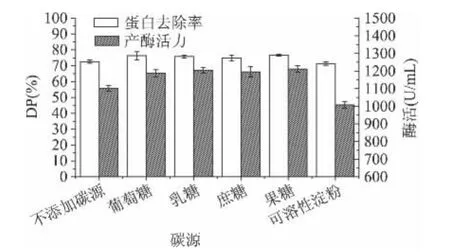
图1 碳源的选择对产酶活力和蛋白去除率的影响Fig.1 Effect of different carbon source on proteolytic activity and DP rate by Bacillus subtilis B-1
2.1.2 发酵时间对产酶活力和蛋白去除率的影响测定了不同发酵时间对蛋白酶的活力以及蛋白去除率,结果见图2。

图2 发酵时间对产酶活力和蛋白去除率的影响Fig.2 Effect of fermentation time on protease production and DP rate by Bacillus subtilis B-1
从图2可以看出,在12~36h内,蛋白酶活力呈上升趋势,在36h蛋白酶活力最高,达到1550U/mL,产生这种现象的原因可能是由于发酵初始,南极磷虾加工下脚料提供氮源,枯草芽孢杆菌在12~36h之间由对数期达到稳定期,在这期间产酶活性趋于增加,但是当发酵时间由36~72h时,菌种由稳定期向衰亡期过渡,蛋白酶活力也随之下降,但是由于蛋白酶的持续水解作用,虾壳的蛋白去除率则随着发酵时间的增加逐渐升高。
2.1.3 料液比对产酶活力和蛋白去除率的影响 研究了不同料液比下枯草芽孢杆菌的产酶活力及蛋白去除率,结果见图3。
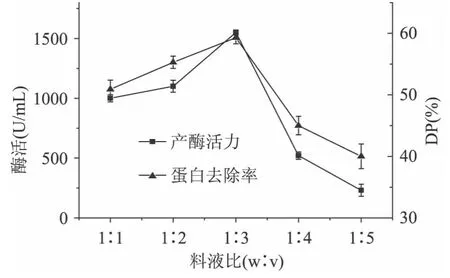
图3 料液比对产酶活力和蛋白去除率的影响Fig.3 Effect of different solid-liquid ratio on protease production and DP rate by Bacillus subtilis B-1
由图3表明,在发酵过程中,不同的料液比,发酵液的产酶活力也不同,最适宜料液比为1∶3,此时的蛋白酶活力及蛋白去除率都达到最高。可能料液比不同,对溶氧量有一定的影响,枯草芽孢杆菌是需氧菌,低溶氧不利于产酶[14]。
2.1.4 接种量对产酶活力和蛋白去除率的影响 研究了不同接种量对枯草芽孢杆菌的产酶活力和蛋白去除率的影响,结果见图4。

图4 接种量对产酶活力和蛋白去除率的影响Fig.4 Effect of different inoculum quanity on protease production and DP rate by Bacillus subtilis B-1
由图4表明,接种的枯草芽孢杆菌越多,发酵液的产酶活力和虾壳的蛋白去除率呈现总体增加的趋势,到4%以后趋于平稳;产生这种现象可能是当接种量增大到一定量时,菌种因为生长导致代谢产物的累积及营养的消耗,抑制了菌体的产酶速率。
2.1.5 发酵温度对产酶活力和蛋白去除率的影响研究了不同的发酵温度对产酶活力和蛋白去除率的影响,结果见图5。

图5 发酵温度对产酶活力和蛋白去除率的影响Fig.5 Effect of fermentation temperature on protease production and DP rate by Bacillus subtilis B-1
图5表明,随着发酵温度的升高,发酵液的产酶活力先升高后降低,最优发酵温度为37℃,此时产酶活力为1560U/mL,温度过低不利于菌体的生长及代谢产酶,温度过高,菌体易衰老而影响其正常生长和代谢。
2.1.6 转速对产酶活力和蛋白去除率的影响 研究了不同转速对产酶活力和蛋白去除率的影响,结果见图6。由图6可知,转速为120r/min时蛋白酶活力最大,转速由0~120r/min之间,随着转速的增大,蛋白酶活力增大,说明转速增大,溶氧增大,有利于产酶;当转速大于120r/min时蛋白酶活力不再升高,可能是转速继续增大,对枯草芽孢杆菌本身有损害,从而使蛋白酶活力降低。
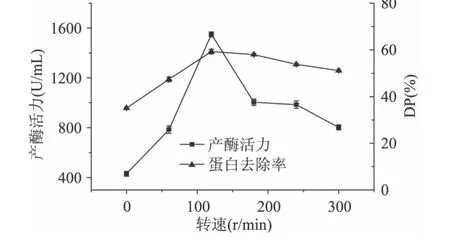
图6 转速对产酶活力和蛋白去除率的影响Fig.6 Effect of rotate speed on protease production and DP rate by Bacillus subtilis B-1
2.1.7 起始pH对产酶活力和蛋白去除率的影响 研究了不同起始pH对产酶活力和蛋白去除率的影响,结果见图7。由图7表明,最优pH为8.5,接近于虾壳自身的pH,此时蛋白酶活力为1590U/mL,pH降低或者升高,蛋白酶活力均降低,说明弱酸及弱碱环境均不利于菌株产酶。所以在后续实验中为了考虑人力成本及实验效果,发酵起始pH则使用虾壳自身的pH即可。
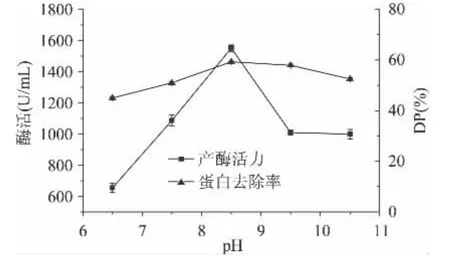
图7 起始pH对产酶活力和蛋白去除率的影响Fig.7 Effect of different initial pH on protease production and DP rate by Bacillus subtilis B-1
根据单因素实验结果,不外加碳源,转速选择120r/min,起始pH选择虾壳自身pH,考虑到枯草芽孢杆菌是需氧菌及发酵液的溶氧量,料液比选择1∶3,对发酵周期、发酵温度和接种量三因素的正交实验水平选择在48~72h,35~40℃和2%~6%的范围内。
2.2 发酵条件的正交优化
以蛋白去除率为指标,对发酵周期、发酵温度和接种量进行三因素三水平的正交实验。正交实验结果如表2所示。
根据表2中极差分析可以看出,影响枯草芽孢杆菌B-1发酵虾壳的蛋白脱除率因素主次顺序为A>C>B,即发酵周期为主要因素,其次是接种量、发酵温度;最佳发酵条件为A3B2C2,即发酵时间72h,发酵温度37℃,接种量为4%。为验证该优化的效果,进行了两次重复验证实验,结果蛋白去除率分别为:87.5%、90.3%,平均值为88.9%,高于正交最高值85.30%,说明实验结果可靠,此时在最优参数下,发酵液中的酶活力为1670U/mL。

表2 正交实验安排及结果分析Table 2 Orthogonal test arrangement and the result analysis
3 结论
在单因素实验(料液比1∶3、转速120r/min、虾壳自身pH)的基础上,通过发酵条件正交实验探明了影响发酵南极磷虾脱蛋白效果的另外三种主要因素影响顺序为:发酵周期对蛋白去除率影响最大,发酵温度次之,接种量影响最小。优化后的发酵工艺条件为:发酵时间72h,发酵温度37℃,接种量为4%,料液比1∶3。在此条件下进行发酵,蛋白去除率可达88.9%左右,可以作为南极磷虾生物发酵制备甲壳素的参考条件。到目前为止,所有发酵相关的研究都旨在评价生物处理的脱矿物质和脱蛋白效果,在此研究之前,Jo等[15]筛选 Serratia marcescens FS-3 发酵蟹壳,发酵7d后蛋白质去除率为84%,不同的微生物自身产蛋白酶的能力不一样,本研究中枯草芽孢杆菌高效的蛋白去除率和更短的发酵周期使得微生物发酵提取甲壳素这种节能环保的生产技术有了更大的进步。未来需要进一步解决的是规模扩大的技术问题,真正实现微生物发酵提取甲壳素的工业生产。
[1]宋素梅,刘富俊,姜启兴,等.南极磷虾虾壳中虾青素稳定性的研究[J].食品工业科技,2012,33(18):96-98.
[2]Tou J C,J Jaczynski,Y C Chen.Krill for human consumption:nutritional value and potential health benefits[J].Nutrition Reviews,2007,65(2):63-77.
[3]Yoshitomi B.Utilization of antarctic krill for food and feed[J].Developments in Food Science,2004,42:45-54.
[4].孙雷,周德庆,盛晓风.南极磷虾营养评价与安全性研究[J].海洋水产研究,2008,29(2):57-64.
[5]任艳.南极磷虾蛋白加工利用的初步研究[D].青岛:中国海洋大学,2009.
[6]Sjodahl J,Emmer A,Karlstam B,et al.Separation of proteolytic enzymes originating from Antarctic krill(Euphausia superba)by capillary electrophoresis[J] .Journal of Chromatography B:Biomedical Sciences and Applications,1998,705(2):231-241.
[7]Gigliotti J C,Davenport M P,Beamer S K,et al.Extraction and characterisation of lipids from Antarctic krill(Euphausia superba)[J].Food Chemistry,2011,125(3):1028-1036.
[8]刘斯雅,林瑞君,庄泽娟,等.植物乳杆菌发酵虾头,虾壳回收蛋白质和甲壳素的研究[J].现代食品科技,2011,27(4):408-411.
[9]Z Zakaria,GM Hall,G Shama.Lactic acid fermentation of scampi waste in a rotating horizontal bioreactor for chitin recovery[J].Process Biochemistry,1998,33(1):1-6.
[10]WJ Jung,GH Jo,JH Kuk,et al.Production of chitin from red crab shell waste by successive fermentation with Lactobacillus paracasei KCTC-3074 and Serratia marcescens FS-3[J].Carbohydrate Polymers,2007,68(4):746-750.
[11]林瑞君,庄泽娟,刘斯雅,等.以嗜酸乳杆菌发酵虾头虾壳回收蛋白质和甲壳素的研究[J].农产品加工,2010(11B):14-18.
[12]O Aytekin,M Elibol.Cocultivation of Lactococcus lactis and Teredinobacter turnirae for biological chitin extraction from prawn waste[J].Bioprocess and Biosystems Engineering,2010,33(3):393-399.
[13]李姝婧,姜启兴,夏文水.南极磷虾肌肉和加工副产物营养成分分析与评价[J].北京:中国科技论文在线,2012.http://www.paper.edu.cn/releasepaper/content/201207-73.
[14]段杉,张影霞,陆婷婷,等.利用乳酸菌发酵协同自溶作用回收虾头、虾壳中的蛋白质[J].食品与发酵工业,2009,35(2):80-83.
[15]GH Jo,WJ Jung,JH Kuk,et al.Screening of proteaseproducing Serratia marcescens FS-3 and its application to deproteinization of crab shell waste for chitin extraction[J].Carbohydrate Polymers,2008,74(3):504-508.

