伽马射线辐照对红豆分离蛋白功能性质的影响
李 杨,王 晶,陈 勇,马文君,王中江,王 瑞,毕 爽,江连洲,2,*
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.国家大豆工程技术研究中心,黑龙江哈尔滨150030)
红豆(Phaseolus angularis)菜豆属,豆科,俗称“赤小豆”、“红豆”、“赤豆”、“红小豆”、“小豆”[1]。红豆中蛋白质含量平均为25.2%,是一种优质的植物蛋白来源,营养分析显示红豆的氨基酸种类齐全,必需氨基酸水平达到甚至高于FAO/WHO的要求[2]。红豆蛋白作为豆类蛋白,它具有和大豆分离蛋白许多相似的蛋白结构和功能特性,如溶解性,乳化性,起泡性等。但红豆蛋白在我国利用率相对较低,是一种潜在的质优豆类蛋白资源[3]。随着人们生活水平的提高和健康意识的加强,对红豆蛋白资源开发和综合利用研究已逐步发展起来,这对于改善人们的膳食结构具有重要意义[4]。
辐照技术,是借助钴-60所产生的高能量、强穿透性的伽马射线,电离和激发物质产生的活化分子与活化原子,并发生一系列物理、化学、与生物化学变化,使物质发生聚合、交联、降解、并发生改性[5]。在食品方面,国际辐照食品联合专家委员会(JECFI),审阅并核实了大量国际研究资料后,在1980年得出“以贮存为目的,任何食品受到10kGy以下的辐照,没有毒理学危险,在营养学和微生物学上也是安全的”的结论[6]。近年来,我国逐步加快了辐照技术在食品中的应用研究,罗春萍[7]通过研究表明蛋白质受到低剂量到中剂量(<10kGy)的辐照后可以观察到一些功能的改变。黄小波等[8]研究发现辐照杀菌对鸡蛋蛋白液的pH、起泡性和泡沫稳定性、乳化性和乳化稳定性都会产生一定的影响。然而,在这些研究中,目前尚未有人研究低剂量辐照处理红豆蛋白,并解释对其功能特性的影响。
本实验主要利用60Coγ射线研究不同辐照剂量对红豆分离蛋白功能性的影响,包括吸水性、吸油性、溶解性、乳化性、乳化稳定性、起泡性和起泡稳定性,为辐照技术对红豆蛋白改性应用提供参考。
1 材料与方法
1.1 材料与仪器
红豆 购于哈尔滨市大润发超市(产地:黑龙江省海林);九三大豆油 购于哈尔滨市大润发超市;Lowry法蛋白质含量测定试剂盒 上海荔达生物科技有限公司;氢氧化钠、磷酸二氢钠、磷酸氢二钠、正己烷、盐酸等试剂 国产分析纯试剂。
PHSJ-4A型实验室pH计 中国上海雷磁公司;锤片式粉碎机 中国天津泰斯特仪器有限公司;TU-1800紫外可见分光光度计 北京普析通用仪器有限责任公司;FD5-3型冷冻干燥机 美国SIM公司;电子分析天平(0.0001g) 北京赛多利斯仪器系统有限公司;高速离心机 德国Eppendorf公司;FJ300-S数显高速分散均质机 上海越磁电子科技有限公司。
1.2 实验方法
1.2.1 红豆分离蛋白提取 红豆脱皮,粉碎过60目筛,正己烷脱脂三次,风干后碱溶酸沉法提取,冷冻干燥,得到的红豆分离蛋白在-20℃下储存备用。
1.2.2 红豆蛋白辐照处理 采用透明聚乙烯(PE)塑料袋包装,50g/袋,辐照处理在黑龙江省农业科学院玉米研究所进行辐照装置为60Coγ辐射源,辐照剂量分别为 1、3、5、7、10kGy。辐照后样品室温下贮存。
1.2.3 吸水性(WAC)测定 将0.2g蛋白样品与6mL蒸馏水加入离心管,振荡1min后静置10min,然后1600r/min离心25min,将上层清液倒出,把剩余样品连同离心管放于50℃烘箱内干燥25min,除去澄清水。吸水性(WHC)以每克蛋白结合水的克数表示[9]。
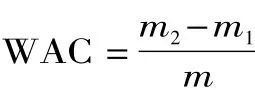
式中:m2为离心管重+沉淀物质量(g);m1为离心管重+蛋白质量;m为红豆蛋白样品质量(g)。
1.2.4 吸油性(OAC)测定 将0.5g样品与5mL豆油加入10mL离心管中,每5min振荡30s,30min之后将离心管放入离心机内以1600r/min速度离心25min,读取剩余大豆油的体积[9]。

式中:V1为加入大豆油总体积(mL);V2为剩余大豆油体积(mL);m为大豆分离蛋白样品质量。
1.2.5 溶解性测定 称取100mg红豆蛋白样品分散于10mL的去离子水中,磁力搅拌 30min,20℃、12000r/min离心20min。上清液经适度稀释,采用Lowry法测定蛋白质含量,以牛血清白蛋白为标准物绘制标准曲线。蛋白质的溶解度表示为上清液蛋白质量浓度占总蛋白质量浓度的百分比[10]。
1.2.6 乳化性及乳化稳定性测定 将15mL蛋白浓度为1%(w/v)的蛋白溶液与5mL大豆油混合,在13500r/min高速均质机下乳化2min,,将乳化液迅速倒入25mL小烧杯中,立即开始取样,取20μL的乳状液与5mL,0.1%的十二烷基磺酸钠(SDS)溶液均匀混合,在500nm处测定其吸光值,记为A0,乳状液静置30min后采用相同的方法测定乳状液吸光值,记为 A30,用 0.1%的 SDS 做空白对照[11]。
乳化性:
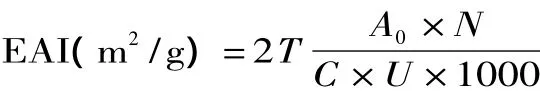
乳化稳定性:
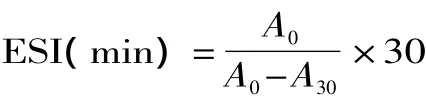
其中T=2.303,N:稀释倍数250,C:乳化液形成前蛋白质水溶液中蛋白质浓度(g/mL),U:乳化液中油的体积分数(0.25)。
1.2.7 起泡性及起泡稳定性测定 将一定浓度的蛋白溶液100mL置于500mL量筒中,使用高速乳化均质机以17500r/min的速度均质40s,连续3次共计2min,记录均质后的液面高度,记为 V0,静置30min后再 次 记 录 液 面 高 度,记 为 V30[12]。 起 泡 能 力(Foaming Capacity)和泡沫稳定性(Foaming Stability)公式如下:
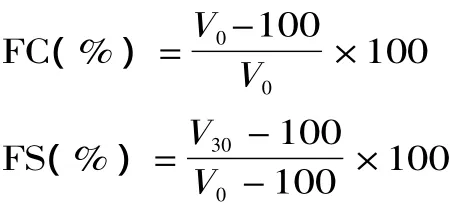
2 结果与分析
2.1 辐照处理对红豆蛋白持水性和持油性的影响
不同辐照处理对红豆蛋白持水性和持油性的影响如图1所示,随着辐照剂量的升高,红豆蛋白的吸水性呈先上升后下降的趋势,原因可能是由于辐照使得大量疏水基团外露及氢键和次级键的破坏,蛋白质变为不规则的松散排列方式,从而与水分子结合的机率提高,吸水性增加[13],随着辐照剂量的继续增加,蛋白结构彻底展开,使原本隐藏在蛋白质分子内部的疏水性基团暴露出来,导致可用于约束水的极性氨基减少,吸水性降低[14]。而吸油性随着辐照剂量的增加呈上升趋势,这可能是由于辐照使得蛋白质分子间的二硫键发生断裂,形成巯基,使疏水性基团暴露,从而吸油性有所增加[13]。而且随着辐照剂量的增加,蛋白分子粒径变小,这有助于颗粒与油的接触面积增加,其分散性增强,因而吸油性有明显提高。

图1 不同剂量辐照处理红豆分离蛋白的吸水性和吸油性的影响Fig.1 Effect of irradiation on water binding capacity and oil binding capacity of red bean protein
2.2 辐照处理对红豆蛋白溶解性的影响
在红豆分离蛋白制备过程中,蛋白分子间通过疏水相互作用等次级作用力而聚集,在碱分散过程中,部分聚集物不能有效解离,因而影响了蛋白溶解性[15]。在辐照处理时,红豆分离蛋白的分子结构展开,蛋白分子解聚,促进了溶解性的增强[3]。图2为对照样品和不同剂量辐照处理红豆蛋白的溶解度变化,由图可以看出,通过辐照处理后,其溶解性得到了明显改善,当辐照剂量达到5kGy时,溶解度达到最高。但随着辐照剂量的进一步增加,其溶解度有下降趋势。原因可能是由于辐照处理破坏了红豆蛋白中维持蛋白质高级结构的次级键,使肽链变得疏松裂解[16],同水分子结合能力增强导致蛋白质分子的原有结构破坏,从而使红豆分离蛋白溶解性的提高。但是随着辐照剂量的继续增加,蛋白分子进一步展开,使埋藏分子内部的疏水基团和巯基进一步暴露,伸展的蛋白分子之间通过非共价键作用重新形成大分子聚集体,因此溶解度下降[17]。
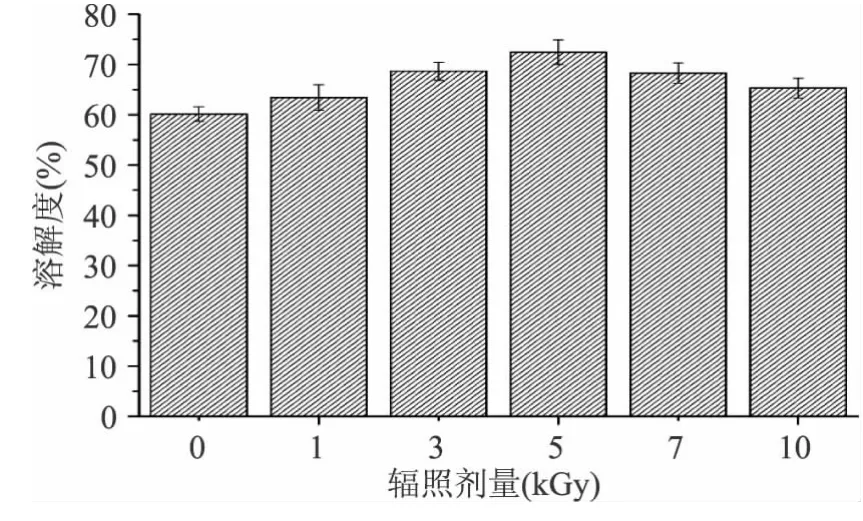
图2 不同剂量辐照处理红豆分离蛋白的溶解度的影响Fig.2 Effect of irradiation on solubility of red bean protein
2.3 辐照处理对红豆蛋白乳化性及乳化稳定性的影响
蛋白质的乳化特性与蛋白质溶解度、表面疏水性以及表面电荷分布相关[3]。还与分子的柔顺性及疏水性有关[18],图3为不同剂量辐照处理红豆分离蛋白的乳化性和乳化稳定性指数的影响,如图所示,随着辐照处理剂量的增加,红豆分离蛋白的乳化性得到显著提高,当辐照剂量达到5kGy时,乳化性达到最高,这是因为辐照处理使蛋白质结构展开,疏水基团暴露,疏水基团数量的增加会使蛋白更倾向于吸附在空气/水或油/水界面,造成乳化能力的升高[19]。但辐照剂量达到10kGy时,反而有显著下降,这可能是红豆蛋白分子内部发生聚集,聚集体具有一个疏水核心,外层被亲水基团包围,达到了界面张力大幅降低的临界点,随着辐射剂量的加强,超过了临界点,乳化性下降[13,20]。低剂量的辐照处理对乳化稳定性没有显著性影响,当剂量升高到5kGy时,乳化稳定性得到提高,可能是辐照加强了对油的吸附能力,而核外的亲水基团又加强了对水的结合能力[13]。

图3 对照样品和不同剂量辐照处理红豆分离蛋白的乳化性和乳化稳定性Fig.3 Effect of irradiation on emulsifying capacity and emulsifying stability of red bean protein
2.4 辐照处理对红豆蛋白起泡性及起泡稳定性的影响
不同剂量辐照处理红豆分离蛋白的起泡性及起泡稳定性如图4所示,由图可见,辐照处理可一定程度上提高蛋白溶液的起泡性和起泡稳定性,造成起泡特性变化的主要原因是辐照过程中蛋白质分子聚集体的形成与解离,导致分子的机械强度以及分子柔韧性的变化而引起的[11]。随着辐照剂量的增加,起泡性呈先上升后下降趋势,这可能是由于辐照处理使疏水基团充分暴露,红豆蛋白具有更大的表面活性,能降低水的表面张力,在剧烈搅拌时形成丰富的泡沫[21],但随着辐照剂量的增加,可溶性聚集体通过聚集形成更大的聚集体或者是可溶性聚集体解离,分解为分子量过小的肽链,不利于分子柔韧性以及机械强度的改善,造成了起泡性的下降[11]。随着辐照剂量的增加,泡沫稳定性呈上升趋势,泡沫稳定性的提高说明蛋白分子的机械强度和柔韧性没有遭到破坏,另一方面,二硫键对泡沫稳定性起着相当重要的作用[22],辐照处理后疏水性增强,更多的疏水部位和-SH的暴露,促进了疏水相互作用和-SH向-S-S-的交换反应,导致蛋白质分子间相互作用的增强,泡沫稳定性提高[23]。
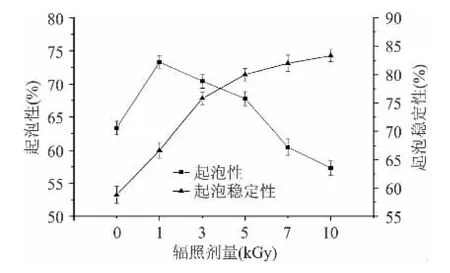
图4 对照样品和不同剂量辐照处理红豆分离蛋白的起泡性及起泡稳定性Fig.4 Effect of irradiation on foaming capacity and foaming stability of red bean protein
3 结论
辐照处理对红豆蛋白功能性质有显著影响。随着辐照剂量的增加,红豆蛋白的吸水性、溶解性、乳化性、起泡性均呈现先增加后减少的趋势,而吸油性、乳化稳定性和泡沫稳定性则呈现持续上升的趋势,这与不同剂量的辐照处理对红豆蛋白分子结构的影响有关。在低剂量辐照处理时,红豆蛋白的蛋白质结构展开,蛋白质变为不规则的松散排列方式,同混合相中其他物质结合能力增强,使红豆蛋白的功能性质得以提升,但随着辐照剂量的增加,埋藏在内部的疏水基团和巯基暴露,蛋白分子之间通过非共价键作用形成聚集体,红豆蛋白分子发生聚集,使吸水性、溶解性、乳化性等功能性质下降,但不断增大的疏水作用使蛋白分子间作用不断增强,吸油性、乳化稳定性和泡沫稳定性继续增强。不同剂量的辐照处理使红豆蛋白质结构发生不同程度的改变,进而影响其功能性质。
[1]余文慧.药食兼优赤小豆[J].药膳食疗,2004(8):33.
[2]Chau Chi-Fai,Cheung Peter CK,Wong Yum-Shing.Functional properties of protein concentrates from three Chinese indigenous legume seeds[J].Journal of Agricultural and Food Chemistry,1997,45(7):2500-2503.
[3]黄科礼,尹寿伟,杨晓泉.微射流处理对红豆分离蛋白结构及功能特性的影响[J].现代食品科技,2011,27(9):1062-1065.
[4]李杨,江连洲,刘琪,等.酶法水解红豆粉特性的研究[J].食品工业科技,2011(11):177-180.
[5]马以桂,徐力平.中国检疫处理需要辐照技术[J].口岸卫生控制,2002,7(6):3-7.
[6]刘伯业.辐照改性大豆分离蛋白/淀粉可生物降解材料研究[D].郑州:河南工业大学,2012.
[7]罗春萍.热加工、辐照及超高压微射流对花生过敏原Arah6结构与抗原性的影响[D].南昌:南昌大学,2011.
[8]黄小波,马美湖,李文革.辐照杀菌对鸡蛋蛋白液特性的影响[J].农业工程学报,2009(5):244-248.
[9]Guil-Guerrero JL,Navarro-Juárez R,López-Martınez JC,et al.Functional properties of the biomass of three microalgal species[J].Journal of Food Engineering,2004,65(4):511-517.
[10]Samoto Mashahiko,Maebuchi Motohiro,Miyazaki Chiaki,et al.Abundant proteins associated with lecithin in soy protein isolate[J].Food Chemistry,2007,102(1):317-322.
[11]郭凤仙,熊幼翎,何志勇,等.热处理对大豆分离蛋白功能特性的影响[J].食品与机械,2009(6):9-11.
[12]李维瑶,何志勇,熊幼翎,等.温度对于大豆分离蛋白起泡性的影响研究[J].食品工业科技,2010(2):86-88.
[13]莫耽,黄行健,段雅庆,等.辐照对大豆分离蛋白功能特性影响[J].食品科学,2011,32(1):52-55.
[14]Oneh Abu,Joseph Muller,Klaus Gyebi Duodu,et al.Functional properties of cowpea(Vigna unguiculata L.Walp)flours and pastes as affected by γ-irradiation[J].Food Chemistry,2005,93(1):103-111.
[15]尹寿伟,唐传核,温其标,等.微射流处理对芸豆分离蛋白构象和功能特性的影响[J].华南理工大学学报:自然科学版,2009,37(10):112-116,123.
[16]陈洁,盛奎川,常蕊,等.辐照处理对玉米醇溶蛋白流变性的影响[J].材料科学与工程学报,2011,29(2):263-266.
[17]张振山,刘玉兰,王娟娟,等.辐照对大豆中蛋白质品质的影响[J].食品工业科技,2013,34(2):104-107.
[18]Liu,Keshun.大豆化学加工工艺与应用[M].哈尔滨:黑龙江科学技术出版社,2005.
[19]Camino Nerina A,Pérez Oscar E,Sanchez Cecilio Carrera,et al.Hydroxypropylmethylcellulose surface activity at equilibrium and adsorption dynamics at the air-water and oil-water interfaces[J].Food hydrocolloids,2009,23(8):2359-2368.
[20]蔡立志,宋玉兰.大豆蛋白的乳化功能及表征研究[J].食品科学,1999,20(10):20-24.
[21]张慧,卞科,万小乐.超微粉碎对谷朊粉理化特性及功能特性的影响[J].食品科学,2010(1):127-131.
[22]Handa A,Gennadios A,Froning GW,et al.Tensile,solubility,and electrophoretic properties of egg white films as affected by surface sulfhydryl groups[J].Journal of Food Science,1999,64(1):82-85.
[23]乔一腾,司玉慧,盖国胜,等.超微粉碎对大豆分离蛋白功能性质的影响[J].中国食品学报,2012,12(9):57-61.

