麻疯树籽壳乙醇提取物的抗氧化活性研究
马 博,张婷婷,刘细祥,李荣峰,农定确
(百色学院化学与生命科学系,广西百色533000)
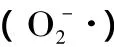
1 材料与方法
1.1 材料与试剂
麻疯树籽 购买于广西南宁富民达生物科技有限公司。麻疯树籽去杂除尘后脱仁,籽壳置于电热鼓风干燥箱内50℃干燥72h,粉碎、过60目筛,石油醚索氏回流脱脂12h、挥干石油醚,将其4℃保藏、备用。
1,1-二苯基-2-苦基肼(1,1-Diphenyl-2-picrylhydrazyl radical,DPPH)和 2,4,6- 三 吡 啶基-S-三嗪(ferric-tripyridyltiazine,TPTZ)Sigma公司;2,6-二叔丁基-4-甲基苯酚(Butylated hydroxytoluene,BHT)(GC,>99.0%) 阿拉丁公司;芦丁国药集团化学试剂有限公司;邻苯三酚、三羟基甲基氨基甲烷(Tris)、抗坏血酸(VC)、无水对氨基苯磺酸、盐酸萘乙二胺、硝酸铝、亚硝酸钠、无水乙醇、石油醚(30~60℃)及柠檬酸等均为分析纯。
1.2 仪器与设备
UV-2700紫外可见分光光度计 日本岛津;FA2004电子分析天平 上海舜宇恒平科学仪器有限公司;TGL-16M高速冷冻离心机 湘仪离心机仪器有限公司;HH-S2数显恒温水浴锅 金坛市医疗仪器厂;DHG-9146A型鼓风干燥箱 上海精宏实验设备有限公司;LD-200中药粉碎机 长沙常宏制药机械设备厂。
1.3 实验方法
1.3.1 麻疯树籽壳乙醇提取物制备 取麻疯树籽壳粉,按照料液比1∶25,溶于70%(V/V)的乙醇溶液中,85℃回流提取2.5h,抽滤,滤液减压除去乙醇,定容。
1.3.2 麻疯树籽壳乙醇提取物中总黄酮含量测定采用亚硝酸钠-硝酸铝-氢氧化钠显色法绘制标准曲线[5]。分别精密量取0.2mg/mL芦丁溶液(30%乙醇制)0、1.0、2.0、3.0、4.0、5.0mL,置入 25mL 容量瓶中,各加1.0mL 5%的NaNO2溶液,混匀后静置6min;再各加1.0mL 10%的Al(NO3)3溶液,混匀,静置6min;最后各加10mL 4%的NaOH溶液,混匀,30%乙醇溶液定容,静置15min。以空白试剂为对照,在510nm处测定各自吸光度,再以吸光度(A)为纵坐标、以芦丁的不同质量浓度为横坐标,绘制标准曲线,所得回归方程为Y1=10.993x-0.0005,R2=0.9998,线性范围为8~40μg/L。取1.0mL麻疯树籽壳乙醇提取液,置入25mL容量瓶中,按照上述方法进行测定总黄酮提取液的吸光度,并代入回归方程,求出麻疯树籽壳乙醇提取液中总黄酮的质量浓度。代入公式(1)计算麻疯树籽壳乙醇提取物中总黄酮的含量。

式中,R为总黄酮含量(%);c为提取液中黄酮浓度(mg/mL);v为黄酮提取液体积(mL);n为稀释倍数;m为麻疯树籽壳质量(g)。

1.3.4 DPPH自由基清除实验 DPPH·是一种较为稳定的以氮为中心的芳香族自由基,其醇溶液呈紫色,在517nm处有特征峰。抗氧化剂通过传递电子或氢原子来中和DPPH·,使其在517nm下吸光度下降,进而评价供试物抗氧化能力。按照参考文献[7],稍作修改。6.5mmol/L的DPPH溶液(无水乙醇配制)4.0mL,加无水乙醇1.0mL,混匀、反应40min后,于517nm测吸光度,记录为A0;用不同黄酮质量浓度的麻疯树籽壳乙醇提取液代替1.0mL无水乙醇,其余步骤同上,于517nm测吸光度,记录为 A1;用4.0mL无水乙醇代替DPPH溶液,并用不同黄酮质量浓度的麻疯树籽壳乙醇提取液代替无水乙醇,混匀、反应 40min后,于 517nm测吸光度,记录为 A2。DPPH·清除率 η3(%)=[1-(A1-A2)/A0]×100。

1.3.6 还原力的测定实验 采用普鲁士蓝法。按照参考文献[6],稍作修改。取2.5mL不同黄酮质量浓度的麻疯树籽壳乙醇提取液,加入0.2mol/L的PBS(pH6.6)2.5mL,混匀,再加入 1%(m/V)的 K3Fe(CN)62.5mL,混匀,50℃水浴20min后,再加入10%(V/V)三氯乙酸 2.5mL,混匀,3000r/min离心10min,取上清液5mL加入0.1%的FeCl3溶液1mL,后用蒸馏水补至10mL,混匀并静止10min,在700nm处测吸光值。
1.3.7 总抗氧化能力实验 采用铁离子还原/抗氧化能力分析法(Ferric reducing/antioxidant Power,FRAP)法[10]。先用 0.04mol/L 的 HCl溶液配制0.01mol/L的TPTZ溶液,然后与0.3mol/L的醋酸钠缓冲液(pH3.6)、0.02mol/L 的 FeCl3溶液按照 10∶1∶1的体积比混合得到TPTZ工作溶液。再分别取不同黄酮质量浓度的麻疯树籽壳乙醇提取液0.1mL,加入1.8mL预热至37℃的FRAP工作液,用蒸馏水补至5mL,混匀,37℃下反应20min,于593nm处测定其吸光度,并在FeSO4标准曲线上查得FRAP值(以mmol/L的Fe2+表示)。用不同摩尔浓度FeSO4溶液代替麻疯树籽壳乙醇提取液,其余操作同上,以吸光度为纵坐标,以不同摩尔浓度FeSO4为横坐标,标准曲线绘制。
1.4 数据统计与分析
利用SPSS13.0软件包进行数据统计分析,并借助Excel 2003进行作图。
2 结果与分析
2.1 麻疯树籽壳乙醇提取物中总黄酮的测定
麻疯树籽壳乙醇提取物中总黄酮含量为6.61%。
2.2 超氧阴离子清除作用

图2 麻疯树籽壳乙醇提取物对超氧阴离子的清除作用Fig.2 Scavenging activity of ethanol extracts from Jatropha curcus L.seed shell on superoxide anion radicals
2.2 DPPH自由基清除作用
由于DPPH·实验敏感性强、重现性好、操作简单、短时内能做多个样品,目前已被广泛用于评价抗氧化剂的抗氧化性能[10-11]。由图3所示。在质量浓度0.05~0.3mg/mL范围内,麻疯树籽壳乙醇提取物和BHT对DPPH·清除率都随质量浓度的增大而增加,而后二者清除率均不再显著增加。另外,从质量浓度0.2mg/mL起,麻疯树籽壳乙醇提取物的DPPH·清除率大于BHT,但麻疯树籽壳乙醇提取物的DPPH·清除率在测定浓度范围内明显均低于VC。麻疯树籽壳乙醇提取物的黄酮半数抑制浓度(IC50)为0.185mg/mL,大于VC的0.085mg/mL,略低于BHT的0.186mg/mL,可见麻疯树籽壳乙醇提取物具有较强的DPPH·清除能力。

图3 麻疯树籽壳乙醇提取物对DPPH·的清除作用Fig.3 Scavenging activity of ethanol extracts from Jatropha curcus L.seed shell on DPPH radicals
2.3 亚硝酸盐清除作用
亚硝胺是已知致癌性最强的化学物质之一,它可由亚硝酸盐和胺类在人及动物的胃中合成。因此,清除体内亚硝酸盐是防止癌症的重要途径。结果表明,NaNO2的回归方程为Y2=0.1151x+0.0616,R2=0.9966,线性范围为5~20mg/L。由图4可知,在测定的黄酮质量浓度范围内,麻疯树籽壳乙醇提取物的亚硝酸盐清除率与其黄酮质量浓度密切相关,其半数抑制浓度(IC50)为0.494mg/mL,大于 VC的0.115mg/mL,但其黄酮质量浓度超过0.5mg/mL后,其亚硝酸盐清除率开始高于BHT,而BHT清除率在测定范围内均小于50%。当麻疯树籽壳乙醇提取物中黄酮的质量浓度为1.0mg/mL时,其清除率达到81.63%。由此说明麻疯树籽壳乙醇提取物具有较强的亚硝酸盐清除能力。

图4 麻疯树籽壳乙醇提取物对亚硝酸盐的清除作用Fig.4 Scavenging activity of ethanol extracts from Jatropha curcus L.seed shell on nitrite
2.4 还原力
抗氧化剂通过自身还原作用供给电子而使自由基变为稳定分子,失去活性,故还原力是反映抗氧化剂提供电子能力的重要指标。待测物的还原力与吸光度大小相关,吸光度越大,还原力越强,抗氧化性越强,还原力可通过待测物吸光度大小来表示[10]。由图5可知,麻疯树籽壳乙醇提取物中黄酮的质量浓度在0.1~0.5mg/mL范围时,其吸光度与质量浓度之间存在剂量依赖关系;在0.7~1.0mg/mL范围时,其吸光度基本稳定,并与同质量浓度的对照VC吸光度相当;当麻疯树籽壳总黄酮质量浓度超过0.3mg/mL时,其吸光度大于BHT。可见麻疯树籽壳乙醇提取物在高质量浓度下具有较强的还原力。

图5 麻疯树籽壳乙醇提取物的还原力Fig.5 Reducing power of ethanol extracts from Jatropha curcus L.seed shell
2.5 总抗氧化能力
FRAP作为最简单、快速、廉价的常规分析方法之一,目前已发展成一种直接测定供试物抗氧化能力的方法[11]。结果显示,FeSO4的线性回归方程为Y3=2.2045x+0.0935,R2=0.9999,线性范围为 0.025~0.8mmoL/L。麻疯树籽壳乙醇提取物的抗氧化能力如图6所示。在测定浓度范围内,其FRAP值随着质量浓度增加而增强,且均大于BHT而小于VC。在麻疯树籽壳乙醇提取物的黄酮质量浓度为1.0mg/mL时,其FRAP值为1.08mmol/L,表明麻疯树籽壳乙醇提取物具有较强的抗氧化能力。
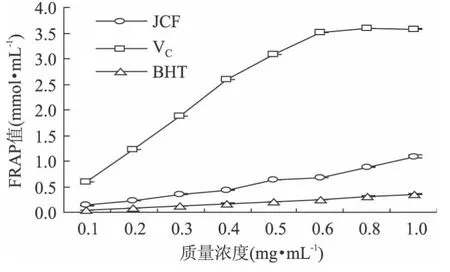
图6 麻疯树籽壳乙醇提取物的总抗氧化能力Fig.6 Total antioxidant ability of ethanol extracts from Jatropha curcus L.seed shell
3 结论
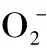
[1]全治国,赵静峰,羊晓东,等.小桐子的化学成分及药理作用研究进展[J].云南化工,2009,36(2):39-43.
[2]李玲,李晓帆,吴慧星,等.麻疯树种子中抗氧化活性成分的研究[J].中草药,2010,41(12):1932-1936.
[3]马博,兰翠玲,李力,等.麻疯树籽粕饲用品质改良及其深加工技术研究进展[J].中国油脂,2011,36(5):26-30.
[4]刘细祥,马博,张婷婷,等.响应面法优化麻疯树籽壳总黄酮工艺的研究[J].食品工业科技,2014,35(6):284-287,291.
[5]张婷婷,马博,李荣峰,等.桂西野生蕨菜黄酮提取工艺的研究[J].北方园艺,2013,16:163-165.
[6]宣丽,刘长江.不同提取方法对软枣猕猴桃多糖单糖组成及抗氧化活性的影响[J].天然产物研究与开发,2013,25:1260-1265.
[7]郭峰,岳永德,汤峰,等.用清除有机自由基DPPH法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008,28(7):1578-1582.
[8]李利华.马铃薯块茎粗多分体外抗氧化活性[J].食品与发酵工业,2013,37(9):176-179.
[9]Benzie IF,Strain JJ.The ferric reducing ability of plasma(FRAP)as a measure of“antioxidant power”:the FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
[10]Choe JH,Jang A,Choi JH,et al.Antioxidant Activities of Lotus Leaves(Nelumbo nucifera)and Barley Leaves(Hordeum vulgare)Extracts[J].Food Science Biotechnology,2010,19(3):831-836.
[11]Jagtap UB,Panaskar SN,Bapat VA.Evaluation of Antioxidant Capacity and Phenol Content in Jackfruit(Artocarpus heterophyllus Lam.)Fruit Pulp[J].Plant Foods for Human Nutrition,2010,65:99-104.

