香蕉枯萎病生防菌的筛选及生防物质分析
王 芳,吕 顺,刘文清,曾莉莎,杜彩娴,周建坤,韩秀香,刘建平
(广东省东莞市香蕉蔬菜研究所,广东 东莞 523061)
香蕉是位于水稻、小麦、玉米之后的世界第四大粮食作物,也是仅次于柑桔的第二大宗水果,更是世界水果贸易量最大宗的鲜果。香蕉枯萎病是由尖孢镰刀菌古巴专化型[Fusarium oxysporum f.sp.cubense(FoC)]侵染引起的一种土传真菌病害。目前该病在珠江三角洲香蕉产区多个县市有分布,病园病株率为10%~40%,严重的达90%以上,以致蕉农失收,大量蕉园丢荒[1]。香蕉枯萎病已经严重阻碍了香蕉的生产和发展,成为香蕉生产过程中急需解决的问题[2-3]。
香蕉枯萎病的防治是现阶段研究的重点,目前香蕉枯萎病的防治方法主要有采用抗病品种和采用化学药剂,但是,由于香蕉具有单性结果,多倍性、高度不育、没有种子等特性,很难进行杂交育种,因此香蕉抗病品种选育进度缓慢。而香蕉枯萎病是一种土传病害,危害香蕉的维管束,目前还没有有效防治的化学药剂[4-5]。近年来,香蕉枯萎病生物防治越来越受到国内外研究者的青睐,并取得了一些成效[6-7],目前利用的生防菌主要有芽孢杆菌、假单孢菌、沙雷氏菌、洋葱伯克尔德氏菌、菊欧氏杆菌、木霉菌、非致病性尖孢镰刀菌和链霉菌等。研究表明,生防菌分泌的抗生素、酶类物质或类植物激素是生防物质。用于防治棉花黄萎病的内生细菌可能产生蛋白酶降解毒素或产生抑制物抑制致病因子[8]。几丁质酶可通过降解真菌菌丝生长末端新合成的几丁质而破坏菌丝端部生长,达到抑制病原真菌生长的目的[9]。纤维素酶中的β-1,3-葡聚糖酶直接攻击真菌菌丝上的葡聚糖,抑制真菌的生长[10]。嗜铁素通过配基的螯合使环境中的铁浓度降低,从而使病原微生物缺铁而不能生长繁殖,进而达到控制植物病害的目的[11]。植物根际微生物产生吲哚乙酸(indole-3-acetic acid,IAA)对植物具有一定的促生作用,另外也有许多研究表明微生物分泌的嗜铁素在一定的环境下对植物的生长具有促进作用[12-14],这些物质能促进植株生长健壮,增强植株对病害抵抗力。因此,本研究进行了香蕉枯萎病生防菌的较大规模的筛选,并对筛选出来的大量的香蕉枯萎病生防菌进行了产水解酶、嗜铁素、吲哚乙酸等生防相关物质测定分析,对生防菌进行了评价筛选,以期为香蕉枯萎病生防菌的进一步研究应用奠定基础。
1 材料和方法
1.1 材料
东莞市香蕉蔬菜研究所从东莞地区种植的不同品种香蕉的根、球茎、假茎以及香蕉、甘蔗、蔬菜的根际土壤分离的3 013个细菌分离物,置于-70 ℃冰箱中保存备用。
香蕉枯萎病病原菌4 号生理小种(Fusarium oxysporum f.sp.Cubense race 4,FOC4),由华南农业大学资源环境学院姜子德教授馈赠。
1.2 方法
1.2.1 香蕉枯萎病生防菌的拮抗能力分析 采用平板对峙培养法,先将病原菌FOC4 接种至PDA(Potato Dextrose Agar)平板培养5~7 d,然后在菌落边缘打取直径为6 mm 的菌饼,将其移至空白共培养平板(蛋白胨5 g,葡萄糖10 g,肉汁浸膏3 g,NaCl 5 g,琼脂20,pH7.0)中央,在距离病原菌菌饼约2.5 cm处接种细菌,以不接种细菌作为对照,每个处理重复3 次,28 ℃培养7~14 d 后观察有无抑菌圈的产生。根据抑菌强弱分为四种类型:无拮抗(无明显抑菌现象)、拮抗性弱(有抑菌现象,但7 d 内被病原菌完全或部分覆盖)、拮抗性中(7 d 内抑菌圈明显,但7 d 后被病原菌覆盖,或被包围,抑菌圈不明显)、拮抗性强(14 d 后仍有明显抑菌圈,不被病原菌覆盖)。
1.2.2 产酶和代谢物活性测定 产生细胞壁降解酶和抗真菌次生代谢物是细菌抑制病原物的常见机制。为了更好地了解这些拮抗细菌,笔者研究了拮抗细菌产生水解酶和次生代谢物的潜力。
(1)蛋白酶活性测定。将细菌在蛋白酶检测平板上(A:脱脂奶粉8 g,溶于300 mL 水中,115 ℃灭菌10 min;B:琼脂8 g,定容至300 mL,121 ℃灭菌20 min,A 与B 分别灭菌后混合)接菌,30 ℃培养3 d后观察,产生清亮斑的则视为能产生蛋白酶[15]。
(2)几丁质酶活性测定。将细菌在以胶体状几丁质为唯一碳源的培养基(磷酸二氢铵1.0 g,氯化钾0.2 g,水合硫酸镁0.2 g,胶体状几丁质10 g/L100 mL,琼脂20 g,pH=7.0)上培养,接菌后30 ℃培养3 d,观察有透明圈的则能产生几丁质酶[16]。
(3)纤维素酶活性测定。将细菌接到纤维素酶活性测定平板上(蛋白胨10 g,酵母粉10 g,羧甲基纤维素钠10 g,氯化钠5 g,磷酸二氢钾1 g,琼脂18 g,pH=7.0),30 ℃培养3 d 后,用1 g/L 的刚果红染1 h后,倒掉染液,再用1 mol/L 的NaCl 浸泡1 h,观察有透明圈的则能产生纤维素酶[17]。
(4)β-1,3-葡聚糖酶活性测定。将细菌接到苯胺蓝葡聚糖琼脂培养基(葡萄糖1.0 g,茯苓粉4.0 g,K2HPO41.0 g,Na2HPO43.0 g,苯胺蓝0.06 g,FeSO4·7H2O 0.5 g,琼脂粉12 g,蒸馏水1 000 mL)上培养。于25 ℃恒温培养,观察菌落周围颜色变化。观测平板上有无色水解区的则能产生β-1,3-葡聚糖酶[18]。
(5)产吲哚乙酸活性测定。将细菌接入1%胰蛋白胨水溶液(pH=7.2~7.6),培养2 d 后加入3~5 mL埃利希氏试剂(二甲氨基苯甲醛8 g,溶于760 mL 95%酒精和160 mL 浓盐酸),观察液面如果变红则能产生吲哚乙酸。
(6)产嗜铁素活性测定。参照Shin 等[19]的方法,将细菌接入产嗜铁素活性测定平板上(A:60.5 mg铬天青S 溶于50 mL 去离子水;10 mL 三价铁溶液(1 mmol/L FeCl3.6H2O,10 mmol/L 盐酸为溶剂);72.9 mg CTAB 溶于40 mL 去离子水。上述3 个溶液混合定容至100 mL,pH 调至中性,121 ℃灭菌20 min。B:30.24 g Pipes 加入900 mL WA 培养基,pH=6.8,121 ℃灭菌20 min。A、B 液混合倒平板),30℃培养3 d 后观察,产生橘黄色晕圈则能产嗜铁素。
2 结果与分析
2.1 香蕉枯萎病生防菌的拮抗分析
经过平板对峙,从本单位获得的3 013份分离物中筛选到182 份对FOC4 具有一定拮抗作用的菌株,所占比例6.04%。通过对平板对峙实验结果的测量和观察,发现其中拮抗性强的有91 株,占总拮抗菌株数的50%,占总的分离物的比例3.02%;拮抗性中等的有60 株,占总拮抗菌株数的32.97%,占总的分离物的比例1.99%;拮抗性弱的有31 株,占总拮抗菌株数的17.03%,占总的分离物的比例1.03%。
2.2 香蕉枯萎病生防菌的产酶和次生代谢物的分析
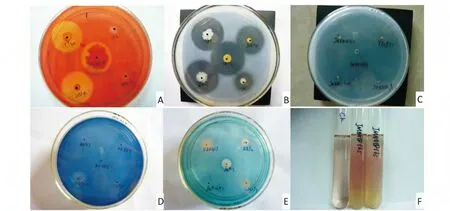
图1 生防菌水解酶和次生代谢物活性的测定Fig.1 Lytic enzymes and metabolites activity determination of the antagonistic bacter
参考前人的方法,进行了生防菌的产酶和次生代谢物的分析(图1,表1),结果表明:筛选出的拮抗菌中能产纤维素酶的有93 株,占总菌株数的51.10%,能产蛋白质酶的有161 株,占总菌株数的88.46%,能产几丁质酶的有62 株,占总菌株数的34.07%,能产β-1,3-葡聚糖酶的有97 株,占总菌株数的53.30%,能产嗜铁素的有142 株,占总株数的78.02%,能产吲哚乙酸的有75 株,占总株数的41.21%。在筛选到的182 株拮抗菌中多数拮抗菌株都能产生检测的水解酶或者次生代谢物中的1 种或多种。拮抗菌中大部分的菌株能产生蛋白酶和嗜铁素,能产生几丁质酶和吲哚乙酸的较少,一半左右的菌株能产生纤维素酶和β-1,3-葡聚糖酶。从拮抗水平不同的菌株之间比较看,拮抗高的类型,其能产几丁质酶的菌株比例最低,其余的比例中等;拮抗中的类型能产各种水解酶和嗜铁素的菌株比例均为最高,拮抗弱的类型其产吲哚乙酸的菌株比例为最高,产各种水解酶(除几丁质酶以外)和嗜铁素的菌株的比例最低。

表1 产酶和次生代谢物的菌株数量比较Tab.1 Quantitative comparison of strains producing lytic enzymes and metabolites
2.3 香蕉枯萎病生防菌的评价筛选
参考Berg 等[20]的方法,采用赋值的方法来评价和筛选香蕉枯萎病生防菌,具有4 种水解酶中的任何一种、或者两种次生代谢物的任何一种的赋值1 分,拮抗性强的赋值3 分,拮抗性中等的赋值2 分、拮抗性弱的赋值1 分。经统计,得分从1 至8 分,其中1 分的有1 株,2 分的有6 株,3 分的有10 株,4 分的有13 株,5 分的有32 株、6 分的有66 株,7 分的有JMBX③g8、通R 等41 株,8 分的有冬R1、N2D7 等14株。表2 列出了筛选出了比较有潜力的菌株(得分为7 及以上的菌株),以及其产酶和次生代谢物、拮抗强弱情况。其中拮抗强的菌株37 株,拮抗中的菌株17 株,拮抗弱的菌株1 株。

表2 香蕉枯萎病拮抗细菌的赋值评价及筛选Tab.2 Assessment of antagonistic bacteria against FOC4 and list of the most promising candidates

续表2 香蕉枯萎病拮抗细菌的赋值评价及筛选Tab.2 Assessment of antagonistic bacteria against FOC4 and list of the most promising candidates
3 讨论
香蕉枯萎病是一种毁灭性的病害,严重影响了我国的香蕉产业,目前还没有好的抗病品种以及有效的化学防治药剂,对环境污染相对小的生防菌制剂是目前研究的热点。肖爱萍等[21]报道了5 株香蕉枯萎病生防菌,对香蕉枯萎病的孢子萌发抑制率达到90.49%~97.18%;李晓杰[22]等分离的1 株拮抗真菌,对该病的防效60%以上。但是由于香蕉枯萎病病原菌种群分化和遗传多样性高,存在病原菌地理小种和致病力的分化,造成生防菌的防效和抗病品种的抗性不稳定[23-24],因此需要更加广泛地进行生防菌的分离,不断筛选有效的生防菌。笔者所在的课题组从不同的生境分离到了3 013份细菌分离物,经过与FOC4 的对峙试验,获得了182 株拮抗菌,根据培养7~14 d 的拮抗表现,将拮抗菌分成:拮抗性强、拮抗性中、拮抗性弱3 类。其中拮抗强的类型最多,有91 株,培养14 d 后仍有明显抑菌圈,不被病原菌覆盖。拮抗弱的菌株最少,只有31 株,60 株拮抗作用中等,可见香蕉枯萎病拮抗菌在东莞的土壤和植株中广泛存在,通过大量的分离,可以获得有潜力的生防菌株。
微生物的生防机理包括产生抗病酶活、产生抗生素、产生拮抗蛋白、产生诱导抗性、病原菌竞争营养及生态位与对植物的促生作用等,孙建波等[25]筛选出一株产几丁质酶的香蕉枯萎病拮抗菌,对香蕉枯萎病有较强的抑制作用。邢介帅等[26]从小麦根际土壤中分离到一株高产蛋白酶并对多种植物病原真菌具有拮抗作用的生防细菌T2,并发现该细菌菌株产生的胞外蛋白酶可能与病菌菌丝生长受抑制密切相关。余美贤等[27]从海南岛橡胶树根际土壤中分离到一株产嗜铁素能力较强的菌株CAS15,通过室内平板对峙试验研究,发现CAS15 对15 个常见植物病原菌的拮抗作用。李桂霞等[28]通过导入β-1,3-葡聚糖酶基因提高番茄灰霉病高效拮抗菌株生防效果。可见微生物产生的水解酶及次生代谢物是生防因子,与其生物防治效果密切相关。为了更好地对筛选出来的大量的拮抗菌进行评价,了解其拮抗机理,进行有效的筛选,本研究对182 株拮抗菌进行了产水解酶,包括蛋白酶、纤维素酶、几丁质酶和β-1,3-葡聚糖酶以及产次生代谢物嗜铁素和促生物质吲哚乙酸的分析。相对来说拮抗作用中强的菌株其产生的水解酶或者次生代谢物种类较多,拮抗作用弱的菌株其产生的水解酶或者次生代谢物种类较少,通过赋值筛选的结果看,得分7 和8 的菌株中,有17 株拮抗性中等的菌株,这些菌株的产酶或者次生代谢物的种类较多,因此在生防菌的筛选中,拮抗性中等的菌株也不能忽略。其中仅有1 株是拮抗作用弱的菌株,但拮抗作用弱的菌株,分泌促生物质的菌株比例较高,在复合生防菌的利用中,可以适当考虑添加拮抗弱的菌株,以增强生防菌制剂的促生作用。目前,笔者所在的课题组正在对筛选出来的菌株进行大田防效的验证。本研究中对产水解酶和次生代谢物的测定,为进一步研究拮抗菌株的拮抗机理奠定了基础。同时根据拮抗强弱、产酶以及次生代谢物对大量的生防菌进行赋值评价,以期为香蕉枯萎病生防菌的筛选提供更有效、合理的评判依据。
[1]刘景梅,王璧生,陈霞,等.广东香蕉枯萎病菌生理小种RAPD 技术的建立[J].广东农业科学,2004,31(4):43-45.
[2]王璧生,罗启浩.广东香蕉的主要病害及其防治[J].中国南方果树,1997,26(3):33-35.
[3]魏岳荣,黄秉智,杨护,等.香蕉镰刀菌枯萎病研究进展[J].果树学报,2005,22(2):154-15.
[4]舒肇甦.台湾香蕉病害的防治[J].柑桔与亚热带果树信息,2000,16(2):43-44.
[5]林兰稳,奚伟鹏,黄赛花.香蕉镰刀菌枯萎病防治药剂的筛选[J].生态环境,2003,12(2):182-183.
[6]程亮,肖爱萍,游春平.拮抗菌对香蕉枯萎病菌的抑菌作用初步研究[J].仲恺农业技术学院学报,2005,18(1):9-13.
[7]Perze V L,Batlle A,Fonseca J,et al.Fusarium oxysporum f.sp.cubense in Cuba[C]//Reaction of cultivars and bio-control method 2nd international symposium on fusarium wilt on banana.Salvador de Bahia.Brazil,2003:22-26.
[8]孔庆科,丁爱云.内生细菌作为生防因子的研究进展[J].山东农业大学学报:自然科学版,2001,32(2):256-260.
[9]王焰玲,秦敏,周青,等.抑制稻瘟病菌生长的几丁质酶产生菌的分离和鉴定[J].植物保护学报,1998,25(4):289-94.
[10]孙娣,汪洋,张丽娟,等.β-1,3 葡聚糖酶及其抗真菌作用[J].黑龙江医药,2005,18(6):416-417.
[11]谭周进,肖罗,谢丙炎,等.假单胞菌的微生态调节作用[J].核农学报,2004,18(1):72-76.
[12]Yehuda Z,Shenker M,Hadar Y,et al.Remedy of chlorosis induced by iron deficiency in plants with the fungal siderophore rhizoferrin[J]J Plant Nutr,2000,23(11/12):1991-2006.
[13]Vandana K,Reeta G.Siderophore mediated plant growth promotion at low temperature by mutant of fluorescent pseudomonad[J].Plant GrowthRegulation,2004,42:239-244.
[14]Chen L,Dick W A,Streeter J M.Production of aerobactin by microorganisms from a compost enrichment culture and soybean utilization[J].Journal of Plant Nutrition.2000,23:2047-2060.
[15]王明江,章如意,林多多,等.棉花黄萎病不同抗性品种内生菌数量调查与拮抗菌筛选[J].江苏农业科学,2010,38(2):102-104.
[16]Roberts W K,Selitrennikoff C P.Plant and bacterial chitinases differ in antifungal activity[J].Microbiology,1988,134(1):169-176.
[17]Ghose T K.Measurement of cellulase activities[J].Pure and Applied Chemistry,1987,59:257-268.
[18]韩立荣.一株土传病害生防菌的筛选及其功能开发[D].杨凌:西北农林科技大学,2010.
[19]Shin S H,Lira Y,Lee S E,et al.CAS agar diffusion assay for the measurement of siderophores inbiological fluids[J].Journal of Microbiological Methods,2001,44:89-95.
[20]Berg G,Krechel A,Ditz M,et al.Endophytic and ectophytic potato-associated bacterial communities differ in structure and antagonistic function against plant pathogentic fungi[J].FEMS Microbiology Ecology,2005,51:215-229.
[21]肖爱萍,李庚花,游春平,等.5 株拮抗细菌对香蕉枯萎病菌的抑制作用[J].江西农业大学学报,2005,27(4):572-5751.
[22]李晓杰,徐树兰,汤历.香蕉枯萎病拮抗菌的筛选及盆栽防效的测定[J].广东农业科学,2009,36(5):99-102.
[23]蒲金基,刘晓妹,曾会才.香蕉抗枯萎病育种研究进展[J].中国南方果树,2003,32(1):31-34.
[24]曹永军,程萍,喻国辉,等.香蕉枯萎病菌菌株致病力分化及其原因研究[J].热带作物学报,2011,32(8):1-7.
[25]孙建波,王宇光,李伟,等.产几丁质酶香蕉枯萎病拮抗菌的筛选、鉴定及抑菌作用[J].果树学报,2010,27(3):427-430.
[26]邢介帅,李然,赵蕾,等.产蛋白酶生防细菌的筛选及其对病原真菌的拮抗作用[J].西北农业学报,2008,17(1):106-109.
[27]余贤美,郑服丛,林超,等.土壤产嗜铁素拮抗细菌CAS15 的分离鉴定[J].植物保护学报,2009,36(2):129-135.
[28]李桂霞,马汇泉,刘婧,等.番茄灰霉病高效拮抗菌株的鉴定及通过导入β-1,3-葡聚糖酶基因提高其生防效果[J].中国生物工程杂志,2007,27(4):44-49.

