不同生长期东乡野生稻根际土壤微生物数量及土壤酶活性研究
付学琴,刘琚珥,黄文新
(1.江西师范大学 生命科学学院,江西 南昌 330022;2.南昌大学 食品工程学院,江西 南昌 330031;3.江西省农业厅,江西 南昌 330046)
植物根际是植物与微生物交流比较活跃的土壤区。植物根系分泌的各种维生素、酶、植物生长调节剂、氨基酸等营养物质,为根际微生物提供了重要的营养和能量来源,影响着根际微生物数量、组成和活性。同样,根际微生物以自身代谢的形式,参与土壤中许多重要的生物化学过程,直接促进或抑制植物营养吸收和生长[1-3]。植物根际微生物数量、种群结构、分布及土壤酶活性已成为评价土壤生态环境质量的重要指标,是当前研究的热点。
江西东乡野生稻(简称“东野”)是全世界分布最北的普通野生稻(28°14'N),拥有雄性不育、恢复性、广亲和性、高产、耐冷性、耐旱性和多种抗病虫性状[4-8]等优良特性,有重要的研究和利用价值。近年来,许多学者对普通栽培稻根际微生物开展了研究,而对东乡野生稻的研究主要集中在种质资源保护与利用、优良基因挖掘等方面,对其根际微生物数量、种群结构、分布及土壤酶活性的研究鲜见报道[9-10]。为考察东乡野生稻根际土壤微生物群落特征,笔者开展了东乡野生稻根际土壤微生物数量、生理类群、土壤酶活性及其相关性研究,旨在探究东乡野生稻和根际微生物之间的相互作用关系,为加快开发东乡野生稻根际微生物资源提供科学依据。
1 材料与方法
1.1 样品采集
本研究供试土壤取自江西省东乡县岗上积镇东乡野生稻原位保护区内,取样时间分别为2012 年5月(苗期)、6 月(分蘖期)、7 月(孕穗期)、8 月(抽穗期)及10 月(成熟期),以S 型随机选取5 株健壮植株,带土挖出植株,轻轻抖落根系并去除黏附在根系上的较大颗粒和植物残根,再用干净毛刷刷下紧粘在根部的土壤,一部分风干保存,测定土壤pH 值和酶活性;一部分在4 ℃保存鲜样,测定其微生物类群和数量。
1.2 土壤微生物数量测定
细菌、真菌、放线菌计数采用稀释涂布平板法[11]。细菌培养采用牛肉膏蛋白胨培养基,真菌培养采用马丁孟加拉红培养基,放线菌培养采用改良高氏1 号培养基。
1.3 土壤微生物生理类群测定
固氮、氨化、硝化、亚硝化、反硝化细菌计数采用最大或然数(MPN)法[11]。固氮细菌培养采用Ashby 无氮培养基,氨化细菌培养采用蛋白胨氨化培养基,硝化细菌培养采用亚硝酸氧化培养基,亚硝化细菌采用改良Stephenson 培养基,反硝化细菌采用酒石酸钾钠硝酸盐培养基。
1.4 土壤酶活性测定
土壤酶活性的测定根据关松萌[12]的方法,土壤蔗糖酶活性、脲酶活性、磷酸单酯酶活性、过氧化物酶活性分别用3,5-二硝基水杨酸比色法、次氯酸钠-苯酚钠比色法、对硝基苯磷酸盐法、邻苯三酚比色法测定。
1.5 数据处理
采用DPS v7.55 和SPSS 软件对数据进行分析。
2 结果与分析
2.1 不同生长期东乡野生稻根际土壤微生物数量的变化
细菌、放线菌和真菌是土壤微生物主要组成类群,在维持生态系统的结构和功能方面起着重要作用。从表1 可知,不同生长期的东乡野生稻根际土壤微生物数量均表现为细菌>放线菌>真菌,说明细菌活性最强,其次是放线菌,真菌活性最差。不同生长期东乡野生稻根际土壤细菌、放线菌和真菌的数量存在不同的差异,并且呈现出不同的变化趋势。细菌呈现出先升后降的趋势,孕穗期达到最大,与分蘖期差异不显著,与其它生长期差异显著;放线菌呈现出逐步上升的趋势,抽穗期达到最大,与成熟期差异不显著,与其它生长期差异显著;真菌呈现出先下降、后上升的趋势,成熟期达到最大,与其它生长期均达到显著差异水平。

表1 不同生长期东乡野生稻根际土壤微生物数量Tab.1 The microbial numbers of Dongxiang wild rice rhizosphere soil in the different growth stages
2.2 不同生长期东乡野生稻根际土壤微生物生理类群的变化
从表2 可以看出,不同生长期东乡野生稻根际微生物各生理类群数量均呈现出先升后降的趋势,各生理类群间均存在不同的差异。自生固氮菌数量分蘖期最大,成熟期最小,分蘖期与孕穗期差异不显著,其它生长期间差异显著;氨化细菌数量分蘖期最大,成熟期最小,生长期间差异均显著;硝化细菌数量分蘖期最大,抽穗期最小,苗期与成熟期间差异不显著,孕穗期与抽穗期间差异不显著,其它生长期间差异显著;亚硝化细菌数量孕穗期最大,苗期最小,苗期与抽穗期间差异不显著,其它生长期间差异显著;反硝化细菌数量孕穗期最大,成熟期最小,分蘖期与抽穗期间差异不显著,其它生长期间差异显著。

表2 不同生长期东乡野生稻根际土壤微生物生理群数量Tab.2 The microbial flora numbers of Dongxiang wild rice rhizosphere soil in the different growth stages
2.3 不同生长期东乡野生稻根际土壤酶活性的变化
土壤酶活性反映了土壤中进行的各种生化过程的方向和强度,是土壤生物活性强度标志之一[13]。从表3 可以看出,不同生长期东乡野生稻根际土壤酶活性存在不同的差异。蔗糖酶活性强弱反映土壤熟化程度和肥力水平,对增加土壤中营养物质起重要作用。蔗糖酶活性呈现出先升后降的趋势,分蘖期酶活性达到最强,且与其它时期差异极显著,说明分蘖期土壤碳氮转化速率最快。磷酸酶能促进土壤中有机磷化合物或无机磷酸盐转化为植物能利用的无机态磷。磷酸单脂酶呈现出先升后降再升的趋势,成熟期酶活性最强,且与其它时期差异极显著,反映了成熟期土壤中的磷供应状况最好。脲酶存在于大多数细菌、真菌中,它仅能水解尿素,脲酶活性可表示土壤氮素供应状况。脲酶活性呈现出先升后降的趋势,孕穗期酶活性达到最强,且与其它时期差异极显著,说明孕穗期土壤氮素供应最好。过氧化物酶为抗性酶,参与腐殖质的形成。过氧化物酶活性呈现出先降后升再降的趋势,苗期酶活性最强且与其它时期差异极显著,反映了苗期土壤中的腐殖质含量最高。
2.4 不同生长期东乡野生稻根际微生物数量与酶活性间的相关分析
不同生长期东乡野生稻根际土壤细菌、放线菌、真菌与土壤酶的活性间存在相关性。从表4 可以看出,细菌与过氧化物酶呈极显著正相关;放线菌与过氧化物酶呈极显著正相关,与脲酶呈显著正相关;真菌与过氧化物酶呈极显著负相关。细菌、放线菌、真菌与其它酶之间也存在相关性,但相关性不显著。不同微生物类群间也存在显著或极显著相关,细菌与放线菌呈显著正相关,与真菌呈极显著负相关;放线菌与真菌呈极显著负相关。
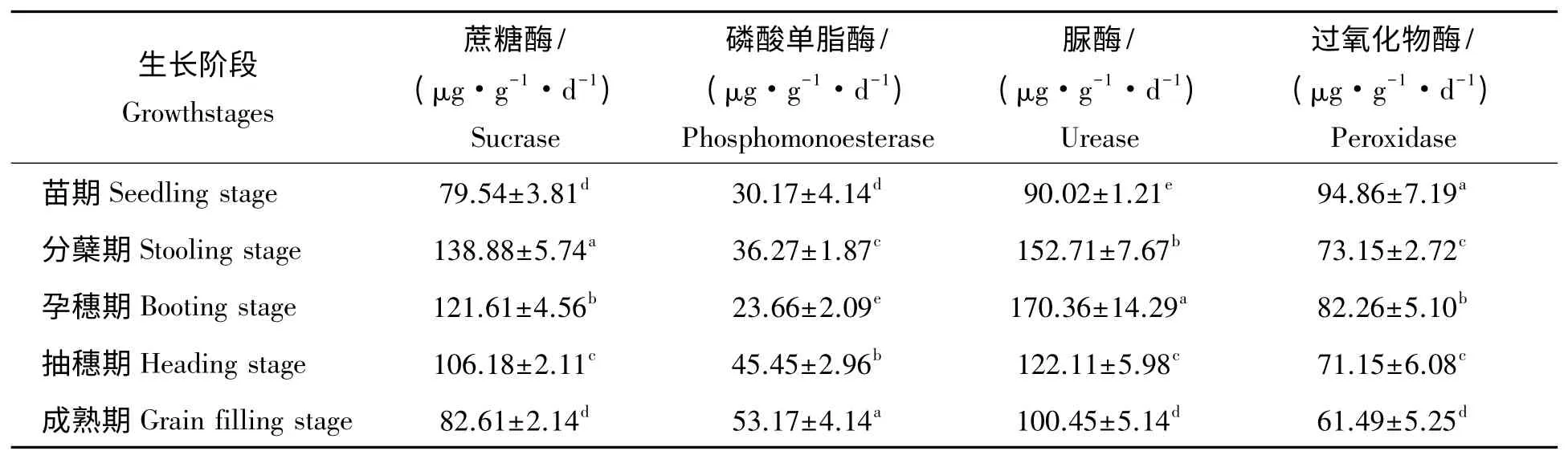
表3 不同生长期东乡野生稻根际土壤酶活性Tab.3 The enzyme activities in Dongxiang wild rice rhizosphere soil of different growth stages

表4 不同生长期东乡野生稻根际土壤微生物数量与土壤酶活性的相关性Tab.4 Correlation analysis of microbial numbers and enzyme activity in Dongxiang wild rice rhizosphere soil of different growth stages
3 讨论
植物根系在代谢分泌及脱落过程中可为根际微生物增殖提供丰富的营养物质。因此,根际较之散土有着数量更大、生物活性更强的微生物区系[14-15]。本研究结果表明,东乡野生稻根际细菌、放线菌、真菌数量差异较大,细菌数量最多,其次为放线菌,真菌数量最少,与前人研究结果基本一致[2-3,16]。本研究还发现,根际细菌、放线菌、真菌数量在不同生长时期存在明显的差异。细菌数量从苗期到孕穗期增加,而后呈下降趋势,这说明细菌数量与根际分泌物和土壤含水量关系密切,由于土壤中厌氧性细菌逐渐适应了淹水环境,加之生长发育期旺盛的根系排出大量的分泌物,提供了丰富的能源,使孕穗期土壤中细菌得以大量繁殖;成熟期由于能量耗尽、养分消耗、氧化还原环境急剧变化等因素综合作用,导致细菌数量减少,这与李华兴等[17]、张凤华等[18]研究结果一致,与Goshal[19]在水稻耕作土壤中几乎没有发现微生物数量增加的结果相矛盾。放线菌数量从苗期开始增加,至抽穗期数值最大。这可能由于东乡野生稻处于旺盛生长阶段时,根系具有较强的根系分泌作用,而细菌对根系分泌物的利用率和敏感性超过放线菌,使得放线菌具有相对劣势的微生态位;抽穗期后,根际分泌物减少,细菌由于个体小、生育期短,可能对环境的变化响应快,细菌数量迅速减少,而放线菌则因具有较强的竞争优势出现峰值。但也有可能是因土壤有机质含量、pH 值等其它因素的变化而引起的,具体原因有待进一步研究。真菌数量从苗期到分蘖期下降,而后上升,成熟期数值最大,这可能由于东乡野生稻生长前期大量灌水,抑制了真菌的生长,成熟期因干湿交替,湿度较高,土壤通气状况良好等,真菌繁殖出现了峰值,当然这还需进一步验证。
微生物生理类群在土壤微生态中发挥着重要的作用,在物质转化中具有特定的功能[20]。本研究结果表明,东乡野生稻根际土壤微生物以氨化细菌为主,自生固氮菌和反硝化细菌次之,硝化细菌和亚硝化细菌最少,这与顾明华等[21]研究结果基本一致。东乡野生稻根际土壤中氨化和反硝化作用比较活跃,而硝化作用比较缓慢,其原因可能与根际土壤含水量相关,也可能因为土壤中氨态氮含量较为丰富,而硝态氮含量较少,原因还要进一步探讨。
土壤酶参与土壤中的各种代谢过程和能量转化,是土壤生物化学特征的重要组成部分,与土壤微生物数量存在相关关系[22-24]。本研究结果显示,不同时期东乡野生稻根际土壤蔗糖酶、磷酸单酯酶、脲酶、过氧化物酶活性存在不同的差异,这与陈汝等[25]研究结果基本一致。其原因可能是不同生长期东乡野生稻根系分泌物组成和数量不同,对根际微生物数量和种类产生了影响,进而影响到了土壤酶活性。相关性分析表明,细菌、放线菌、真菌与土壤酶的活性间存在不同程度的相关性。细菌与过氧化物酶呈极显著正相关;放线菌与过氧化物酶呈极显著正相关,与脲酶呈显著正相关;真菌与过氧化物酶呈极显著负相关,与其它酶间相关性较小。其原因可能是土壤酶是生物和非生物活性的总和,不仅与土壤微生物密切相关,还与环境等非生物因素有关联。
[1]朱丽霞,章家恩,刘文高.根系分泌物与根际微生物相互作用研究综述[J].生态环境,2003,12(1):102-105.
[2]Nihorimbere V,Ongena M,Smargiassi M,et al.Beneficial effect of the rhizosphere microbial community for plant growth and health[J].Biotechnology,Agronomy,Society and Environment,2011,15(2):327-337.
[3]Richardson A E,Barea J M,McNeill A M,et al.Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms[J].Plant and Soil,2009,321(1/2):305-339.
[4]He G M,Luo X J,Tian F,et al.Haplotype variation in structure and expression of a gene cluster associated with a quantitative trait locus for improved yield in rice[J].Genome Research,2006,16(5):618-626.
[5]肖晓春,王云基,肖诗锦,等.东乡野生稻细胞质源雄性不育系“东B11A”的选育[J].江西农业学报,2001,13(2):8-11.
[6]余守武,万勇,胡标林,等.东乡野生稻细胞质雄性不育育性恢复的遗传研究[J].分子植物育种,2005,3(6):761-767.
[7]余丽琴,徐巧玲,邱兵余,等.原、异位保存东乡野生稻主要农艺性状的比较研究[J].植物遗传资源学报,2007,8(1):99-101.
[8]刘凤霞,孙传清,谭禄宾,等.江西东乡野生稻孕穗开花期抗冷基因定位[J].科学通报,2003,48(17):1864-1867.
[9]胡桂萍,尤民生,刘波,等.水稻茎部内生细菌及根际细菌与水稻品种特性的相关性[J].热带作物学报,2010,31(6):1026-1029.
[10]刘云霞,张青文,周明牂.水稻体内细菌的动态研究[J].应用生态学报,1999,10(6):735-738.
[11]吴金水,林启美,黄巧云,等.土壤微生物生物量测定方法及其应用[M].北京:气象出版社,2006.
[12]关松萌.土壤酶及其研究法[M].北京:农业出版社,1986.
[13]Mengel K,Kirkby E A.Principles of plant nutrition[M].Switzerland:International Potash Institute,Bem,1987:247-252.
[14]Morgan J A,Bending G D,White P J.Biological costs and benefits to plant-microbe interactions in the rhizosphere[J].Journal of Experimental Botany,2005,56(417):1729-1739.
[15]Weller D M,Thomashow L S.Current challenges in introducing beneficial microganisms into the rhizosphere[C].//Molecular Ecology of Rhizosphere Microorganisms(eds O’Gara F,Dowling DN,Boesten B),1994:1-18.
[16]胡元森,吴坤,刘娜,等.黄瓜不同生育期根际微生物区系变化研究[J].中国农业科学,2004,37(10):1521-1526.
[17]李华兴,卢维盛,刘远金,等.不同耕作方法对水稻生长和土壤生态的影响[J].应用生态学报,2001,12(4):553-556.
[18]张凤华,马富裕,郑重,等.不同水肥处理膜下滴灌棉田根际微生物及棉花生长发育的研究[J].新疆农业大学学报,2000,23(4):56-58.
[19]Goshal N,Singh P K.Effects of farmyard manure and inorganic fertilizers on the dynamics of soil microbial biomass in a tropical dry land agroecosystem[J].Biol Fertil Soils,1995,19:231-238.
[20]黄益宗,冯宗炜,张福珠.化感物质对土壤硝化反应影响的研究[J].土壤与环境,1999,8(3):203-207.
[21]顾明华,区惠平,刘昔辉,等.稻草免耕稻田土壤的氮素形态及氮素生理群特征[C]//中国土壤学会.中国土壤学会第十一届全国会员代表大会暨第七届海峡两岸土壤肥料学术交流研讨会论文集(下).北京:中国农业出版社,2008:39-46.
[22]刘素慧,刘世琦,张自坤,等.大蒜连作对其根际土壤微生物和酶活性的影响[J].中国农业科学,2010,43(5):1000-1006.
[23]黄继川,彭智平,于俊红,等.施用玉米秸秆堆肥对盆栽芥菜土壤酶活性和微生物的影响[J].植物营养与肥料学报,2010,16(2):348-353.
[24]Susanne K,Veronica A M,Husein A.Microbial community composition and enzyme activities in a sandy loam soil after fumigation with methyl bromide or alternative biocides[J].Soil Biology & Biochemistry,2006,38(6):1243-1254.
[25]陈汝,王海宁,姜远茂,等.不同苹果砧木的根际土壤微生物数量及酶活性[J].中国农业科学,2012,45(10):2099-2106.
——东乡三中发展掠记

