嗜线虫致病杆菌HB310 培养基筛选和培养条件优化
王永娟,张 杰,孔繁芳,南宫自艳,宋 萍,王勤英
(河北农业大学植物保护学院,河北保定 071000)
嗜线虫致病杆菌Xenorhabdus nematophila 与小卷蛾斯氏线虫Steinerne macarpocapsae 呈互惠共生关系,线虫-共生菌复合体共同侵染昆虫,短时间内造成昆虫患败血病死亡,在防治多种地下害虫中起重要作用。研究表明,嗜线虫致病杆菌可以分泌多种杀虫物质,在线虫-共生菌复合体中起杀死昆虫的作用(Park et al.,2000;Owuama,2001)。近年来,随着研究不断深入,除杀虫活性外,嗜线虫致病杆菌其他功能也被不断发现,可以合成各种抗菌物质,对多种植物病原微生物具有抑制作用(刘霞等,2006;马丽丽等,2007);与苏云金芽孢杆菌(Sungchae et al.,2006)、化学杀虫剂(李立涛等,2011)混合使用可以提高杀虫效果。嗜线虫致病杆菌具有杀虫谱广、杀虫活性高、抑菌作用强等优点,具有广阔的开发利用前景,世界各国对共生菌资源亦日趋重视。
近年来有关嗜线虫致病杆菌发酵的研究也成为了热点,但是相关研究内容主要集中在抗生素的产生和抑菌活性上(李骞等,2006),而关于影响嗜线虫致病杆菌杀虫活性的发酵因子却很少报道。嗜线虫致病杆菌Xn HB310 是本实验室分离得到的一株具有高杀虫活性的菌株,前期工作对它的杀虫活性和杀虫机理进行了深入研究(王勤英等,2005;Wang et al.,2012)。本实验针对Xn HB310 菌株杀虫活性,利用正交试验对发酵培养基进行优化,明确其最佳发酵条件,提高发酵效率,为以后规模化、商品化生产微生物杀虫剂提供理论依据。
1 材料与方法
1.1 供试材料
供试菌株:嗜线虫治病杆菌HB310 菌株(Xn HB310)保存于河北农业大学害虫生物防治实验室,从小卷蛾斯氏线虫体内分离获得,以NBTA 为鉴别培养基确定菌株的初生型。
供试虫源:小菜蛾Plutella xylostella 由河北农业大学害虫生物防治实验室提供,置于25±1℃,RH 65%-75%、光照16 h 的人工气候箱内,用萝卜苗饲养至2 龄幼虫,挑选健康整齐幼虫供试。
培养基:NBTA 鉴别培养基(营养琼脂45 g,氯化三苯基四氮唑0.04 g,溴百里酚蓝0.025 g)、BR 培养基(牛肉蛋白胨10 g,牛肉膏3 g,氯化钠5 g)、NA 培养基(牛肉膏5 g,牛肉蛋白胨6 g,NaCl 5 g)、KB 培养基(牛肉蛋白胨5 g,酵母浸粉3 g,葡萄糖2.5 g)、BM 培养基((NH4)2SO41 g,K2HPO47 g,KH2PO43 g,MgSO4·7H2O 0.1 g,葡萄糖1 g,牛肉蛋白胨1 g,酵母浸粉5 g)、BPY培养基(牛肉蛋白胨10 g,牛肉膏5 g,氯化钠5 g,酵母浸粉5 g,葡萄糖5 g)和YS 培养基((NH4)2SO40.5 g,K2HPO40.5 g,MgSO4·7H2O 0.2 g,NaCl 5 g,酵母提取物5 g)。以上培养基皆定容1000 mL,pH 值7.0-7.2。
1.2 生物测定方法
采用浸叶法对小菜蛾进行生物测定(李立涛等,2011),取甘蓝叶片在加有0.3% 吐温-80 的菌液中浸泡10 s,取出后自然晾干,放入灭菌养虫盒中,接入小菜蛾2 龄幼虫,每盒15 头,每个处理设3 次重复,以含有0.3% 吐温-80 的无菌水处理作为对照,25℃培养72 h 后,统计死亡数并计算死亡率。对生测数据均通过DPS 软件分析,采用Dunan's 新复极差法统计分析,数据均为平均数±SE (mean±SE)。
1.3 基础培养基的筛选
从NBTA 培养基上挑取Xn HB310 初生型单菌落,接入BR 培养基中,28℃、200 rpm 培养14 h,按1% 接种量分别接入到不同培养基,28℃、200 rpm培养,每隔2 h 取一次菌液测定OD600,培养48 h 后,测定其杀虫活性,方法见1.2。
1.4 最佳碳源、氮源和无机盐的选择与优化
采用单因素方法确定最佳三大营养源。分别在BR 培养基中加入1%的蔗糖、乳糖、葡萄糖、果糖和麦芽糖为不同碳源;以1.5%的牛肉蛋白胨、蛋白胨、酵母浸粉、牛肉浸膏、干酪素和尿素作为不同氮源;以0.5% 的 MgSO4、MgCl2、KCl、(NH4)2SO4、KH2PO4和NaH2PO4为无机盐,其他组分相同,28℃、200 rpm 培养48 h 后检测菌株OD600,测定其杀虫活性,方法见1.2。
在确定最佳碳源、氮源和无机盐的基础上,采用正交实验设计优化三大营养源的用量,因素水平见表1,其中A 因素为葡萄糖、B 因素为牛肉蛋白胨、C 因素为牛肉浸膏和D 因素为KH2PO4。
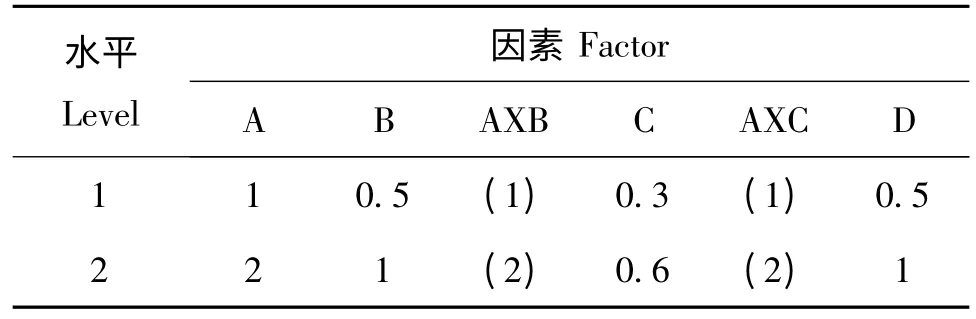
表1 培养基优化设计表Table 1 Optimization design of medium
1.5 培养条件的优化
本实验分别对接种量、培养时间、温度、培养基初始pH 值、摇床转速和装液量等6 个因素对菌株生长及杀虫活性的影响进行了研究,并确定了最佳的培养方案。原始发酵条件为:将种子菌以1%接种接入到置于500 mL 摇瓶内的100 mL BR培养基中,200 rpm、28℃培养48 h。测定菌液OD600和杀虫活性。
2 结果与分析
2.1 基础培养基对Xn HB310 菌株生长和杀虫活性的影响
将Xn HB310 菌株分别接入6种不同培养基,在不同时间点测定菌液OD600,绘制生长曲线,最后测定各菌液的杀虫活性,结果见图1 和图2。从图1 可以看出,Xn HB310 菌株在BR 培养基中OD600最高,生长情况最好;图2 也显示BR 培养基中的Xn HB310 菌株杀虫活性高于其他培养基,且差异显著(P≤0.05,下同)。因此选择BR 培养基作为后继研究的基础培养基。

图1 嗜线虫致病杆菌HB310 在不同培养基中的生长曲线Fig.1 Growth curve of Xenorhabdus nematophila HB310 in the different culture medium

图2 嗜线虫致病杆菌HB310 在不同培养基中对小菜蛾幼虫的杀虫活性Fig.2 Insectical activity of X.nematophila HB310 in the different culture medium against the larvae P.xylostella
2.2 碳源对Xn HB310 菌株生长及杀虫活性的影响
由表2 可以看出,当以葡萄糖、蔗糖和麦芽糖作为碳源时,Xn HB310 菌株的杀虫活性高于以果糖和麦芽糖为碳源时的活性,而且前三者没有显著差异;但是以葡萄糖为碳源时,菌液OD600显著高于其它碳源。综合以上两个因素考虑,选择葡萄糖为最佳碳源。
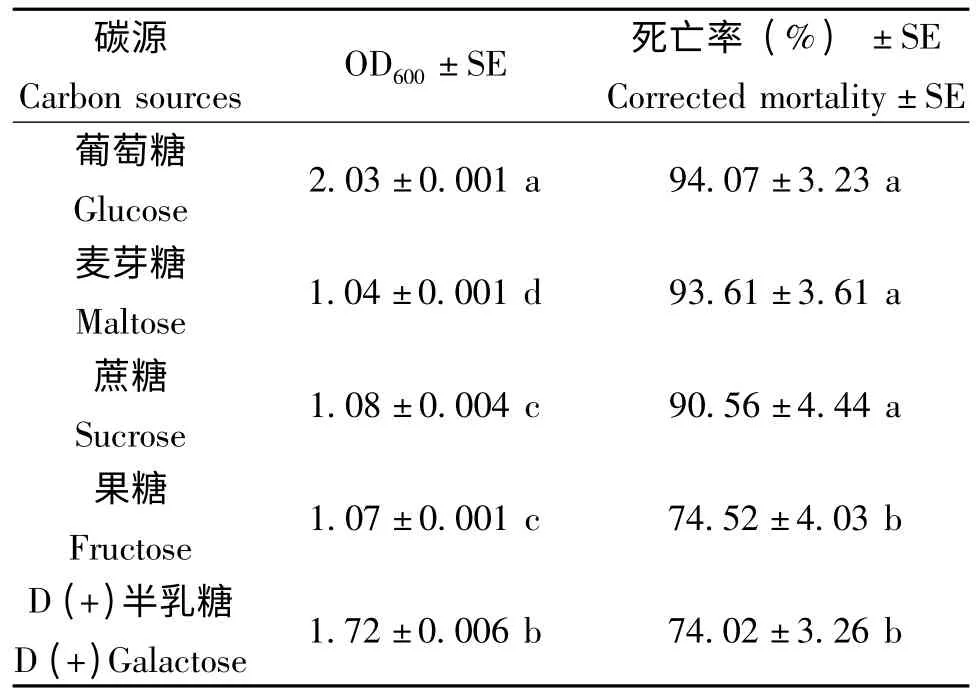
表2 不同碳源对嗜线虫致病杆菌Xn HB310生长及杀虫活性的影响Table 2 Effect of different carbon sources on the growth and insecticidal activity of Xn HB310
2.3 氮源对Xn HB310 菌株生长和杀虫活性的影响
不同氮源对Xn HB310 菌株的影响见表3,由表3 可以看出,以牛肉浸膏和牛肉蛋白胨为氮源时,培养的Xn HB310 菌液的杀虫活性显著高于其它氮源。虽然以牛肉浸膏和牛肉蛋白胨为氮源的培养基培养的菌液OD600值差异显著,但是两种菌液对小菜蛾致死率都很高,且差异不显著,所以选择牛肉浸膏和牛肉蛋白胨共为最佳氮源。
2.4 无机盐对Xn HB310 菌株生长和杀虫活性的影响
测定不同无机盐对Xn HB310 菌株影响,结果显示(表4),当以KH2PO4和NaH2PO4作为无机盐时,Xn HB310 菌株的杀虫活性高于其它无机盐,并且无显著差异,但是菌液在KH2PO4条件下生长情况优于后者,所以选择KH2PO4作为最适无机盐。

表3 不同氮源对嗜线虫致病杆菌HB310 生长及杀虫活性的影响Table 3 Effect of different nitrogen sources on the growth and insecticidal activity of X.nematophila HB310

表4 无机盐对嗜线虫致病杆菌HB310 生长及杀虫活性的影响Table 4 Effect of inorganic salt on the growth and insecticidal activity of Xn HB310
2.5 培养基的优化
在确定最适碳源、氮源和无机盐的基础上,采用正交实验对Xn HB310 发酵培养基成分的用量进行了优化。表5 结果表明,葡萄糖的用量对Xn HB310 菌株产杀虫活性物质的影响最大,增加葡萄糖用量可显著提高菌株的杀虫活性,其次是牛肉蛋白胨,葡萄糖与牛肉蛋白胨的交互作用可忽略不计,而葡萄糖与牛肉浸膏的交互作用对产杀虫活性物质有一定的影响。从均值1 和均值2 可以看出,培养基的优化组合为葡萄糖2%,牛肉蛋白胨1%,牛肉浸膏0.3%和K2HPO41%。将其培养的Xn HB310 菌液稀释10 倍对小菜蛾二龄幼虫的致死率为92%,而以稀释10 倍BR 培养基培养的Xn HB310 菌液,对小菜蛾二龄幼虫的致死率为60.7%。

表5 培养基的优化Table 5 Optimization of medium
2.6 接种量对Xn HB310 菌株生长和杀虫活性的影响
接种量对Xn HB310 的影响结果表明(见表6),当接种量在3%-6%时,小菜蛾幼虫的死亡率无显著差异,皆高于其他接种量,但是,当接种量为6%时,菌液OD600显著高于其他接种量,因此选择6%的接种量进行接种。
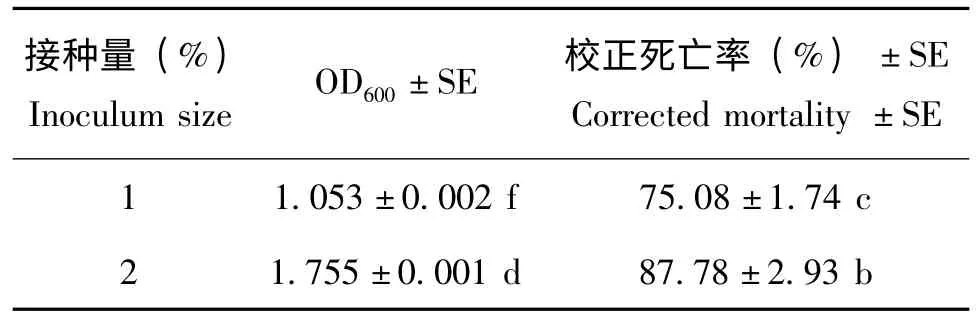
表6 接种量对嗜线虫致病杆菌HB310 生长及杀虫活性的影响Table 6 Effect of inoculum size on the growth and insecticidal activity of Xn HB310

(续上表)
2.7 培养时间对Xn HB310 菌株生长和杀虫活性的的影响
分别取培养不同时间的Xn HB310 菌液,检测其生长情况并测定杀虫活性,结果见表7。由表7可以看出,随着培养时间延长,Xn HB310 菌株的OD600随之升高,杀虫活性也同步提高,到达48 h时,两项指标达到最高值,显著高于其他培养时间,之后随着时间的延长,菌株的生长情况和杀虫活性呈下降趋势,说明菌液由稳定期发展为衰亡期,菌液杀虫活性也随之下降。综上所述,选择48 h 作为发酵时间。
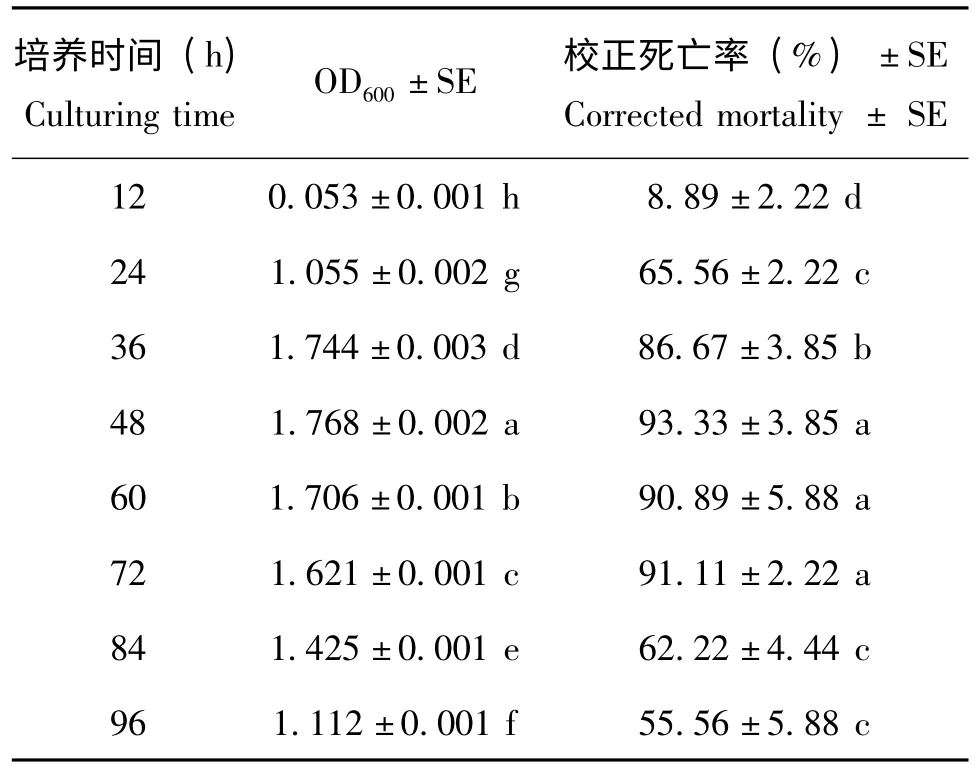
表7 培养时间对嗜线虫致病杆菌HB310 生长及杀虫活性的影响Table 7 Effect of culturing time on the growth and insecticidal activity of Xn HB310
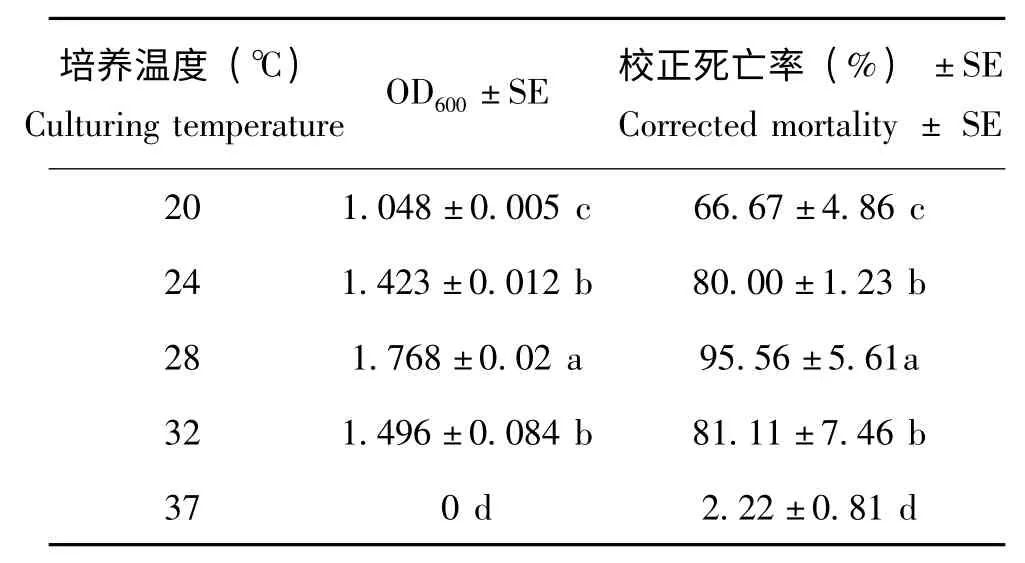
2.8 培养温度对Xn HB310 菌株生长和杀虫活性的影响
不同温度对菌株发酵影响结果见表8。由表8可以看出,不同温度对菌株的发酵影响较大,温度过高或过低,菌株生长缓慢甚至停止生长,失去杀虫活性;当温度为28℃时,Xn HB310 的OD600和杀虫活性最高,且差异性显著,因此选择28℃为菌株Xn HB310 最适发酵温度。
2.9 培养基初始pH 值对Xn HB310 菌株生长和杀虫活性的影响
培养基不同pH 值对菌株Xn HB310 生长影响见表9。结果表明,pH 值在6.0-7.5 范围之间,菌株Xn HB310 的OD600及杀虫活性随pH 值升高而升高;当pH 值达到7.5 时,菌液生长和杀虫活性都显著高于其他pH 值;当高于8.0 时,菌株生长和杀虫活性就受到抑制。因以选用pH 值7.5 为发酵培养基的初始pH 值。

表9 初始pH 值对嗜线虫致病杆菌HB310 生长及杀虫活性的影响Table 9 Effect of initial pH value on the growth and insecticidal activity of Xn HB310
2.10 摇床转速对Xn HB310 菌株生长和杀虫活性的影响
设定不同转速对Xn HB310 菌株进行发酵,48 h 时检测菌液的OD600值和杀虫活性。结果如表10 所示,随着转速的升高,OD600值随之增加,菌株生长速度加快,杀虫活性也逐渐升高;转速为200 rpm 时,Xn HB310 的OD600和杀虫活性达到最高,且差异性显著;当达到250 rpm 时,OD600值和杀虫活性都有所降低,所以选用转速为200 rpm。
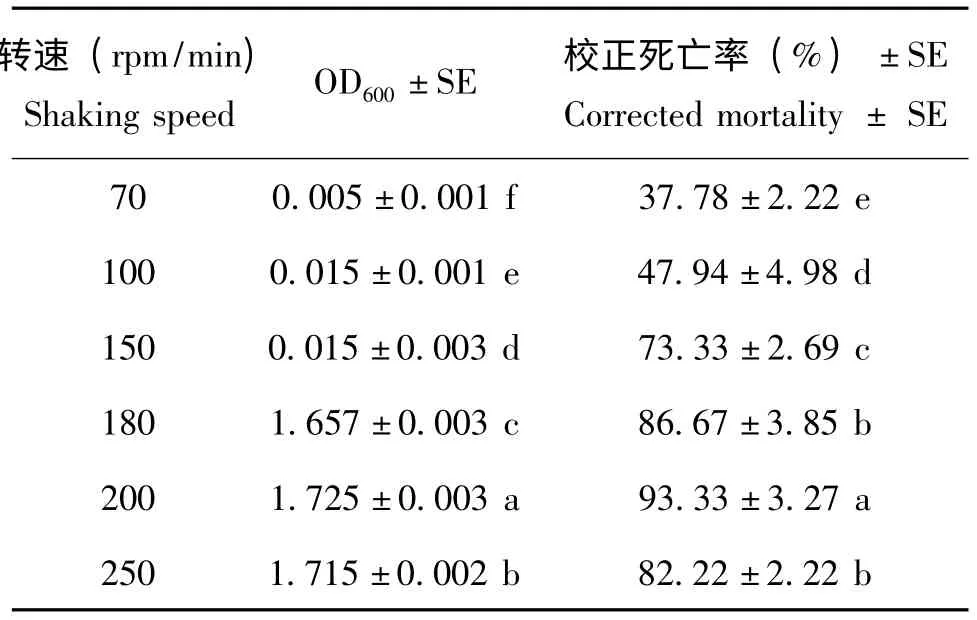
表10 摇床转速对Xn HB310 生长及杀虫活性的影响Table10 Effect of shaking speed on the growth and insecticidal activity of Xn HB310
2.11 装液量对Xn HB310 菌株生长和杀虫活性的影响
在500 mL 摇瓶中分别加入不同体积培养基,对Xn HB310 进行发酵培养,结果表明,当装液量在50-150 mL 之间时,杀虫活性较高且差异不显著,当装液量为100 mL 时,菌株OD600值显著高于其他装液量,说明该装液量最适合菌株生长,因此选择100 mL/500 mL 三角瓶装液量来进行发酵培养。

表11 装液量对嗜线虫致病杆菌HB310 生长及杀虫活性的影响Table 11 Effect of loading amount on the growth and insecticidal activity of Xn HB310
3 结论与讨论
小菜蛾的危害具有隐蔽性且世代重叠严重,防治十分困难,因此小菜蛾已经成为世界性害虫。在田间,小菜蛾对多种化学农药及生物农药Bt(Liu et al.,1998;杨峰山等,2006)已经表现出了很强抗性,所以开发和推广新的杀虫资源至关重要。本实验室前期研究发现,嗜线虫致病杆菌Xn HB310 对小菜蛾具有很强的杀虫效果(王勤英等,2004)。杨云艳等(2012)针对嗜线虫致病杆菌对小菜蛾的致死和亚致死效应进行了评价,发现Xn HB310 不仅对小菜蛾幼虫有很强的杀虫活性,而且与Bt 无交互抗性。Wang 等(2012)对Xn HB310 菌株的杀虫机理进行了研究,他们从菌体细胞中分离出了一种复合蛋白Xnpt,通过组织病理学研究发现,Xnpt 可以破坏中肠组织和抑制中肠蛋白酶活性,对小菜蛾具有拒食作用和致死作用。此外,近期研究表明,来自昆虫病原线虫共生菌的这类复合杀虫蛋白毒素的杀虫机理不同于Bt Cry 毒素(Meusch,et al.,2014),因此嗜线虫致病杆菌作为治理Bt 抗性小菜蛾种群的一种新的生防武器,具有潜在的开发利用价值。
本研究以Xn HB310 菌液OD600值和杀虫活性为指标,采用单因素方法和正交试验来优化菌株Xn HB310 的发酵条件,最终得到最优培养基和最佳发酵条件。优化后的菌液杀虫活性比对照提高了31.3%。本研究中,温度和培养基pH 值是影响菌株生长的最主要因素,当温度和pH 值过高或过低时,菌株无法正常生长,杀虫活性也急剧下降,甚至失去杀虫活性。这可能是由于温度和pH 值不但影响菌株的代谢速度,而且可能会造成代谢走向发生不可逆的改变。其他因素对菌株的生长代谢有一定影响,影响效果虽不及以上两个因素,但是如果作为微生物杀虫剂进行发酵生产,其它因素也不可忽略。
杨秀芬等 (2006)曾针对致病杆菌 D43(Xenorhabdus sp.D43)的抑菌活性对其发酵条件进行了研究,确定该菌株的最佳三大营养源为麦芽糖、牛肉蛋白胨和CaCl2。这与本实验结论不同,可能是由于嗜线虫致病杆菌产生杀虫蛋白所需营养不同于产生抑菌物质所需营养。但是,杨秀芬等(2006)所提出的接种量、装液量和培养基初始pH 值的结论与本实验一致,说明嗜线虫致病杆菌杀虫和抑菌的最适条件是相似的。因此,针对不同目的摸索相应的发酵条件以达到最好的效果是必须的。
发酵优化是生防微生物产业化的前期基础,本研究初步探索了实验室条件下不同营养物质和发酵条件对Xn HB310 菌株杀虫活性的影响,为进行下一步发酵罐发酵提供了理论基础。但是作为产品进行商品化推广还会受到发酵技术和生产成本等因素的影响,需要开发更加廉价高效的发酵方法,这就有待于进一步的试验探索。
References)
Jung S,Kim Y.Synergistic effect of entomopathogenic bacteria(Xenorhabdus sp.and Photorhabdus temperata ssp.temperata)on the pathogenicity of Bacillus thuringiensis ssp.aizawai against Spodoptera exigua (Lepidoptera:Noctuidae)[J].Environmental Entomology,2006,35 (6):1584-1589.
Jung S,Kim Y.Synergistic effect of Xenorhabdus nematophila K1 and Bacillus thuringiensis subsp.aizawai against Spodoptera exigua(Lepidoptera:Noctuidae)[J].Biological Control,2006,39:201-209.
Li LT,Wen X,Zhao YN et al.The synergism of Xenorhabdus nematophila HB310 mixtures with seven insecticides to Plutella xylostella (L.) [J].Journal of Environmental Entomology,2011,33 (2):185-190.[李立涛,文旭,赵亚楠,等.嗜线虫致病杆菌与七种杀虫剂混配对小菜蛾毒杀增效作用评价[J].环境昆虫学报,2011,33 (2):185-190.]
Li Q,Liu X,He J,et al.Primary study of inhibition activity with different extracts from fermentation broth of the Xenorhadbus nematophila YL001 [J].Acta Agriculturae Boreali-occidentalis Sinica,2006,15 (6):229-232.[李骞,刘霞,何军,等.昆虫病原线虫共生菌YL001 发酵液不同粗提物抑菌活性研究[J].西北农业学报,2006,15 (6):229-232]
Liu X,Li Q,Xu X,et al.Study on the antifungal activity of intracellular secondary metabolic products from Xenorhabdus nematophilus[J].Chinese Journal of Pesticide Science,2006,8(1)95-98.[刘霞,李骞,许贤,等.昆虫病原线虫共生菌细胞内代谢产物抑菌作用研究初报[J].农药学学报,2006,8(1)95-98]
Liu YB,Brucee ET,William JM,et al.Synergism between Bacillus thuringiensis Spores and toxins against resistant and susceptible diamondback moths (Plutella xylostella)[J].Appl.Environ.Microbiol.,1998,64 (4):1385-1389.
Ma LL,Xu YL,Tai LM.Antimicrbial activity of the symbiotic bacteria of entomopathgenic nematode against plant pathogens[J].Plant Protection,2007,33 (4)95-98.[马丽丽,许艳丽,台莲梅.昆虫病原线虫共生细菌对植物病原菌的抑制作用[J].植物保护,2007,33 (4):95-98]
Meusch D,Gatsogiannis C,Efremov RG,et al.Mechanism of Tc toxin action revealed in molecular detail [J].Nature,2014,508(7494):61-65.
Owuama CI.Entomopathogenic symbiotic bacteria,Xenorhabdus and Photorhabdus of nematodes [J].World J.Microbiol.Biotechnol.,2001,17:505-515.
Park Y,Kim Y.Eicosanoids rescue Spodoptera exigua infected with Xenorhabdus nematophilus,the symbiotic bacteria to the entomopathogenic nematode Steinernema carpocapsae [J].Insect Physiol.,2000,11:1 469-1 476.
Wang QY,Lu XJ,Li XH,et al.Larvicidal activity of the symbiotic bacterium Xenorhabdus nematophilus HB310 against three species of cruciferae pests[J].Journal of Ariculture Uversity of Hebei,2004,27 (5):73-76.[王勤英,陆秀君,李秀花等.嗜线虫致病杆菌Xenorhabdus nematophilus HB310 对3种十字花科蔬菜害虫杀虫活性的研究[J].河北农业大学学报,2004,27 (5):73-76]
Wang QY,Nangong ZY,Lu XJ,et al.Purification of insecticidal proteins from Xenorhabdus nematophila HB310 and detection of their insecticidal activity [J].Acta Entomologica Sinica,2005,48(3):353-358.[王勤英,南宫自艳,陆秀君,等.嗜线虫致病杆菌HB310 菌株杀虫蛋白的纯化及活性鉴定[J].昆虫学报,2005,48 (3):353-358]
Wang QY,Nangong ZY,Yang J,et al.Toxic activity of a protein complex purified from Xenorhabdus nematophila HB310 to Plutella xylostellalarvae[J].Insect Science,2012,19:329-336.
Yang FS,Wu QJ,Xu BY,et al.Resistances election of Plutella xylostella by Cry1Ac toxin and Bt formulation and biological fitness of the resistant populations[J].Acta Entomologica Sinica,2006,49 (1):64-69.[杨峰山,吴青君,徐宝云,等.小菜蛾对Bt 毒素Cry1Ac 和Bt 制剂抗性的选育及其抗性种群的生物学适应性[J].昆虫学,2006,49 (1):64-69。
Yang XF,Qiu DW,Jiao NN,et al.Cultural medium and fermentation conditions of Xenorhabdus sp.Strain D43[J].Chinese Journal of Biological Control,22 (1):58-62.[杨秀芬,邱德文,焦宁宁,等.致病杆菌D43 菌株产素培养基及发酵条件[J].中国生物防治,22 (1):58-62]

