人瘢痕疙瘩成纤维细胞裸鼠荷瘤模型的建立
朱莲花 万红双 金明姬 方宇辉 李周娜 金哲虎 高钟镐
人瘢痕疙瘩成纤维细胞裸鼠荷瘤模型的建立
朱莲花 万红双 金明姬 方宇辉 李周娜 金哲虎 高钟镐
目的建立一种简单、成功率高的人瘢痕疙瘩裸鼠荷瘤模型。方法27只雌性BALB/c裸鼠随机分为5组,A、B、C组每组5只,在每只裸鼠腋窝下接种人瘢痕疙瘩成纤维细胞和Matrigel胶混悬液0.1 ml,细胞浓度分别为 1.0 × 104个/μl Matrigel胶(A 组)、3.0 × 104个/μl Matrigel胶(B 组)、5.0 × 104个/μl Matrigel胶(C组)。取C组成形瘤块修剪成若干个5 mm×5 mm×5 mm大小的组织块移植于D组裸鼠(8只)的腋窝皮下;E组裸鼠(4只)皮下注射100 μl Matrigel胶作为对照组。A、B、C组出瘤后30 d、D组瘤块移植后30 d肉眼观察瘤体的形成过程及变化,并在第31天处死裸鼠进行组织病理学检查,分析其移植后成形的瘤体组织学变化及裸鼠的心、肝、脾、肺、肾组织的变化。结果A、B、C组裸鼠成瘤率为100%,出瘤时间分别为(90.20±3.96)d、(61.00±2.92)d、(39.60±3.20)d。 出瘤 30 d时 3组瘤体体积分别为(288.34±25.29)mm3、(1 370.63±105.24)mm3、(1 940.98±184.37)mm3,3组差异有统计学意义(F=138.74,P<0.05)。D组裸鼠成形瘤块移植后瘤块体积先略增大后逐渐减小,移植第14天始持续增大,8只中7只成瘤。E组裸鼠未见瘤体形成。组织病理学检查,各组瘤体的组织形态在镜下一致,与人瘢痕疙瘩组织相似,未见其他脏器组织学改变及转移瘤灶。结论裸鼠皮下接种人瘢痕疙瘩成纤维细胞可建立瘢痕疙瘩裸鼠荷瘤模型,而且已成瘤组织修剪成一定体积再次移植于裸鼠皮下也可以建立瘢痕疙瘩裸鼠荷瘤模型。
瘢痕疙瘩;成纤维细胞;疾病模型,动物
瘢痕疙瘩是以胶原蛋白和成纤维细胞堆积为特点的纤维增生性疾病[1],临床上尚没有特效治疗方法,复发率极高[2]。曾有研究者尝试用鼠、兔或其他动物研究瘢痕疙瘩[3-4],但它们的创伤愈合结果都与人类形成的瘢痕疙瘩差异较大[5]。在肿瘤动物模型的建立中,体外肿瘤细胞培养后接种于动物体内是常用的建模方法[6],Matrigel胶是制备肿瘤动物模型常用的辅助材料,在4℃下呈液体状态,而在室温条件下,聚合形成具有生物学活性的三维基质,能模拟体内细胞基底膜的结构,与肿瘤细胞混合后接种能缩短成瘤时间,提高成瘤率[7]。我们利用Matrigel胶的此特性与人瘢痕疙瘩成纤维细胞混合后,移植于裸鼠皮下,制备瘢痕疙瘩裸鼠荷瘤模型,为今后研究瘢痕疙瘩的作用机制及治疗提供基础。
材料和方法
一、实验动物
健康雌性BALB/c裸鼠27只,SPF级,6~8周龄,体重20~22 g,由北京维通利华公司提供,合格证号:11400700023588。饲养于中国医学科学院药物研究所动物饲养中心。
二、实验材料
DMEM培养液、磷酸盐缓冲液(PBS),美国HyClone公司;胎牛血清,美国Gibco公司;消化液(0.25%胰蛋白酶、0.03%EDTA)、冻存液,北京协和基础医学细胞中心;Matrigel胶,美国BD公司。
三、实验方法
1.细胞培养:人瘢痕疙瘩成纤维细胞(CRL-1762)由上海丽臣生物技术有限公司保存传代,采用含10%胎牛血清的DMEM培养液,在37℃、5%CO2培养箱中培养,3 d换液1次,细胞长满90%时传代,取第3~5代细胞用于实验。
2.细胞处理:取对数生长期瘢痕疙瘩成纤维细胞,PBS冲洗2次,加入适量消化液消化,取细胞悬液离心,弃上清,加无血清DMEM培养基制成单细胞悬液,计数后再次离心,弃上清,置于冰上,加入Matrigel胶,吹打混匀,调整细胞密度分别为1.0×104个/μl Matrigel胶,3.0 × 104个/μl Matrigel胶,5.0 ×104个/μl Matrigel胶。
3.细胞接种:27只裸鼠随机分为5组。A、B、C组各5只,分别于裸鼠右腋窝下接种1.0×104、3.0×104、5.0 × 104个成纤维细胞/μl Matrigel胶, 每只接种1点,接种量为0.1 ml。D组8只,取C组成瘤瘤体组织,无菌环境下修剪成5 mm×5 mm×5 mm,在D组裸鼠右腋窝处皮肤消毒后做一切口,长约1 cm,在距离切口一定距离的皮下潜行分离腔隙,将修剪后的瘤体组织包埋于裸鼠皮下,切口处丝线缝合。E组4只,注射0.1 ml Matrigel胶作为对照组。术后观察成瘤情况,并记录瘤体大小(测瘤体长径a与短径b,体积V=a×b2/2)和裸鼠体重。
4.组织病理学检查:以成纤维细胞接种后出现皮下结节,直径大于0.5 cm记为出瘤时间[8]。各组裸鼠出瘤后30 d处死,取出瘤体及裸鼠的心、肝、脾、肺、肾,4%甲醛固定,石蜡包埋,切片,HE染色,光镜下观察瘤体的组织学形态及裸鼠的内脏组织形态学改变。
5.统计学处理:用SPSS17.0软件进行统计学分析,计量资料以±s表示,各组间瘤体体积比较用方差分析,P<0.05为差异有统计学意义。
结 果
一、成纤维细胞接种后成瘤情况
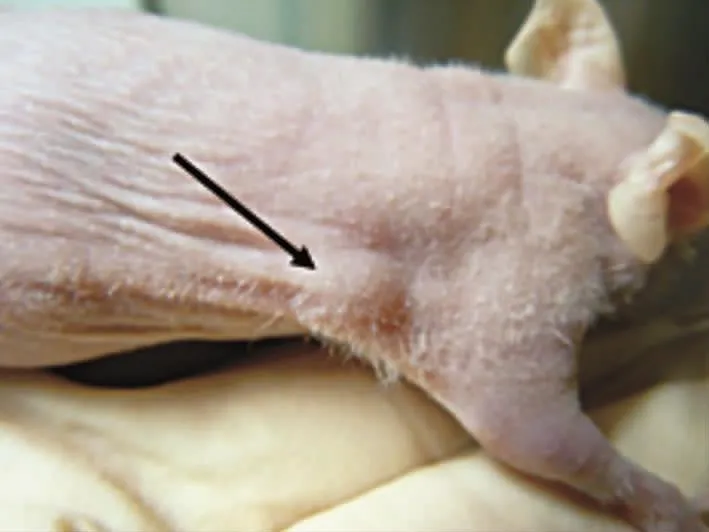
图1 人瘢痕疙瘩成纤维细胞接种雌性BALB/c裸鼠右腋窝下后形成的皮下瘤
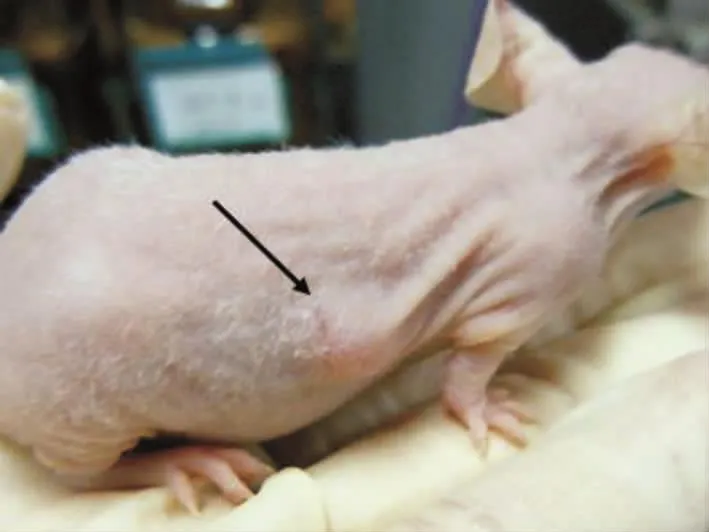
图2 雌性BALB/c裸鼠右腋窝处瘤块移植后3 d瘤体情况(D组)
见图1。A、B、C组裸鼠成瘤率为100%,出瘤时间分别为(90.20 ± 3.96)d、(61.00 ± 2.92)d、(39.60 ±3.20)d。出瘤后30 d时A组瘤体体积为(288.34±25.29)mm3,B组为(1 370.63±105.24)mm3,C组为(1 940.98±184.37)mm3,A、B、C组瘤体体积比较,差异有统计学意义(F=138.74,P<0.05)。E组裸鼠未见瘤体形成。
二、瘤块移植后成瘤情况
D组裸鼠皮下移植瘤块后3 d切口基本愈合,见图2。瘤体移植后体积稍有增加,4 d后逐渐减小,14 d左右开始持续增大(图3)。其中1只由于移植时瘤块组织与切口过于靠近,小部分瘤体组织与切口相连或外露,瘤块在切口愈合过程中逐渐结痂至消失,故D组8只中7只成瘤。
三、瘤体组织肉眼观察
A、B、C、D组裸鼠皮下瘤体均为实体瘤,圆形或椭圆形,瘤体生长部位可见新生血管形成,瘤体包膜完整,未侵袭周围组织。瘤体横切面呈淡红色,质软(图4)。

图3 雌性BALB/c裸鼠右腋窝处瘤块移植后瘤体体积变化
四、组织病理学检查
A、B、C组与D组裸鼠皮下瘤镜下结构一致,成纤维细胞密集排列,呈放射状、漩涡状走行,与人瘢痕疙瘩组织相似(图5)。各组裸鼠的心、肝、脾、肺、肾组织HE染色结果未见组织病理学改变和转移瘤灶。
讨 论

图4 雌性BALB/c裸鼠右腋窝处移植瘤的肉眼观察 4a:解剖时完整瘤体;4b:瘤体的横切面图
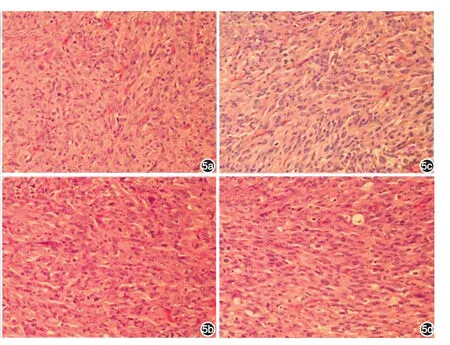
图5 雌性BALB/c裸鼠瘤体组织的组织学形态(HE×100) 5a~5c:分别为接种1.0×104、3.0×104、5.0×104个成纤维细胞/μl Matrigel胶组;5d:瘤块移植组。4组裸鼠皮下瘤镜下结构一致,成纤维细胞密集排列,呈放射状、漩涡状走行
目前应用较多的瘢痕疙瘩动物模型是临床上手术切下的人瘢痕疙瘩组织剪成小块后植入到裸鼠皮下制备而成[9],但这种方法制备模型有时限性,必须在瘢痕疙瘩离体后2~3 h内移植到裸鼠皮下,否则瘢痕疙瘩组织坏死导致建模失败。Wang等[10]从人瘢痕疙瘩组织中分离出成纤维细胞,并在体外培养后接种到一种新型高空隙率海绵状聚乳酸-乙醇酸共聚物(PLGA)的支架上,将该支架旋转培养1周后植入到裸鼠皮下,建立瘢痕疙瘩模型。但此方法对生物材料、培养系统和操作技术要求较高,很难普遍应用于瘢痕疙瘩的研究中。在肿瘤模型的建立中,较常用的是将人或动物的肿瘤组织或细胞移植到动物体内形成肿瘤模型,目前较成熟的肿瘤模型有结肠癌、黑素瘤、乳腺癌、肺癌模型等[3]。考虑瘢痕疙瘩具有侵袭性生长的特性和难治的临床症状,类似于肿瘤,但其生长速度缓慢,无远处转移,也有人将其定义为良性肿瘤[11]。因此,本实验模拟肿瘤的建模方法,将人瘢痕疙瘩成纤维细胞与Matrigel胶混合接种于裸鼠皮下,建立了瘢痕疙瘩动物模型。
本实验中细胞接种模型的出瘤时间与接种细胞密度明显相关,密度高者出瘤快,虽然每组裸鼠均形成皮下瘤,但接种量为1.0×104/μl Matrigel胶时,出瘤时间长达90 d,此时裸鼠生命状态已开始逐渐下降,皮肤变薄,出现衰老迹象,瘤体增长缓慢,不利于后期实验研究,不推荐应用此密度建立模型。当接种量为3.0×104/μl Matrigel胶和5.0×104/μl Matrigel胶时,平均出瘤时间分别为61 d和40 d,整个观察过程中均未发现瘤体失控性生长和坏死,是较合适的接种密度。而且由此推测,如果增加细胞接种量,出瘤时间有可能提前,这还需通过更多的实验证实。考虑到大批量建立动物模型时需要细胞较多,同时接种工作量非常大,故本实验将已成形瘤块继续移植到其他裸鼠体内,即把经细胞接种后形成的瘤体切成若干小块,分别移植到裸鼠皮下,由于本实验中A组和B组出瘤时间较长,而C组成瘤较快,故只将C组成形瘤块进行分割移植,其他密度细胞接种形成的瘤块移植后的生长情况还需进一步考察。D组裸鼠瘤块移植后瘤块体积略增大后逐渐缩小甚至小于移植时瘤块大小,这可能由于植入时皮下组织创伤形成水肿,导致体积略增大,随后移植组织部分被吸收,体积减小;至移植后14 d左右瘤体开始持续性增大,说明移植瘤周围已形成新生血管,瘤体开始成活生长。有研究表明,在裸鼠皮下移植人瘢痕疙瘩组织时,在移植后16 d已有血管形成[12],这与本实验结果接近。本实验中瘤块移植方法能降低细胞培养的工作量,在建模时先以高浓度细胞接种几只裸鼠,将得到的瘤块分割后分别移植到多只裸鼠皮下,同时获得较多的模型,而且组织学观察发现移植后成活的瘤块与人瘢痕疙瘩成纤维细胞接种所得瘤块未见明显差异,也可以用此方法建立瘢痕疙瘩裸鼠荷瘤模型。另外,本实验瘤块移植组中有1例可能瘤块与切口过于靠近,在切口愈合的过程中瘤块组织与切口共同形成结痂后逐渐消失,因此,瘤块移植时应在距离切口一定距离的皮下潜行分离腔隙,并妥善固定组织块,避免移植组织外露,可以有效提高瘤块移植的成功率。
通过本次实验研究,初步确定了人瘢痕疙瘩成纤维细胞结合Matrigel胶于裸鼠皮下接种的可成瘤性,成功建立了人瘢痕疙瘩成纤维细胞接种模型和瘤块移植模型。本课题组还将进行以下方面的深入研究:Matrigel胶中本身含有Ⅳ型胶原、基质金属蛋白酶、生长因子等,可能会对某些实验研究造成影响,模型应用时应尽量减少Matrigel胶的干扰作用或者筛选更合适的移植材料;本实验针对细胞接种数量进行了考察,还需要研究细胞的传代代数和细胞活性对成瘤结果的影响,并进一步探讨瘤块的细胞成分和来源以及瘤块传代后的变化;也将与人瘢痕疙瘩组织块裸鼠移植模型进行比较,观察两者成纤维细胞有无差异性。以上问题的深入解决将使此模型的建立更加合理、可靠,适用广泛。
[1]安英华,金英姬,方宇辉,等.瘦素抗体对兔耳增生性瘢痕组织转化生长因子-β1 mRNA表达的影响[J].中华皮肤科杂志,2013,46(2):109-112.
[2]Naylor MC,Brissett AE.Current concepts in the etiology and treatment of keloids[J].Facial Plast Surg,2012,28(5):504-512.
[3]尹冬云,曹莫,刘柳.长脉冲1 064 nm Nd:YAG激光治疗兔耳增生性瘢痕的实验研究[J].中华皮肤科杂志,2011,44(7):479-482.
[4]张彤,夏群力,郑捷.强功率UVA1对兔耳增生性瘢痕模型影响的机制研究[J].中华皮肤科杂志,2011,44(1):39-43.
[5]Greenhalgh DG.Models of wound healing[J].J Burn Care Rehabil,2005,26(4):293-305.
[6]万继英,韩庶勇.肿瘤实验动物模型的建立及应用研究进展[J].医学综述,2009,15(19):2959-2961.
[7]Benton G,Kleinman HK,George J,et al.Multiple uses of basement membrane-like matrix(BME/Matrigel)in vitroandin vivowith cancer cells[J].Int J Cancer,2011,128(8):1751-1757.
[8]杨勤,张亚声,杨德全.复方苦参注射液联合低剂量5-Fu对人胃癌裸鼠移植瘤血管生成的影响[J].重庆医学,2011,40(32):3239-3241.
[9]Shetlar MR,Shetlar CL,Hendricks L,et al.The use of athymic nude mice for the study of human keloids[J].Proc Soc Exp Biol Med,1985,179(4):549-552.
[10]Wang H,Luo S.Establishment of an animal model for human keloid scars using tissue engineering method[J].J Burn Care Res,2013,34(4):439-446.
[11]刁建升,马显杰.瘢痕疙瘩发病机制和药物治疗研究新进展[J].中国美容整形外科杂志,2013,24(3):187-189.
[12]金培生,岑瑛,刘晓雪,等.病理性瘢痕裸鼠模型的建立[J].中华烧伤杂志,2007,23(2):126-129.
2014-03-19)
(本文编辑:颜艳)
Establishment of a keloid model in nude mice with human keloid-derived fibroblasts
Zhu Lianhua*,Wan Hongshuang,Jin Mingji,Fang Yuhui,Li Zhouna,Jin Zhehu,Gao Zhonggao.*Department of Dermatology,Yanbian University Hospital,Yanji 133001,Jilin,China
s:Jin Zhehu,Email:jinzh-621@163.com;Gao Zhonggao,Email:zggao@imm.ac.cn
ObjectiveTo establish a simple and efficient method for developing a keloid model in nude mice with human keloid-derived fibroblasts.MethodsTwenty-seven female BALB/c nude mice were randomly divided into five groups with 5,5,5,8 and 4 mice in group A,B,C,D and E respectively.The mice in group A,B and C were inoculated with 0.1 ml of suspension containing human keloid-derived fibroblasts at concentrations of 1.0 × 104,3.0 × 104and 5.0 × 104per microliter Matrigel,respectively,at the right axillary fossa.The tumors that formed in one mouse in group C were taken out,and cut into several parts measuring 5 mm × 5 mm × 5 mm in size,which were then subcutaneously transplanted into the right axillary fossa of mice in group D.The mice in group E were subcutaneously injected with 100 μl of Matrigel and served as the control group.The formation of tumor in mice was observed by naked eyes,and the size of tumors was measured until day 30 after tumor formation in group A,B and C as well as after tumor transplantation in group D.Mice were sacrificed on day 30 after tumor formation,and histopathologic examination was performed to analyze histological features of transplanted tumors and pathological changes in visceral organs such as heart,liver,spleen,lung and kidney.ResultsThe tumor formation rate was consistently 100%in group A,B and C,and the time required for tumor formation was(90.20 ± 3.96),(61.00±2.92)and(39.60±3.20)days in group A,B and C respectively.There was a significant difference in tumor volume on the 30thday after tumor formation between group A,B and C((288.34±25.29)vs.(1 370.63±105.24)vs.(1 940.98 ± 184.37)mm3,F=138.74,P< 0.05).The size of implanted tumor mass in group D firstly increased,then gradually decreased,but began to continuously increase since the 14thday,and tumor finally formed in 7 out of 8 mice.There was no evidence of tumor formation in group E.Histopathologic examination showed uniform histological manifestations,which were similar to those of human scar,in tumor tissues from mice in group A,B,C and D.Neither pathological changes nor metastases were observed in visceral organs of these mice.ConclusionKeloid-bearing nude mouse model can be established by subcutaneous inoculation with human keloidderived fibroblasts,or by subcutaneous transplantation of tumor masses of a certain size that have formed in nude mice.
Keloid;Fibroblasts;Disease models,animal
412-4030.2014.12.003
国家自然科学基金(81260233、81373342);2013年吉林省产业技术研究与开发专项项目计划(2013C034);吉林省教育厅“十二五”科技研究项目;吉林省卫生厅科研课题(2011Z085);北京市自然科学基金(2141004)
133001吉林延吉,延边大学附属医院皮肤科(朱莲花、万红双、方宇辉、李周娜、金哲虎);中国医学科学院药物研究所(金明姬、高钟镐)
金哲虎,Email:jinzh-621@163.com;高钟镐,Email:zggao@imm.ac.cn

