在用医疗仪器设备现状及监管对策思路
【作 者】马莉,杜堃,叶岳顺,吴夷,林联君,孙瑜,秦丽萍
浙江省医疗器械检验院,杭州市,310018
作为在医疗领域发挥越来越重要作用的诊断、治疗用的医疗仪器设备,既有普通仪器设备的一般特性:需要进行日常的维护保养,保证其适用性,又有作为医疗器械特定用途的更高要求:涉及生命安全和健康的性能必须得到保证。而目前对保障在用医疗仪器设备正常、有效、安全运行和使用的法规和机制,在统一、明确、有效和完善性方面还相当地缺乏,这也引起业内不少有识之士的关注和思考。本文试就从近几年对医疗机构部分在用仪器设备进行检测所获得的数据及在检查过程中获得的一些信息,对目前在用医疗仪器设备现状进行说明和分析,据此提出对在用医疗仪器设备的监管对策思路,供监管部门和其他相关人士参考。
1 概述
医疗器械现行的行政法规《医疗器械监督管理条例》调整对象是从事医疗器械的研制、生产、经营、使用、监督管理的单位或者个人,因此医疗器械的监管应包含其产品的整个生命周期[1]。为了对在用医疗仪器设备现状情况进行摸底,我省监管部门分地区逐步对医疗机构部分在用仪器设备作为评价性监督抽验进行了检查。在具体实施中,对在用仪器设备部分检验项目的要求和试验方法上仍按照相关设备的国家和行业标准进行。
2011~2013年间共进行了注射泵、输液泵、激光治疗仪、除颤器、婴儿培养箱、婴儿光治疗仪、电动病床、心电图机、心电监护仪、验光仪等10个品种在用仪器设备的评价性抽验共584台(件),遍及浙江省内8个地市的三甲、三乙、二甲、二乙医院和尚未获得等级评定的55家综合、专科或是国营、民营医疗机构。从统计意义上讲,这样的样本量不足够充分、典型,但从获得的数据和相关信息中仍可了解一些目前在用医疗仪器设备的现状,并据此对监管对策思路进行了思考,欲以此投石问路、抛砖引玉,以期引起相关方的关注、重视和集思广益。
2 数据统计和现状分析
经过检查,在584台受检在用医疗仪器设备中,有159台含有各种不符合项,占受检总数的27.2%;8个受检地区的受检在用医疗仪器设备均存在不符合项,其中存在不符合项的在用仪器设备占受检仪器设备比例最高的地区达到了47.0%;55家受检医疗机构中有38家医疗机构受检的在用医疗仪器设备存在不符合项,在用仪器设备存在不符合的受检医疗机构占受检医疗机构总数的69.1%,仅有17家医疗机构在用仪器设备检验品种未见存在不符合项,见图1。
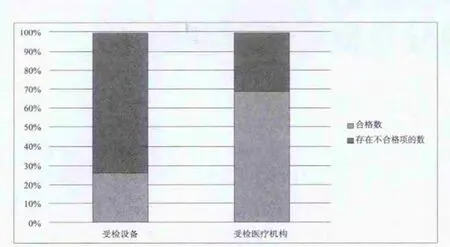
图1 受检设备和受检医疗机构概貌Fig.1 General picture of tested equipment and medical institution
在10种受检样品中,除心电图机外,其余在用仪器设备就设定的检验项目而言均发现了有各种不合格项;而就品种而言,含有不合格项的在用医疗仪器设备占所有被检查在用仪器设备的90%。其中含有不合格项在用仪器设备比例最高的是婴儿光治疗仪,为81.8%,其他含有不合格项在用仪器设备比例较高的品种是激光治疗仪、电动病床和验光仪,含有不合格项在用仪器设备比例分别占到了其受检总数的77.4%、73.9%和50.0%,见图2。
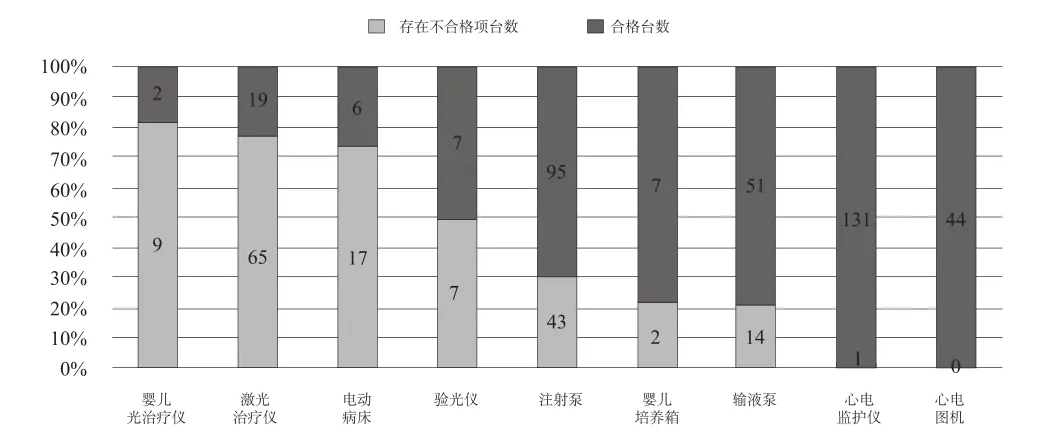
图2 受检仪器设备情况Fig.2 General picture of tested equipiment
本集合数据中检查项目是按现行相关标准的要求进行检查的,虽然这些项目的设定尚可探讨和商榷,但通过检查发现的问题,归纳分析有以下几个方面:
(1)售后服务不足,定期调校、更换部件不充分。部分在用仪器设备,如激光治疗机虽然也进行调校,但通常只对激光输出的最大值进行校准,没有对使用中功率或能量的整个范围进行校准,还有一些使用中的激光治疗仪是未经现场安装和调校的,不得而知这样的调校活动或不调校是否经过了风险评估,使用方是否明确知晓其风险程度。
(2)对产品标签、标识不够重视或对标准中要求的标签、标识内容理解有偏差致产品标签、标识错误或不规范。检查中发现一些在用医疗仪器设备缺少符合标准要求的适当标记,或者标记形式、位置、内容的错误或者使用后标记发生脱落等现象。而产品的标记有时与安全使用密切相关,有些产品风险是靠有效的产品标记提醒、说明得以降低的,因为产品标签、标识错误、不规范或脱落增加了产品的使用风险。
(3)医疗仪器设备本身未能标识预期使用年限或寿命。一般是视使用单位的经费情况考虑对医疗仪器设备的更新换代,制造商也未能针对不同使用频次和使用环境给出详细的维护保养频次和维护保养项目、步骤、评价等内容的建议和说明,一些医疗机构对此也未予以充分的重视,缺乏全面、有效的维护保养制度、规范及从事医疗仪器设备维护保养的专业人员。
(4)使用时间长,维护不足或部件更新不及时。部分受检在用仪器设备使用年代久远,维护不足或部件更新不及时,导致部分受检项目表征的性能降低。如:仪器设备中的接地端子由于长期的电化学反应,载流能力下降导致保护接地阻抗增加;除颤器的核心元件高压储能电容出现了老化或者缺少日常维护,锂电池因长久未充放电而致充电时间过长;激光管老化而致的控制器件和仪表的准确性下降。
(5)有些医疗机构的使用环境和条件不能完全满足需要。检查中还发现部分医疗机构仪器设备使用场所老旧,建筑物本身未提供有效接地,以致在此环境下使用的医疗仪器设备接地不良;部分在用的进口医疗仪器设备仍使用欧标的电源线插头。
(6)医疗机构保障在用医疗仪器设备正常、有效、安全运行和使用的制度机制缺乏。在一些医疗机构,很多医疗仪器设备的使用几近饱和,难以想象正常有序维护保养的开展和进行能得以保障;而一些小型但使用量较大的医疗设备,如注射泵、输液泵等的日常维护保养几近空白,通常是只要能开机运行,就一直使用着;一些有安全隐患的场所,如激光工作场所的进入和操作人员未受制度或规定的限制,在部分激光治疗机的安全连锁装置失效或遥控连锁装置未按要求使用时,人身伤害的风险较大。
从检查过程中获得的本集合数据及相关信息看,相较对医疗器械生产企业和产品的监管而言,对在用医疗仪器设备的监管,无论是法规还是具体形式和内容上都要薄弱得多,显示出监管上的极不平衡,故而存在风险隐患较多。目前与《条例》相配套的部门规章不多,且大部分是规范医疗器械生产企业和产品的,对获证医疗器械投入使用后的部门规章仅有2011年出台的《医疗器械召回管理办法(试行)》[2]以及安徽、辽宁、浙江省以及济南市发布的关于医疗器械使用监督管理办法的地方法规和规章[3-6]。在现有的千余项医疗器械的国家或行业标准中,绝大部分都是对刚生产完成,尚未使用的医疗器械的规范,涉及在用医疗仪器设备(已使用)相关内容的仅有行业标准YY/T 0841-2011《医用电气设备 医用电气设备周期性测试和修理后测试》(IEC 62353:2007,IDT),但此标准是针对在用医用电气设备的一个原则性通用要求,无法据此对某一个具体产品的测试数据作为判定的依据,更无法给出最后的综合判定结论。法规的缺失和技术层面上标准的不足导致了与在用医疗仪器设备相关的各方,都没有统一、协调、全面、完善的依据和指导,监管乏力。如生产企业、医疗机构对在用医疗仪器设备的服务和保障完全视其本身对这个问题的认识程度开展,各种制度从数量和覆盖面上参差不齐,总体是既不完整,也不全面;技术支撑的评估检测机构依据不充分,无法开展全面检查,检测获得的数据没有充分的判定依据。
3 监管对策思路的探讨和建议
本集合数据及反映的问题虽不足够充分、全面,但就上述分析而论,我们认为在用医疗仪器设备的安全、有效使用监管涉及面较为广泛,内容颇为丰富,应该从法规、标准、检测、评估以及制造商、医疗机构保障等方面考虑一个系统、全面、整体、协同的体系,来保证在用医疗仪器设备正常、有效、安全运行和使用,其内涵是以政府层面的法规建设、在用医疗仪器设备标准体系建设、监测评估技术体系建设为核心,促进制造商的服务保障体系建设、医疗机构的使用保障体系建设,最终以保障医疗机构中在用医疗器设备正常、有效、安全运行和使用为落脚点的系统建设,如图3所示。
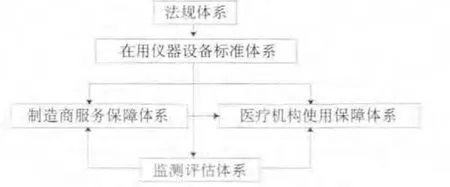
图3 在用医疗仪器设备监管框架Fig.3 Frame strutuer of medical devices in use on supervising
3.1 法规和制度体系建设
行政监管依据的是法规,因此法规建设是实施行政监管的前提和条件。医疗器械的监管在现行医疗器械监督管理条例框架下,对于医疗机构及在用仪器设备的监管法规和制度相较对于医疗器械生产企业、经营企业和未经使用产品的监管法规,更为缺乏和薄弱。建议在医疗器械监管的国家层面上开展在用仪器设备情况的调研,探索研究在我国现行体制制度下医疗机构在用医疗仪器设备的监管思路和模式,逐步建立和健全适应我国国情及未来发展需要、能够满足在用医疗仪器设备正常、有效、安全运行和使用的监管法规制度。在医疗仪器生产、经营、使用、维护保养以及监管等环节对在用医疗仪器设备的安全、有效明确要求、责任及必要的惩罚规则,从法规和机制上保证在用医疗仪器设备的安全、有效使用。具体内容可包含:对于技术层面在用医疗仪器设备标准体系的要求;明确制造商在其产品生命周期内的服务保障责任和义务;明确医疗机构保障在用仪器设备正常、有效、安全运行和使用的责任和义务;明确监测评估部门对于最终保证在用仪器设备正常、有效、安全运行和使用的职责;对于不能履行职责、责任和义务的罚则。
可尝试推行在用医疗仪器设备周期检验及状态标识制度,并对在用医疗仪器设备的正常、有效运行进行考核和监督,其结果作为医疗机构绩效考核或等级评定的重要内容之一。
3.2 在用医疗仪器设备标准体系建设
强化在用医疗仪器设备标准体系的研究和建设,围绕YY/T 0841-2011《医用电气设备 医用电气设备周期性测试和修理后测试》(IEC 62353:2007,IDT)基础标准,在充分积累在用医疗仪器设备现有数据基础上,结合风险分析,逐步建立完整的、系统的、层次清晰的、相互配套、互相协调的以在用医疗仪器设备为调整和规范对象的标准体系。在此标准体系基本框架内,推出不同种类,不同应用领域、不同安全等级的在用医疗仪器设备规范或检测标准以及评估标准,具体内容可涉及:
(1)用以规范和指导制造商结合产品的预期用途、风险分析及实际产品质量管控情况,以适当方式给出产品预期寿命或使用年限以及日常维护保养频次、项目、步骤等内容的建议或给予产品生命周期内,产品正常、有效、安全运行的服务保障和承诺;
(2)用以规范和指导医疗机构为保证在用医疗仪器设备正常、有效、安全运行和使用的维修保养制度,明确职责、任务、目标以及考核、评价等;
(3)用以指导在用医疗仪器设备监测评估的要求、内容、方法、步骤等,统一规范监测和评估工作的具体实施;
也可采用与医疗器械标准体系建设同步的方式,即在一些医疗仪器设备的标准中体现其投入使用后的规范要求。另外,在建设在用医疗仪器设备标准体系过程中,必须加强和重视对这些标准的宣贯。其意义在于,对制造商而言,是对标准要求的正确理解,把握和执行,按要求提供服务承诺;对医疗机构而言,是对其使用的医疗仪器设备所涉及标准的了解,以及正确保养和维护在用的仪器设备;对监测评估机构而言,则是对标准的正确使用和判定。
3.3 在用仪器设备监测评估体系建设
通过法规、制度和标准要求,逐步建立医疗机构在用医疗仪器设备的监测、评估和跟踪机制,这种机制既可以是监管部门委托的第三方技术机构实施的监测评估和跟踪,也可以是医疗机构本身的执行和实施。具体内容可涉及:根据不同临床科室类别、不同安全应用等级,对在用医疗仪器设备实施监测评估;按制度和规定进行的仪器设备维护保养的活动;按标准和规范对在用医疗仪器设备进行检测的活动;评估在用医疗仪器设备正常、有效、安全运行和使用的保障能力;对维护、维修(包括更换部件)、保养后或定期监测获得的某些性能下降的在用医疗仪器设备进行安全风险的评估、继续使用的限定或强行更换、报废处理规定等;对于已发现问题,进行整改后的在用医疗仪器设备进行跟踪的监测评估。
这样的监测评估和跟踪体系应该是制度化的、长效的、有效运行并有接口可以对其不断进行优化的,尤其是医疗机构在用仪器设备监测机制,其是否有效运行应纳入医疗机构绩效考核内容之一。
3.4 医疗机构在用仪器设备安全使用保障体系建设
通过法规、制度和标准要求,建立健全医疗机构在用仪器设备安全使用的保障体系,其包含的内容可以涉及:明确职责、任务的机构设置和人员要求;全面详尽的在用医疗仪器设备维护保养计划及实施记录;全面详尽的、明确间隔周期的监测评估计划及实施记录;符合实际需要的包括在用现场在用仪器设备状态标识等内容在内的管理控制制度;可便利操作的检查监督制度。
医疗机构在用仪器设备安全使用的保障体系可以借力于制造商提供的定期调校或维护保养服务和第三方监测评估机构提供的技术服务。
3.5 制造商服务保障体系建设
通过法规、制度和标准要求,建立制造商服务保障体系,这种保障体系涉及的内容可以是:对于产品生命周期或使用寿命的预期或建议;对于产品维护保养的内容、方式、步骤、频次的建议以及易损部件更换标准;为用户定期调校的承诺及实施方式;维修后限定或降级使用的建议以及报废、更换的建议条件。
这种保障体系既可以是制造商本身实施,也可通过企业联盟或协会组建第三方的服务保障机构具体操作和实施。
3.6 其他监管手段和措施建议
通过调研对实际现状和监管需求的分析,不断丰富对在用医疗仪器设备的监管手段和措施。一是在全面建立和运行在用医疗仪器设备监测评估体系、制造商服务保障体系和医疗机构在用医疗仪器设备安全使用保障体系基础上,建立健全医疗机构在用仪器设备安全使用信用等级评定机制,以在用医疗仪器设备安全、有效使用的信用等级作为评估医疗机构等级评定和工作目标的考核内容之一,提高医疗机构对在用医疗仪器设备安全、有效使用的重视程度,促进和保障在用医疗仪器设备的安全、有效使用;二是进一步强化对现有注册产品的审评要求,对现有注册产品的审评更为全面,不仅关注产品性能参数的实际检测结果,更要强化对医疗仪器设备产品说明书、用户手册、附加信息、标签、标记等内容执行标准程度的评估以及具体产品的维护保养周期、项目内容的要求。
4 结束语
医疗器械关乎人的生命安全和健康,安全、有效地发挥其应有的效用,涉及产品的整个生命周期。随着现代医疗技术对于医疗器械依赖程度的日益提高,使用环节安全、有效的重要性应等同于生产环节和产品质量的重要性,也越来越引起人们的普遍关注。希望有识之士共同进行更多的研究探讨,推动在用医疗仪器设备安全、有效使用水平的提高。
[1]中华人民共和国国务院.国务院令第276号医疗器械监督管理条例[EB/OL].[2000-01-04].http://www.sda.gov.cn/WS01/CL0063/16570.html.
[2]中华人民共和国卫生部.卫生部令第82号医疗器械召回管理办法(试行)[EB/OL].[2011-05-20].http://www.sda.gov.cn/WS01/CL0053/63138.html.
[3]安徽省人民政府.安徽省药品和医疗器械使用监督管理办法[EB/OL].[2007-12-18].http://www.sda.gov.cn/WS01/CL0877/64488.html.
[4]济南市人民政府.济南市医疗器械使用管理若干规定[EB/OL].[2008-11-14].http://www.sda.gov.cn/WS01/CL0877/64522.html
[5]辽宁省人民政府.辽宁省医疗机构药品和医疗器械使用监督管理办法[EB/OL].[2006-11-30].http://www.lnfda.gov.cn/CL0016/867.html.
[6]浙江省人民政府.浙江省医疗机构药品和医疗器械使用监督管理办法[EB/OL].[2007-10-15].http://www.sda.gov.cn/directory/web/WS01/CL0005/25787.html.

