KLF9基因腺病毒载体的构建及其抗ROS功能
焦 涛,崔安芳,常永生
(中国医学科学院 基础医学研究所 医学分子生物学国家重点实验室, 北京 100005)
研究论文
KLF9基因腺病毒载体的构建及其抗ROS功能
焦 涛,崔安芳,常永生*
(中国医学科学院 基础医学研究所 医学分子生物学国家重点实验室, 北京 100005)
目的构建及鉴定KLF9基因过表达的腺病毒载体,初步研究KLF9在对抗反应活性氧方面的功能。方法克隆KLF9过表达质粒,定向克隆入穿梭载体pAdTrack-CMV,PmeⅠ酶切线性化,转化E.coli.BJ5183(含腺病毒载体pAdEasy-1)感受态细菌,产生重组腺病毒载体。重组载体经过卡那霉素抗性筛选和限制性内切酶分析确认重组后,再用PacⅠ线性化重组质粒,回收,转染293A细胞,7~12 d包装产生病毒颗粒。利用H2O2和过表达KLF9的腺病毒处理体外培养的C57BL/6J小鼠原代肝脏细胞,实时定量PCR检测KLF9和抗ROS基因(CAT、SOD2和GPx1)的表达。结果H2O2可以刺激C57BL/6J小鼠原代肝脏细胞KLF9和抗ROS基因的表达上调(Plt;0.05)。定量PCR以及Western blot结果显示成功包装过表达KLF9腺病毒,感染效率达90%以上。过表达KLF9可以上调抗ROS基因的表达水平(Plt;0.05)。结论初步认定KLF9基因可参与C57BL/6J小鼠原代肝脏细胞中抗ROS基因的调节。
KLF9;腺病毒;反应活性氧
反应活性氧(reactive oxygen species, ROS)包括超氧阴离子、过氧化氢和羟自由基等。正常状态下,氧化磷酸化过程中消耗的氧0.4%~4.0%转化为过氧化物,并最终解毒成O2和H2O2。当机体的防御机制无法抵抗活性氧的产生,就会产生氧化应激,诱导生物大分子(如DNA、蛋白质、脂类等)发生超氧化反应而产生突变或损伤,引起细胞结构、功能破坏[1]。机体内抗氧化防御机制主要有两种:抗氧化酶类如超氧化物歧化酶(manganese superoxide dismutase,SOD2)、过氧化氢酶(catalase,CAT)等,非酶类分子则包括谷胱甘肽(glutathione,GSH)、硫氧还蛋白(thioredoxin,TRX)和维生素A、C、E等[2]。
Krüppel样转录因子(Krüppel-like factors,KLFs)是一类Cys2/His2锌指结构-DNA结合蛋白[3],在细胞的增殖、分化、凋亡[4]和组织器官发育[5]中发挥重要作用。目前的研究表明有许多KLF家族成员都与机体的能量代谢有关。Krüppel样转录因子9(KLF9),又称为基础转录元件结合蛋白-1(basic transcription element-binding protein-1,BTEB1),是KLF家族中的重要成员,最初从大鼠肝脏 cDNA文库中克隆得到[6]。但是有关KLF家族在能量代谢和ROS方面的研究鲜有文章报道。本研究初步探讨KLF9在抗反应活性氧中的作用机制。
1 材料与方法
1.1 材料
KLF9扩增序列引物(Invitrogen公司),扩增序列:5′-GAATTCCCACCATGTCCGCGGCCGCCTACA-3′(正向)和5′-CTCGAGTCACAAGGGGCTGGC-3′ (反向),两端分别添加KpnⅠ和XbaⅠ酶切位点,C端加Flag标签。KpnⅠ和XbaⅠ酶、T4 DNA连接酶、pyrobest Taq DNA聚合酶、dNTPs(Takara公司)。T-easy质粒、实时定量PCR试剂盒(Promega公司)。Lipofectamine2000、细胞培养基DMEM、RPMI1640、 Trizol(Invitrogen公司)。pAdTrack-CMV、pAdTrack-U6、E.coli. BJ5183、DH5 感受态细菌以及人胚肾细胞系293A由本实验室保存。反转录试剂盒(ABI公司)。胎牛血清、青霉素、链霉素(Hylone公司)。明胶和胶原酶(Sigma公司)。六周龄的雄性C57BL/6J小鼠购自中国人民解放军军事医学科学院实验动物中心[许可证号为SCXK-(军)2012-0004]。小鼠饲养和管理按照中国医学科学院的实验动物标准执行。
1.2 KLF9基因重组质粒的构建及腺病毒包装
将测序正确连接在T-easy质粒上的KLF9酶切下来,定向插入穿梭载体pAdTrack-CMV。提取穿梭质粒,取5 μg质粒,经PmeⅠ酶切7 h充分线性化,酚/氯仿抽提,溶于20 μL去离子水中。取100~500 ng酶切质粒转化E.coli. BJ5183感受态细菌。以500 mL LB培养基重悬细菌,涂于卡那霉素抗性的LB平板,置于37 ℃孵箱内培养16~20 h。挑取较小的克隆摇床过夜,提质粒,经PacⅠ酶切可得30.0和4.5 kb两条带,即为阳性克隆。将阳性克隆的质粒转化大肠杆菌DH5,提取质粒。取12 μg所得的重组质粒,用PacⅠ 酶切7~9 h,经酚/氯仿抽提,乙醇沉淀后,溶于去离子水。将回收质粒以转染密度50%~70%接种于T-25培养瓶的293A细胞。孵箱中培养10~15 d,不用换培养基,隔天补500 μL DMEM完全培养基。一般转染5~7 d后可以通过荧光显微镜观察到GFP斑。
1.3 KLF9腺病毒的扩增
转染后10~12 d,收取细胞,转入50 mL离心管。重悬于PBS中,在液氮和37 ℃反复冻融4次,收集病毒裂解液。第2轮扩增,加病毒裂解液到2个T-25瓶子(接种293A细胞,汇合度90%),细胞全部呈绿色且30%~50%细胞悬浮时,收集细胞,重悬于PBS中,在液氮和37 ℃反复冻融4次,收集病毒裂解液。第3轮扩增,加病毒于10个Φ100 mm大皿中(接种293A细胞,汇合度90%),其余步骤同第2轮扩增。
1.4 细胞培养及小鼠肝原代细胞处理
采用10%胎牛血清的DMEM培养基培养293A细胞,培养基中添加100 U/mL青霉素和0.1 mg/mL链霉素。细胞在37 ℃、5% CO2的孵箱中培养,实验时取对数生长期细胞。用经典的灌流胶原酶消化法获取成活率为90%以上的C57BL/6J小鼠肝脏原代细胞,铺至6孔板中,用1640(10%血清、100 U/mL青霉素和0.1 mg/mL链霉索)培养,在37 ℃、5% CO2的饱和湿度箱中培养。用浓度为1 mmol/L的H2O2处理C57BL/6J小鼠原代肝脏细胞,对照组加等量的PBS,在37 ℃、5% CO2的饱和湿度温箱中培养2 h,然后弃去培养基,用PBS清洗两次,换新鲜的完全培养基再培养2 h后去掉培养基,用1 mL Trizol提取RNA。向C57BL/6J小鼠原代肝脏细胞中加过表达KLF9的腺病毒及其对照Ad-GFP,6 h以后更换新鲜的培养基继续培养。24 h后荧光显微镜下观察绿色荧光蛋白完全表达,去掉培养基,用1 mL Trizol提取RNA。
1.5 总RNA提取和Real-time PCR
Trizol法提取小鼠原代肝脏细胞总RNA,紫外分光光度计定量,取2 μg总RNA,加入随机引物用Multi Scribe反转录酶反转录成cDNA。以1 μg cDNA为模板,在CFX-96仪器(BIO-RAD公司)上进行扩增反应。条件为:95 ℃ 10 min、95 ℃ 30 s、58 ℃ 30 s、72 ℃ 30 s(捕捉荧光值),循环40次,并作熔解曲线。各基因的定量PCR引物序列见表1。样本结果以目的基因与β-actin的比值做相对定量分析,数据分析采用比较CT法,重复样本(n=3)取平均值。

表1 实时定量PCR的引物序列
1.6 Western blot
蛋白样品以SDS-PAGE(分离胶浓度为10%)分离;电泳结束后将凝胶中的蛋白样品电转至PVDF膜上,电转1.5 h,封闭液室温封闭PVDF膜1.5 h;PVDF膜置于一抗(anti-Flag:1∶8 000)溶液中,4 ℃摇床过夜;TBST洗PVDF膜4次,每次10 min;PVDF膜与辣根过氧化物酶标记的二抗(用TBST配制的2.5% BSA以1∶5 000稀释)室温作用1~2 h;TBST洗PVDF膜4次,每次10 min;将ECL液体以0.1 mL/cm2膜的用量滴加在PVDF膜上,室温1 min。迅速吸去多余的ECL液体,用保鲜膜包好PVDF膜,暗室曝光。
1.7 统计学分析
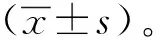
2 结果
2.1H2O2刺激小鼠的原代肝脏细胞KLF9及抗ROS基因的表达上调
与对照组相比,H2O2处理的C57BL/6J小鼠原代肝脏细胞中,KLF9以及抗ROS基因的表达水平均明显上调(Plt;0.05)(图1)。
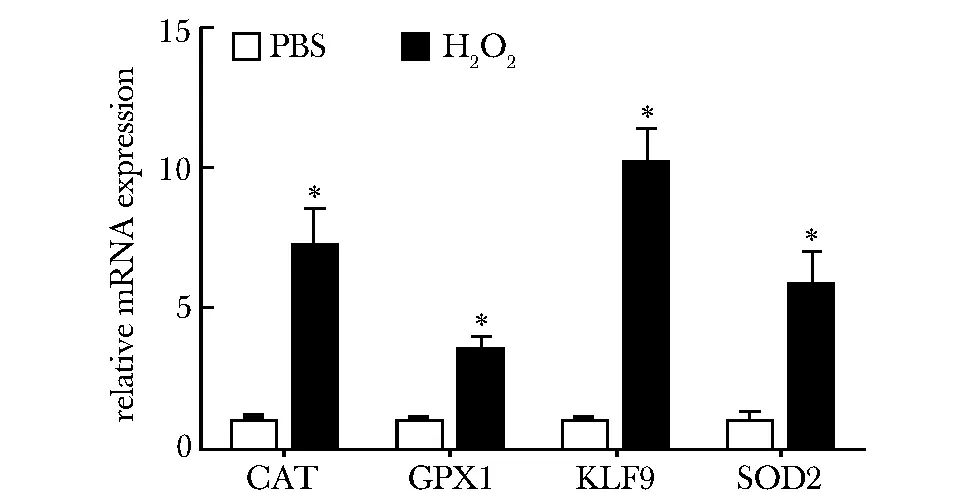
*Plt;0.05 compared with PBS group图1 H2O2刺激小鼠的原代肝脏细胞抗ROS基因表达上调Fig 1 The expression of anti-ROS genes was upregualted in mouse primary hepatocytes following H2O2 treatment
2.2KLF9基因过表达腺病毒的包装及原代肝细胞水平验证
PCR扩增约1 000 bp片段,连接T-easy载体,经过测序与NCBI上报导的序列一致。重组质粒,经PacⅠ酶切后,产生30.0 kb和4.5 kb左右的两条带。PacⅠ 线性化的质粒,转染293A细胞,约7~10 d 可见明显的扩增斑(图2A)。实时定量PCR检检测,与空白对照组及感染Ad-GFP组相比,感染Ad-KLF9腺病毒组原代肝细胞中KLF9的表达量上调约20倍(Plt;0.01)(图2B)。Western blot实验检测感染Ad-KLF9的原代肝脏细胞,在相对分子质量38 ku处有一条非常特异的条带,而感染Ad-GFP的对照组则没有条带(图2C)。
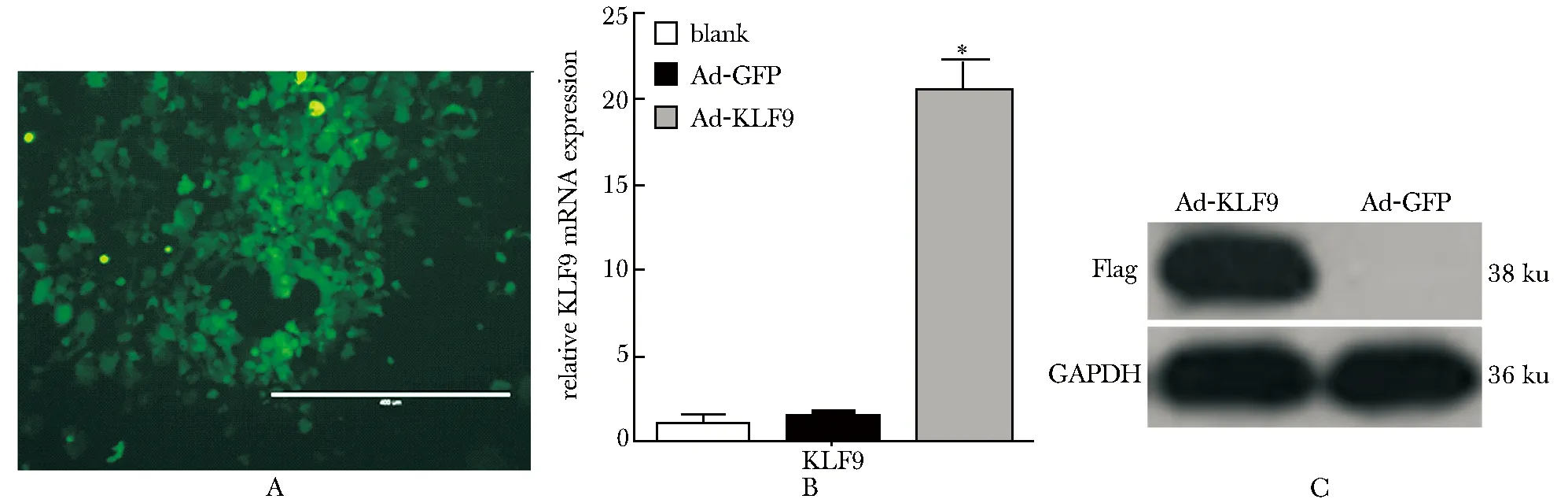
A.the viral multiplied plaque when transfeced into 293A cells 8 th day(×20);B.the expression ofKLF9 in mouse primary hepatocytes infected with Ad-GFP and Ad-KLF9(*Plt;0.01 compared with Ad-GFP and blank);C.the expression ofKLF9 in protein level when infected with Ad-GFP and Ad-KLF9
图2KLF9基因腺病毒载体的包装验证
Fig2TheidentificationofKLF9adenoviralvector
2.3KLF9激活小鼠原代肝脏细胞抗ROS基因的表达
与感染Ad-GFP对照组相比,过表达KLF9可以明显诱导CAT、SOD2、GPx1等抗ROS相关基因的表达上调(Plt;0.05)(图3)。
3 讨论
反应活性氧(ROS)能与DNA、蛋白质、脂类等反应,在许多生理和病理过程中发挥重要的作用,如糖尿病、神经退行性疾病、癌症、衰老等[7- 8]。细胞内ROS的清除途径主要是通过ROS去毒酶,包括谷胱甘肽过氧化物酶(GPxl)和超氧化物歧化酶(SODs)等[1]。
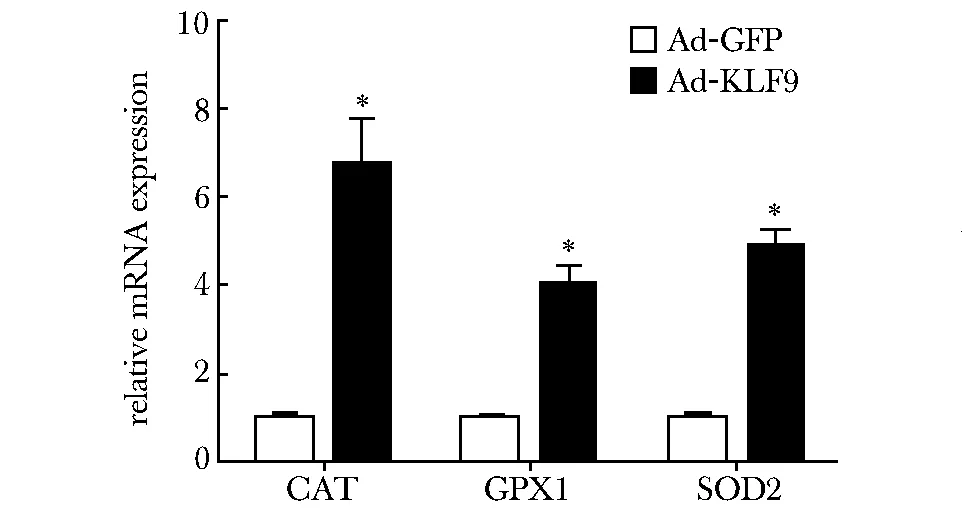
*Plt;0.05 compared with Ad-GFP图3 KLF9上调小鼠原代肝细胞抗ROS基因的表达Fig 3 The expression of anti-ROS genes in mouse primary hepatocytes infected with Ad-GFP and Ad-KLF9
研究表明有许多KLF家族成员包括KLF2、KLF5和KLF15参与脂代谢。例如敲低KLF4可以影响脂肪合成[9]。KLF5敲除小鼠的白色脂肪组织发育不良,而且过表达KLF5可以促进前脂肪细胞3T3-L1的分化。而KLF5又可以与C/EBPβ相互作用,从而促进PPARγ(peroxisome proliferator-activated receptor γ)基因的表达[10]。这些KLF家族在脂肪细胞中的作用提示KLF9很可能在能量代谢ROS清除中起作用。
本研究首先用H2O2刺激C57BL/6J小鼠的原代肝细胞,检测和抗ROS相关基因的表达,然后用过表达的腺病毒感染原代肝细胞。结果显示可通过增加细胞中清除ROS基因的表达而提高细胞的抗氧化应激能力,为其用于治疗与ROS有关的疾病奠定了理论基础。
腺病毒载体系统能够实现基因在哺乳动物和细胞中高效表达,该实验方法目前应用非常广泛。本研究包装成功的腺病毒感染肝原代细胞效率可以达到90%以上,为在细胞水平功能的研究提供了有力手段。而且腺病毒能够特异且高效地感染肝脏细胞,实现KLF9基因在肝脏中过表达,为KLF9可能的基因治疗提供了保证。
[1] Castegna A, Thongboonkerd V, Klein JB,etal. Proteomic identification of nitrated proteins in Alzheimer’s disease brain[J]. J Neurochem, 2003, 85:1394- 1401.
[2] Finkel T, Holbrook NJ. Oxidants, oxidative stress and the biology of ageing[J]. Nature,2000, 408:239- 247.
[3] Kikuchi Y, Sogawa K, Watanabe N,etal. Purification and characterization of the DNA-binding domain of BTEB, a GC box-binding transcription factor, expressed in Escherichia coli[J]. J Biochem, 1996, 119:309- 313.
[4] Sporl F, Korge S, Jurchott K,etal. Kruppel-like factor 9 is a circadian transcription factor in human epidermis that controls proliferation of keratinocytes[J]. Proc Natl Acad Sci U S A, 2012, 109:10903- 10908.
[5] Morita M, Kobayashi A, Yamashita T,etal. Functional analysis of basic transcription element binding protein by gene targeting technology[J]. Mol Cell Biol, 2003, 23:2489- 2500.
[6] Imataka H, Sogawa K, Yasumoto K,etal. Two regulatory proteins that bind to the basic transcription element (BTE), a GC box sequence in the promoter region of the rat P-4501A1 gene[J]. EMBO J, 1992, 11:3663- 3671.
[7] Lin J, Wu PH, Tarr PT,etal. Defects in adaptive energy metabolism with CNS-linked hyperactivity in PGC-1 alpha null mice[J]. Cell, 2004, 119:121- 135.
[8] Leone TC, Lehman JJ, Finck BN,etal. PGC-1alpha deficiency causes multi-system energy metabolic derangements: muscle dysfunction, abnormal weight control and hepatic steatosis[J]. PLoS Biol, 2005, 3:101- 116.
[9] Birsoy K, Chen Z, Friedman J. Transcriptional regulation of adipogenesis by KLF4[J]. Cell Metab, 2008, 7:339- 347.
[10] Oishi Y, Manabe I, Tobe K,etal. Kruppel-like transcription factor KLF5 is a key regulator of adipocyte differentiation[J]. Cell Metab, 2005, 1:27- 39.
KLF9 adenoviral vector construction and it’s function in anti-ROS
JIAO Tao, CUI An-fang, CHANG Yong-sheng*
(State Key Laboratory of Medical Molecular Biology,Institute of Basic Medical Sciences,CAMS,Beijing 100005,China)
ObjectiveTo construct the adenoviral overexpressing vector of Krüppel-like factor 9(KLF9) and to explore the role ofKLF9 in the regulation of anti-ROSgenes expression.MethodsTheKLF9 gene is cloned into the shuttle vector pAdTrack-CMV. The resultant plasmid is linearized by digesting with restriction endonucleasePmeⅠ, and subsequently cotransformed intoE.coli. BJ5183 competent cells with pAdEasy-1.Recombinants are selected for kanamycin resistance and recombination confirmed by restriction endonuclease analyses. Finally, the linearized recombinant plasmid is transfected into 293A cells. Recombinant adenoviruses are typically generated within 7 to 12 days. The mouse primary hepatocytes are isolated from the C57BL/6J mouse and subsequently H2O2treatment is conducted. We aslo performedKLF9 overexpression by using Ad-virus system (Ad-KLF9) in mouse primary hepatocytes isolated from the C57BL/6J mouse. Quantitative real-time PCR (qRT-PCR) analysis was further performed to determine the expression of anti-ROSgenes including catalase(CAT), manganese superoxide dismutase(SOD2) and glutathione peroxidase 1(GPx1).ResultsThe expression ofKLF9 and anti-ROSgenes were upregualted in C57BL/6J mouse primary hepatocytes following H2O2treatment (Plt;0.05).The results of qRT-PCR
and Western blot proved that adenoviral vector ofKLF9was successfully produced with 90% infection efficiency. The expression of anti-ROSgenes were also upregualted in C57BL/6J mouse primary hepatocytes after infecting with Ad-KLF9(Plt;0.05).ConclusionsKLF9 represents its impact on the expression of anti-ROSgenes.
KLF9; adenovirus; ROS
2014- 03- 08
2014- 04- 11
国家自然科学基金(81170763)
*通信作者(correspondingauthor):changy@ibms.pumc.edu.cn
1001-6325(2014)06-0762-05
R 73
A

