肿瘤微环境中乳酸对巨噬细胞表型极化和功能的影响
刘 妍,陈 翀,曹峰琦,白丽鹏,罗云萍
(中国医学科学院 基础医学研究所 北京协和医学院 基础学院 免疫学系, 北京 100005)
研究论文
肿瘤微环境中乳酸对巨噬细胞表型极化和功能的影响
刘 妍,陈 翀,曹峰琦,白丽鹏,罗云萍*
(中国医学科学院 基础医学研究所 北京协和医学院 基础学院 免疫学系, 北京 100005)
目的研究肿瘤微环境中乳酸对巨噬细胞表型极化和功能的影响。方法在Balb/c小鼠乳腺处接种乳腺癌细胞4T1,研磨肿瘤组织后测其乳酸浓度。以不同浓度乳酸处理RAW264.7巨噬细胞,用流式细胞术、RT-PCR和Western blot检测M1、M2型巨噬细胞的标志分子和NFκB P50/P65。蛋白芯片检测RAW细胞分泌的细胞因子。流式细胞术检测RAW细胞吞噬功能和抗原递呈功能。结果小鼠乳腺癌组织的乳酸浓度高于正常乳腺组织(Plt;0.05)。15 mmol/L浓度的乳酸可显著上调RAW细胞M2型标志分子的表达(Plt;0.05),下调M1标志分子的表达(Plt;0.05),使RAW细胞分泌的M1型细胞因子明显减少(Plt;0.05),同时使磷酸化NFκB P65降低(Plt;0.05)。乳酸对RAW细胞的吞噬功能没有明显的影响,但减弱其抗原递呈功能(Plt;0.05)。结论在乳酸的作用下,RAW巨噬细胞表型向M2型转变,抗原递呈功能减弱,NFκB参与调控乳酸对巨噬细胞的作用。提示肿瘤微环境中的乳酸对抗肿瘤免疫有较大影响。
肿瘤微环境;乳腺癌; 乳酸; 巨噬细胞
肿瘤中的乳酸量与多种癌症如宫颈癌和头颈部癌症等的生存率成负相关,可作为恶性实体瘤的预后指标[1]。乳酸本身有内在炎性介导者的功能,它导致T细胞和巨噬细胞表达IL-17A增多,促进肿瘤微环境中的慢性炎性反应,并且和肿瘤的免疫逃逸、肿瘤发生和抗化疗等直接相关[2]。近期研究发现,细胞外的乳酸能够抑制单个核细胞向树突状细胞(dendritic cell, DC)的分化,并且阻碍DC释放抗肿瘤的细胞因子[3]。分离人外周血中的CD8+T细胞并将其制备成细胞毒性T细胞后用乳酸刺激,发现乳酸能够抑制细胞毒性T细胞(cytotoxic T cell,CTL)增殖和对靶细胞的杀伤作用[4]。因此,乳酸不仅仅是肿瘤细胞的代谢产物,在调控肿瘤微环境和抗肿瘤免疫中也发挥着重要作用。
肿瘤相关巨噬细胞(tumor associated macrophages, TAMs)是存在于肿瘤微环境中的替代激活型巨噬细胞[5],研究发现其具有促进肿瘤生长、转移、血管生成以及抑制抗肿瘤免疫的功能[6]。但是影响TAMs表型和功能的因素和机制还未解释清楚。因此,本实验拟探索乳酸对巨噬细胞表型和功能的影响,为进一步理解肿瘤微环境和抗肿瘤免疫提供线索。
1 材料与方法
1.1 动物与试剂
清洁级6~8周龄雌性Balb/c小鼠(22.8±0.2)g(中国医学科学院基础医学研究所动物中心,11400700021892)。4T1乳腺癌细胞系(AATC公司),RAW264.7巨噬细胞系(美国The Scripps Institute Ralph.A.Reisfeld教授惠赠)。细胞培养基RPMI1640、胎牛血清、胰蛋白酶、细胞培养用双抗(100×青霉素-链霉素溶液)和100×非必需氨基酸(NEAA)(Gibco公司)。乳酸(Sigma公司)。乳酸测量试剂盒(南京建成生物技术有限公司)。RNA提取试剂Trizol Reagent(Invitrogen公司)。cDNA反转录试剂盒(Promega公司)。PCR试剂盒、DNA 分子量标记和real-time PCR试剂盒(北京全式金公司)。小鼠细胞因子蛋白芯片(Ramp;D公司)。BSA-FITC(中科晨宇生物科技有限公司)。Anti-CD206-Fluor48(Biolegend公司)。流式细胞术用anti-MHC Ⅰ-PE和anti-MHC Ⅱ-PE抗体(eBioscience公司)。羊抗鼠或兔抗鼠CD206/Mrc1、Arg1、NOS2、NFκBp50/p65和β-actin抗体及辣根过氧化物酶标记二抗(Santa Cruz公司)。引物合成(上海生工生物工程股份有限公司)。
1.2 细胞培养
4T1细胞和RAW细胞均在含10%胎牛血清、1%双抗(青链霉素溶液)的RPMI1640培养基中培养。培养条件为37 ℃、5% CO2。4T1细胞用0.25%胰蛋白酶消化传代。RAW细胞用细胞刮刀刮下。
1.3 实验方法
1.3.1 动物实验:将1×106个4T1细胞注射进21只雌性小鼠(n=3)第4对乳腺,在接种后的不同时间点(分别是第5、10、15、20、25 和第30天)处死小鼠,取肿瘤组织后称量,按照质量(g)∶体积(mL)=1∶9的比例加入PBS进行匀浆,2 000r/min 离心,15 min,取上清,按照测量乳酸试剂盒的方法测其乳酸浓度。
1.3.2 PCR:将RAW细胞以1×106个/孔接种于6孔板中,隔夜换液,用不同浓度的乳酸处理细胞,24 h后按Trizol法提取细胞总RNA,测定RNA浓度,并稀释至工作液浓度,按照反转录试剂盒说明书进行反转录,合成cDNA。RT-PCR反应根据试剂盒说明书进行扩增,琼脂糖凝胶电泳鉴定。Real-time PCR根据试剂盒说明书进行。RT-PCR引物序列:NFκB P50正向:5′-GCCAAAGAAGGACACGAC-3′,反向5′-ATCAC CCTCCAGAAGCAG-3′;NFκB P65正向:5′-CTGATG GAGTACCCTGAAGC-3′,反向:5′-TCCGCAATGGAG GAGAAG-3′。Real-time PCR引物序列:CD206正向:5′-GCAAGTGATTTGGAGGCT-3′,反向:5′-ATAGGAA ACGGGAGAACC-3′;Arg1正向:5′-GCAAGACAGCA GAGGAGGTG-3′,反向:5′-GCAGTCAGTCCCTGGCTT AT-3′;NOS2正向:5′-GAGCGAGTTGTGGATTGTC-3,反向:5′-CCAGGAAGTAGGTGAGGG-3′。
1.3.3 Western blot:将RAW细胞以1×106个/孔接种于6孔板中,乳酸处理24 h后提取细胞总蛋白,行SDS-PAGE,转膜。3%牛血清白蛋白封闭1 h。一抗1∶500(CD206、Arg1或NOS2)或1∶1 000(β-actin)稀释,4 ℃摇床过夜。TBST洗膜10 min,3次。二抗1∶5 000稀释,室温孵育1 h,TBST洗膜同前。加入化学发光液,5 min后暗室显影。
1.3.4 流式细胞术:用细胞刮刀将RAW细胞刮下,PBS洗1遍后计数,取5×105个细胞,用100 μL含0.5 μL荧光标记抗体anti-CD206-Fluor488的染色缓冲液重悬,室温暗处染色20 min,加入500 μL PBS洗两遍, 400×g离心, 4 min。200 μL PBS重悬后行流式细胞仪分析计数(Merck Millipore公司)。
1.3.5 蛋白芯片:按照说明,将芯片用封闭液封闭1 h,同时孵育样品和抗体混合物1 h。将孵育好的样品加入芯片上,4 ℃摇床过夜。用洗膜缓冲液洗芯片10 min,洗3遍。加入辣根过氧化酶标记的二抗,室温摇床30 min后洗3次,加入发光底物后显影。
1.3.6 吞噬实验:6孔板中的RAW细胞培养24 h后,加入γ-干扰素和LPS作用4 h,然后加入FITC标记的BSA,每孔5 μL,分为37 ℃和4 ℃两组,4 ℃作为对照组。3 h后取出细胞, 400×g离心,4 min,用500 μL PBS洗两遍,200 μL PBS重悬行流式细胞仪分析计数。
1.4 统计学分析
2 结果
2.1 小鼠乳腺肿瘤组织的乳酸浓度升高
Balb/C小鼠正常乳腺组织乳酸浓度为(9.2±1.3)μmol/g,接种4T1乳腺癌细胞后第5天肿瘤组织乳酸浓度升至(25.4±3.7)μmol/g(Plt;0.01),第25天升至(32.9±1.8)μmol/g(Plt;0.01)。
2.2乳酸上调RAW细胞M2型巨噬细胞标志分子的表达
15 mmol/L乳酸处理RAW细胞 24 h后,如图1A、1B和1D所示, M2型巨噬细胞标志分子甘露糖受体CD206和精氨酸酶Arg1升高, M1型巨噬细胞标志分子一氧化氮合酶(NOS2)降低。RAW细胞CD206阳性群体增多(图1C)(Plt;0.05)。

A.RT-PCR;B.Western blot; C.FACS;D.real-time PCR;*Plt;0.05 compared with untreated control(NC)图1 15 mmol/L乳酸上调RAW细胞的M2 标志分子CD206和Arg1,下调M1标志分子 NOS2
2.3乳酸减少RAW细胞分泌的M1型巨噬细胞细胞因子
细胞因子蛋白芯片结果(图2A和2B)显示,15 mmol/L乳酸处理RAW细胞24 h后,细胞培养上清中的细胞因子谱发生改变,M1型细胞因子TNF-α、IFN-γ和IL-1α减少,趋化因子如CCL2、CCL5等也减少(Plt;0.05)。
2.4乳酸对RAW细胞吞噬功能没有影响但降低其抗原递呈功能
15 mmol/L乳酸处理24 h后,用流式细胞术检测RAW细胞吞噬功能(图3A)和抗原递呈功能的影响(图3B)。吞噬功能无明显变化,MHC Ⅰ、MHC Ⅱ分子和协同刺激分子CD80表达减少(Plt;0.05)。
2.5 NFκB参与乳酸对RAW细胞的调控
15 mmol/L乳酸处理后,RAW细胞NFκB P50蛋白水平(图4A)和RNA水平(图4B)都有升高(Plt;0.05)。NFκB P65蛋白表达水平升高(Plt;0.05),其磷酸化水平降低(Plt;0.05)(图4A)。
3 讨论
乳酸作为肿瘤细胞有氧糖酵解的产物,其大量堆积是肿瘤微环境的重要特点[7]。在本研究中,对小鼠接种乳腺癌细胞系后测量其肿瘤组织内乳酸浓度,发现肿瘤组织的乳酸浓度明显高于正常乳腺组织,在体内说明乳酸大量存在于肿瘤组织中。
巨噬细胞的激活状态分为两种类型。Th1型细胞因子或病原体使巨噬细胞转化为M1型,表现为高表达MHC Ⅱ,产生大量TNFα、IL12和NO,可杀死病原体和靶细胞。Th2型细胞因子使巨噬细胞M2型激活,表现为CD206和Arg1表达增高,具有促进血管新生和组织修复等功能[8]。肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)大多为M2型,TAMs的基因表达谱分析表明其确实向M2型偏移[9],并促进肿瘤转移和血管新生[10]。本实验中乳酸处理后RAW细胞的CD206、Arg1等M2型巨噬细胞标志分子升高,M1型标志分子 NOS2降低。细胞因子蛋白芯片结果表明,乳酸处理后RAW细胞表达的M1型细胞因子TNFα、IL1、γ-IFN等明显减少。说明乳酸对巨噬细胞向M2型极化具有促进作用,同时抑制M1型细胞因子分泌。
抗原递呈是引发机体适应性免疫的一个重要步骤。乳酸降低RAW细胞MHCI和MHCⅡ分子的表达,说明乳酸削弱了巨噬细胞的抗原递呈能力,这反映了乳酸的存在不利于抗肿瘤免疫的发生和扩大,同时也是肿瘤细胞免疫逃逸的一个重要因素。另研究表明MHC ⅡlowTAMs能够促进小鼠肿瘤的进展,抑制T细胞激活,分泌免疫抑制性因子[11]。
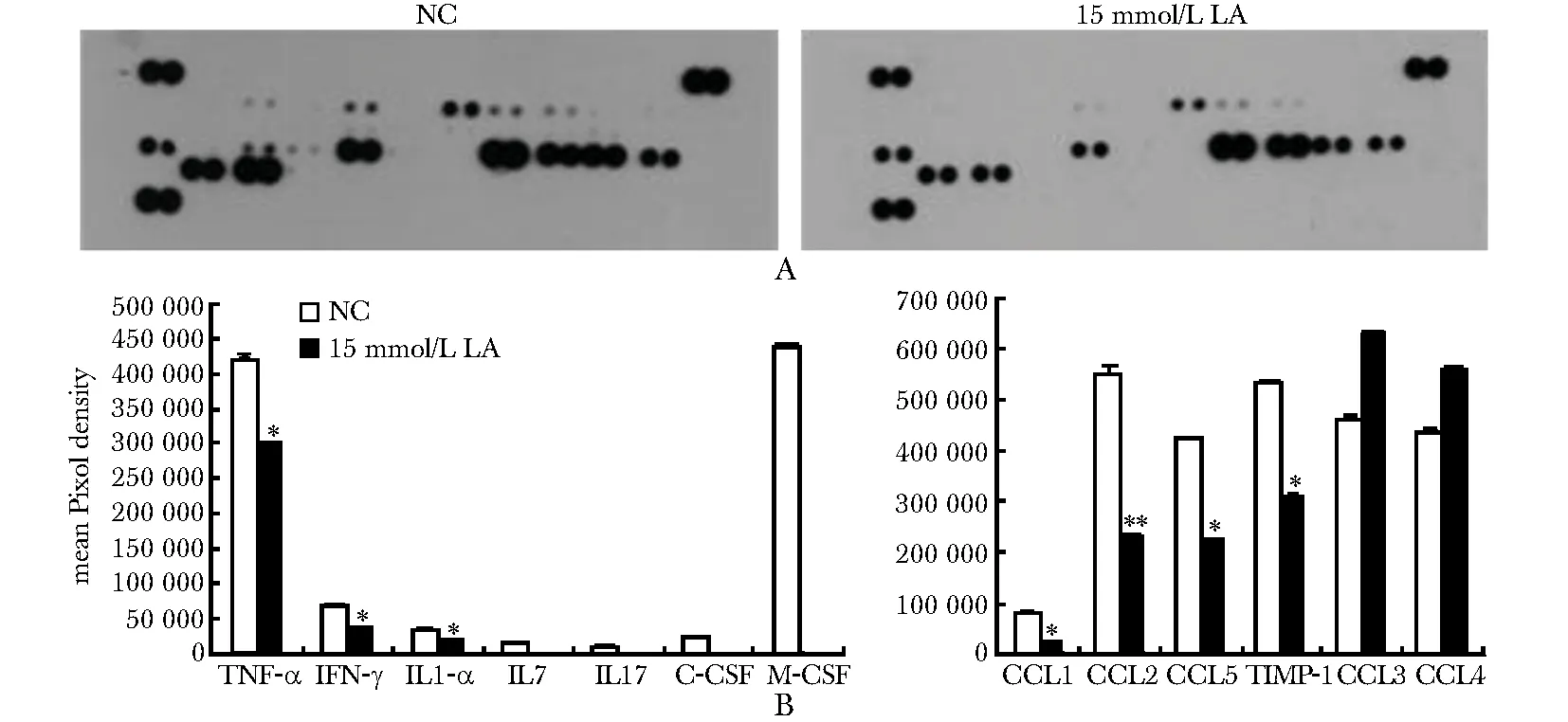
A.cytokine array scanning image;B.mean Pixel density assay; *Plt;0.05,**Plt;0.01 compared with untreated control(NC)
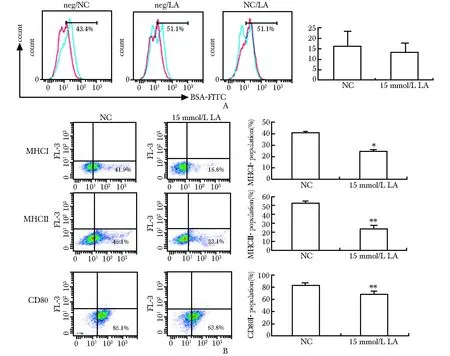
A.FACS;B.FACS; *Plt;0.05, **Plt;0.01 compared with untreated control(NC)图3 乳酸对RAW细胞吞噬功能没有影响但是减弱其抗原递呈功能Fig 3 Lactic acid had no effect on phagocytosis but decreased antigen presenting function of RAW cells
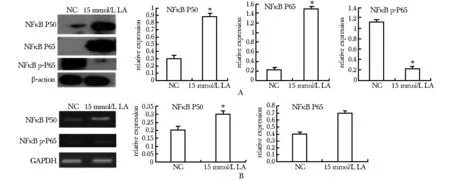
A.Western blot;B.RT-PCR; *Plt;0.05 compared with untreated control(NC)图4 NFκB参与乳酸对RAW细胞的调控Fig 4 NFκB contributed to lactic acid regulation of RAW cells
本研究发现乳酸处理后,RAW细胞的NFκB P65磷酸化水平降低,说明NFκB活性降低参与调控乳酸促进RAW细胞向M2型转化的作用,但具体机制还有待进一步研究。
总之,本研究表明小鼠乳腺癌组织中的乳酸浓度升高,乳酸使RAW细胞表现为M2型,M1型细胞因子分泌减少,抗原递呈功能减弱,NFκB在这个过程中发挥一定作用,具体机制有待研究。
[1] Ziebart T, Walenta S, Kunkel M,etal.Metabolic and proteomic differentials in head and neck squamous cell carcinomas and normal gingival tissue[J]. J Cancer Res Clin Oncol,2011,137:193- 199.
[2] Yabu M, Shime H, Hara H,etal. IL-23-dependent and-independent enhancement pathways of IL-17A pro-duction by lactic acid[J]. Int Immunol,2011,23:29- 41.
[3] Michalek RD, Gerriets VA, Jacobs SR,etal. Cutting edge: distinct glycolytic and lipid oxidative metabolic programs are essential for effector and regulatory CD4+T cell subsets[J]. J Immunol,2011,186:3299- 3303.
[4] Fischer K, Hoffmann P, Voelkl S,etal. Inhibitory effect of tumor cell derived lactic acid on human T cells[J].Blood,2007,109:3812- 3819.
[5] Mantovani A, Sozzani S, Locati M,etal.Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes[J].Trends Immunol,2002,23:549- 555.
[6] Lewis CE, Pollard JW.Distinct role of macrophages in different tumor microenvironments[J].Cancer Res,2006,66:605- 612.
[7] Hirschhaeuser F, Sattler UG, Mueller-Klieser W.Lactate: a metabolic key player in cancer[J].Cancer Res,2011,71:6921- 6925.
[8] Gordon S. Alternative activation of macrophages[J]. Nat Rev Immunol,2003, 3:23- 35.
[9] Pucci F, Venneri MA, Biziato D,etal. A distinguishing gene signature shared by tumor-infiltrating Tie2-expressing monocytes, blood “resident” monocytes, and embryonic macrophages suggests common functions and developmental relationships[J]. Blood,2009, 114: 901- 914.
[10] Pollard JW. Tumor-educated macrophages promote tumor progression and metastasis[J]. Nat Rev Cancer,2004,4:71- 78.
[11] Wang B, Li Q, Qin L,etal. Transition of tumor-associated macrophages from MHC class Ⅱhito MHC class Ⅱlowmediates tumor progression in mice[J].BMC Immunol,2011,12:43- 57.
Lactic acid regulates phenotypepolarization and function of macrophages in tumor microenvironment
LIU Yan, CHEN Chong, CAO Feng-qi, BAI Li-peng, LUO Yun-ping*
(Dept. of Immunology,Institute of Basic Sciences,CAMS,School of Basic Medicine,Peking Union Medical College, Beijing 100005, China)
ObjectiveTo investigate that lactic acid regulates polarization of phenotype and function of macrophages in tumor microenvironment.MethodsBalb/c mice were inoculated by 4T1 breast tumor cells with the mammary gland injection.The tumor tissues were harvested at different time points and detected the lactic acid concentration. The expression of M1 and M2 markers in RAW264.7 cells treated with different concentration of lactic acid were detected by RT-PCR,FACS and Western blot. The mouse cytokine array chip was used to evaluate the release of cytokines from RAW cells treated with 15 mmol/L lactic acid. Phagocytosis and antigen presenting function was evaluated by using FACS.Resultslactic acid concentration of mouse breast tumor was higher than that of normal breast tissue(Plt;0.05). M2 markers of RAW cells were up-regulated and M1 markers were down-regulated by 15 mmol/L lactic acid(Plt;0.05).M1 cytokines secretion of RAW cells treated with 15mmol/L lactic acid was down-regulated(Plt;0.05). Phosphorylated NFκB P65 was down-regulated by 15mmol/L lactic acid(Plt;0.05).The phagocytosis was not affected by lactic acid, but the expression of the antigen presenting and co-stimulatory molecules were down-regulated in RAW cells treated with 15 mmol/L lactic acid(Plt;0.05).Conclusionslactic acid induces the M2 phenotype shift and inhibits the antigen presenting function of RAW cells. NFκB P50/P65 are involved in the phenotype polarization of macrophages.This study suggested that lactic acid plays an indispensable role in macrophages polarization in tumor microenvironment.
tumor microenvironment; breast tumor; lactic acid; macrophages
2014- 02- 17
2014- 04- 12
国家重点基础研究发展计划(2013CB967202)
*通信作者(correspondingauthor):Yunpingluo@hotmail.com
1001-6325(2014)06-0740-06
R 392.1
A

