术中引流在乳腺多发良性肿块麦默通微创旋切术中的应用
金科 章远江 许健
乳房良性疾病(benign breast disorders,BBD)是妇女的常见表现,其中又以乳腺良性肿瘤较为常见,这类疾病一定程度困扰着相当大一部分女性。围绕着是否具有潜在恶变倾向而纠结于是否需要外科干预,对乳腺肿瘤的诊断和治疗原则上是手术活检及切除,而传统手术方法会造成乳房外形受损,留下明显的瘢痕,部分患者肿块较小,传统手术术中难以寻找,造成肿块残留,加重患者的心理负担,近年来微创技术已在这一领域开辟了新思路[1-2]。本研究对2011年6月-2014年3月入住本院的106例289处乳腺病灶行超声引导麦默通微创旋切术的临床资料进行回顾性分析,根据手术方法的不同分为术中引流组及非引流组,发现通过术中引流更能减少术后出血的概率,现报告如下。
1 资料与方法
1.1 一般资料 选取2011年6月-2014年3月入住本院的106例术后经病理检查均确诊为良性病变的患者,根据手术细节的不同分成术中引流组54例患者及非引流组52例患者,手术均选择在非月经期进行,凝血功能均正常。患者均为女性,年龄17~48岁,中位年龄34岁。乳腺病灶均为多发共289处,其中单侧多发65例,双侧多发41例;临床可触及肿块208处,触诊阴性肿块81处;肿块直径8~28 mm,平均16.5 mm。两组患者的基本资料比较差异无统计学意义(P>0.05),具有可比性。见表1。
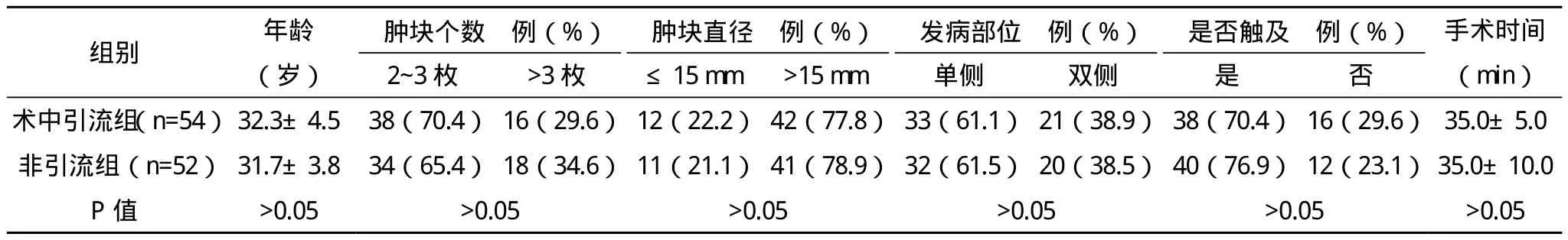
表1 两组患者的基本资料比较
1.2 方法
1.2.1 仪器 美国强生公司生产的麦默通微创旋切系统:SCM23K型;麦默通EX手柄;HH8BEX 8G穿刺旋切针刀头,刀槽长度24 mm。深圳迈瑞生物医疗电子股份有限公司生产的Mindray全数字便携式超声诊断系统DP-6600。
1.2.2 方法 术中引流组:根据需要在仰卧位基础上取45°侧卧,患侧在上,充分暴露术区。术前再次行超声检查明确肿块的位置、大小及血流特征,确定穿刺点及穿刺路径并在皮肤上作适当标记。术区常规消毒铺巾,按固定比例配置好局麻药物,2%利多卡因20 mL+肾上腺素0.5 mg+0.9%氯化钠注射液20 mL[3]。超声引导下于穿刺点、预穿刺针道、环肿块周围及乳腺后间隙予局部浸润麻醉。进针点皮肤做3 mm切口,沿预定针道在超声引导下将穿刺刀从皮肤切口准确置于乳腺肿块下方,超声核实穿刺针刀槽向上对准肿瘤后开始旋切,直至在超声下肿块被完全切除。吸尽积血,撤针后再次超声多方位、多角度检查,确保无肿块残留。针道内置皮片行暂时引流切口不作缝合,无菌辅料覆盖后助手加压按压,用同样方法处理下一个肿块。待所有肿块切除完毕,局部加压压迫15 min,再次确认无明显活动性出血后,拔除皮片,免缝胶逐个粘贴切口,弹力绷带加压包扎48 h,嘱患者术后两周内避免双上肢的剧烈活动。标本按肿块个数逐个送常规病理切片检查。非引流组:手术方式与术中引流组大体相同,区别仅在术中未在手术残腔及穿刺针道放置皮片作临时引流。
1.3 术后出血定义 术后一周内B超示有单个创腔积液>10 mL并伴有肿痛及可触及肿块等症状者定义为术后出血[4]。
1.4 统计学处理 采用SPSS 19.0统计软件进行数据处理,计量资料以(x-±s)表示,比较采用t检验,计数资料采用x2检验,以P<0.05为差异具有统计学意义。
2 结果
106例289处乳腺病灶均完整切除,术后病理结果均为良性,其中纤维腺瘤245处,乳腺病31处,导管内乳头状瘤13处。5例发生术后手术残腔内血肿(均出现在非引流组),未做特殊处理,于术后2~3个月吸收缓解。所有患者均于术后3~6个月予超声复查未见肿块残留,所有病例均未出现术后感染,手术瘢痕不明显,手术成功率100%。与非引流组相比,术中引流可明显降低术后血肿的发生率,其差异具有统计学意义(P<0.05)。两组手术时间比较差异无统计学意义。
3 讨论
美国强生公司于1994年推出麦默通(Mammotome)微创旋切系统,初期只用于乳腺可疑病灶的定位活检[4],随着这一技术的成熟应用,后被FDA批准用于乳腺肿块的切除手术。如今,麦默通更是逐渐发展成为一种治疗手段[5],广泛的用于乳房良性肿块的微创切除,超声引导麦默通微创旋切术更是具有实时显像、动态观察、操作灵活、定位简便准确的优点,对于乳腺内的小病灶既不会遗漏,又不会造成过大创伤,特别对于<15 mm的良性病灶,逐渐体现出可替代传统外科手术的优势[6],更能轻松应对传统外科手术处理困难的乳腺内多发病灶。但麦默通也存在一定的局限性,因为操作过程中不能在直视下进行止血,设备本身也不具备止血的功能,因此术中及术后的出血便成了麦默通技术的主要并发症之一,国外甚至有术中出现不可控制出血而采取血管栓塞止血的报道[7-8]。尽管如此,医生仍可通过严格筛选患者,术中细致操作,术后加强护理来使并发症降至最低,让其安全、准确、微创的优势发挥至最大。
3.1 受局限于麦默通穿刺针刀槽长度为24 mm,在切除大于30 mm病灶时常需反复变换穿刺针位置与方向对肿块分割切除,手术时间明显延长,创伤增大,出血增多,张屹辉等[9]报道切除单个肿块的最长时间为45 min。而形态不规则、包膜不明显或多个肿块融合的病灶会给术中超声判断造成困难最终导致术后残留。笔者建议对于小于30 mm、形态规则、包膜完整的肿块比较适合麦默通微创旋切术,而对于乳房体积大、肿块位置深等临床触诊阴性病灶,只要超声显示满意,更应首选麦默通治疗[10]。在年轻女性中,对外观要求高者,麦默通的应用也为其提供了更好的选择。对于多发肿块,只要手术过程顺利,多个病灶的连续切除也是安全可靠的[11]。
3.2 手术操作前常规行超声检查,对肿块的数目、大小、部位、深浅加以确认,在体表做好标记,对肿块附近血流信号进行评估,以便穿刺时避开大血管减少出血可能。穿刺点在兼顾多个肿块部位的同时还要遵循就近及美观的原则,这样既能保证对所有肿块的切除,又能使操作对乳腺腺体的损伤减少到最低程度,从另一方面减少出血等并发症的发生概率。
3.3 满意的麻醉可减轻患者痛苦,并能有效的减少术中出血。笔者用2%利多卡因400 mg+0.9%氯化钠注射液20 mL+肾上腺素0.5 mg配成局麻药,分别注射于穿刺点、穿刺针道、肿块表面皮下组织、乳腺后间隙,有收缩注射部位小血管,减少局部出血并延长麻醉效果的作用,如此既能保证操作过程肿块显影清晰,又能很大程度减少术中出血。
3.4 对于多发病灶原则上先从小的,B超显示困难的或者手术时间短的开始切除,反之会因组织移位、出血影响导致肿块残留。穿刺时要注意进针角度,避免针与胸壁垂直,以免误人胸腔,尽量将穿刺针置于紧贴肿块的下方,术中始终保持肿块位于取样槽正上方,采用十字交叉法完整切除肿块[12]。在进行下一个肿块旋切之前,一定要确保上一个旋切创面有助手尽可能加压一定的时间,往往可以避免血肿的形成[13-14],笔者采用术中旋切残腔放置皮片引流的方法,使缝合前残腔内的出血量减到最少,有效的降低了术后出血的发生率。
3.5 术后还需局部压迫15 min,观察穿刺口无渗血,B超显示创腔无明显液体积存后可粘贴穿刺口,弹力绷带加压包扎48 h,嘱患者术后2周内避免双上肢的剧烈活动。闺存礼等[15]建议术后在创区用纱布团持续压于病灶创缘缺损处可有效控制术后血肿发生。笔者认为用平软的厚棉垫压迫包扎同样可达到压迫止血的效果,且不会引起患者的不适,适量的创腔内积血反而有利于日后乳房缺损处的塑性。
麦默通技术自推出20年来,经过广大临床工作者的不懈努力,已进入了越来越多乳腺疾病的领域,笔者坚信,每一个环节、细节的不断改进都会使其并发症的发生得到更有效的控制,真正能使乳腺疾病患者接受安全、准确、有效的治疗。同时,医生们也要严格把握适应证,决不能一味地为追求美观而滥用这项技术。
[1]Hartman L C,Sellers T A,Frost M H,et al.Benign breast diseast disease and the risk of breast cancer[J].N Engl J Med,2005,353(3):229-237.
[2]Santen R J,Mansel R.Benign breast disorders[J].N Engl J Med,2005,353(3):275-285.
[3]陈广秀,黄春丽,张菊梅.超声引导下麦默通微创乳腺肿块切除手术配合[J].中国实用医药,2009,4(18):73-74.
[4]雷蕾,徐久东,冯国斌,等.麦默通乳腺微创手术术中、术后出血的原因分析及防治[J].西南军医,2012,14(5):702-704.
[5]Burbank F,Parker S H,Fogarty T J.Stereotactic breast biopsy:improved tissue harvesting with the Mammotome [J].The American Surgeon,1996,62(9):738.
[6]Iwuagwu OC,Calvey TA,Ilsley D,et al.Ultrasound guided minimally invasive breast surgery:a superior technique for gynecomastic[J].Ann Plast Surg,2004,52(2):131-133.
[7]Kumaroswamy V,Liston J,Shaaban AM,et al.Vacuum assisted stereotactic guided mammotome biopsies in the management of screen detected microcalcifications:experience of a large breast screening centre[J].J Clin Pathol,2008,61(6):766-769.
[8]Fischman AM,Epelboym Y,Siegelbaum RH,et al.Emergent embolization of arterial bleeding after vacuum-assisted breast biopsy[J].Cardiovas and Intervent Radio,2012,35(1):194-197.
[9]张屹辉,于霞,祝海颖,等.超声引导下麦默通微创切除乳腺良性肿块626例分析[J].中国介入影像及治疗学,2008,5(4):284-285.
[10]吕晶,张青松,陈征.麦默通微创旋切活检系统在乳腺触诊阴性病变诊断治疗中的应用[J].中国肿瘤临床,2008,35(4):196-197,205.
[11]蒋国勤,邢春根,方军初,等.多发性乳房肿块麦默通微创切除术35例分析[J].中国现代医药杂志,2005,7(5):8-10.
[12]李宏江.超声引导下麦默通乳腺微创手术治疗规范[J].中国普外基础与临床杂志,2012,19(9):926-929.
[13]Carder P J,Khan T,Burrows P,et al.Large volume “mammotome”biopsy may reduce the need for diagnostic surgery in papillary lesions of the breast[J].J Clin Patho,2008,61(8):928-933.
[14]Maxwell A J.Ultrasound-guided vacuum-assisted excision of breast papillomas:review of 6-years experience[J].Clin Radiol,2009,64(8):801-806.
[15]闺存礼,侯林都.乳腺肿块麦默通微创旋切术后出血防治的体会[J].吉林医学,2014,35(10):2185-2186.

