肤光方及其加减方体外抗金黄色葡萄球菌活性研究
卢芳,钱思宇,李敏,张钟,刘毅,刁庆春
(重庆市第一人民医院,重庆400011)
肤光方为我院院内制剂,临床应用治疗皮炎湿疹20余年,疗效确切。为了深入探讨其作用机制同时为临床应用提供一定的理论基础,本实验通过纸片扩散法、打孔法和琼脂稀释法观察肤光方及其加减方共6种方剂的水煎液对金黄色葡萄球菌(金葡菌)甲氧西林敏感株和耐药株的抑菌作用,同时测定各组方对两型金葡菌最低抑菌浓度。
1 资料与方法
1.1 材料与试剂 金葡菌标准菌株ATCC25923为甲氧西林敏感株,购自中国普通微生物菌种保藏管理中心。金葡菌甲氧西林耐药株从重庆市第一人民医院皮肤科患者标本中经分离、鉴定而获得。接种培养在普通琼脂平板上。肤光方由野菊花、蒲公英、白鲜皮、苦参、地肤子、蛇床子等组成,清热解毒方由野菊花、蒲公英等组成,清热解毒燥湿方由野菊花、蒲公英、白鲜皮、苦参等组成,收敛解毒方由野菊花、蒲公英、儿茶(3%浓度)等组成,清热燥湿方由白鲜皮、苦参等组成,祛风止痒方由地肤子、蛇床子等组成。其中收敛解毒方为肤光方加方,其余均为其减方。Mueller-Hinton琼脂(MH琼脂)购自北京奥博星生物技术有限公司。
1.2 方法
1.2.1 药液制备 按处方比例称取除冰片外的上述药材,加水浸泡30 min后,分别加水10倍量、8倍量、8倍量煎煮3次,1 h/次,滤过,合并3次滤液,浓缩至所需浓度,相应分量的冰片细粉经过100目筛子筛选,加入浓缩药剂中,即得。
1.2.2 纸片扩散法(K-B法)观察各组方的抑菌活性 用打孔器将定性滤纸制作成直径6 mm左右的圆形纸片,高压灭菌后加入相应量的药物制备成含药量纸片。将孵育16~24 h的数个菌落置于生理盐水试管中,校正浓度至0.5麦氏标准(相当于1.0×108CFU/mL)。用无菌棉签蘸取菌液,在试管内壁旋转挤去多余菌液后在MH琼脂平板表面均匀涂布接种3次,每次旋转平板60°,最后沿平板内缘涂抹1周。平板在室温下干燥3~5 min后用无菌镊子将药物纸片紧贴于琼脂表面,置35℃孵育16~18 h。记录抑菌圈的直径,实验重复10次。设置8个组:含药量均为10 mg的肤光方组、清热解毒方组、清热解毒燥湿方组、清热解毒燥湿方组、收敛解毒方组、祛风止痒方组为实验组;生理盐水(NS)组为阴性对照组,10 U的青霉素(PEN)和30 μg的万古霉素(VAN)分别作为甲氧西林敏感株和耐药株的阳性对照组。如上述方法制作菌液,并接种在MH琼脂平板表面待干后,用直径6 mm无菌金属打孔器在平皿内打孔,除去洞内琼脂,用微量移液器吸取50 μL各组方水煎液加入洞内,37℃培养16~18h,记录抑菌圈的直径,实验重复10次[1]。抑菌圈直径小于10 mm表示无抑菌作用。设置6个组:浓度为1×103g/L的肤光方组、清热解毒方组、清热解毒燥湿方组、清热解毒燥湿方组、收敛解毒方组为实验组;生理盐水(NS)组为阴性对照组。
1.2.4 琼脂稀释法测定各组方对金葡菌的最小抑菌浓度(MIC值) 将各浓度受试药液2 mL加入无菌平皿内,再加入MH琼脂培养基18 mL摇匀,使培养基内各组方组终浓度分别为100,50,25,12.5,6.25,3.125,1.562 5 g/L;待凝固后,用接种环取 2 μL菌液分别在以上平板上划线种入实验菌液,置35℃恒温箱中培养16~20 h,观察结果,以培养皿中无细菌生长者为受试中药的最低抑菌浓度。
2 结果
2.1 纸片法观察各组方对金葡菌甲氧西林敏感株ATCC25923和MRSA株的抑制作用 和NS组相比,肤光方、祛风止痒方、收敛解毒方、清热解毒燥湿方对金葡菌耐药株和敏感株均具有一定的抑菌活性,其中肤光方的抑菌作用最强。肤光方表现出来显著的抑制金葡菌耐药株和敏感株生长的活性,尤其是对耐药株,肤光方表现出高于青霉素3倍的抑制作用,稍弱于万古霉素。对金葡菌敏感株,清热解毒方、清热燥湿方均无显著的抑制作用。对金葡菌耐药株,清热解毒方具有一定的抑制作用,而清热燥湿方的抑制作用不具有统计学意义。另外,对ATCC 25923(P=1.000)和 MRSA 菌株(P=1.000),收敛解毒方和清热解毒燥湿方之间抑菌活性差异亦无统计学意义。见表1。
表1 纸片法各组方对金葡菌ATCC 25923和MRSA株的抑菌圈直径 (±s)

表1 纸片法各组方对金葡菌ATCC 25923和MRSA株的抑菌圈直径 (±s)
注:P为各组与生理盐水组(NS)之间两两比较的P值。检验水准α=0.05,P<0.05为差异有统计学意义。
组别 ATCC 25 923(mm) MRSA(mm)±s P ±s P肤光方 16.99±1.05 0.000 18.92±1.10 0.000清热解毒方 6.20±0.20 0.916 11.22±1.30 0.000收敛解毒方 9.02±0.54 0.000 13.59±1.02 0.000清热燥湿方 6.08±0.65 1.000 6.02±0.04 1.000祛风止痒方 10.16±0.56 0.000 16.24±0.96 0.000清热解毒燥湿方 8.85±0.57 0.000 13.48±0.79 0.000 PEN 32.39±0.98 0.000 6.09±0.07 0.346 VAN 20.42±1.15 0.000 24.21±0.93 0.000 NS 6.06±0.48 6.02±0.05
2.2 打孔法验证各组方的抑菌作用 运用打孔法对各组方的抑菌活性进行验证后发现,各组方对ATCC 25923菌株和MRSA菌株均有一定的抑菌活性,和NS组相比差异有统计学意义。抑菌圈大小见表2。同纸片法结果相似,无论对ATCC 25923菌株(P=0.973)还是 MRSA 菌株(P=0.682),收敛解毒方和清热解毒燥湿方均具有较强的抑菌活性,且抑制作用大小相似,两者相比差异无统计学意义。
2.3 琼脂稀释法测各组方的MIC值 各组方对MRSA菌株均具有一定的抑菌活性,其中肤光方、祛风止痒方、清热解毒燥湿方活性最强,清热燥湿方活性最弱。清热燥湿方对ATCC 25923未表现出明显的抑菌活性,其余各组方对ATCC 25923均有抑菌作用。见表3。
表2 打孔法各组方对金葡菌ATCC 25923和MRSA株的抑菌圈直径 (±s)
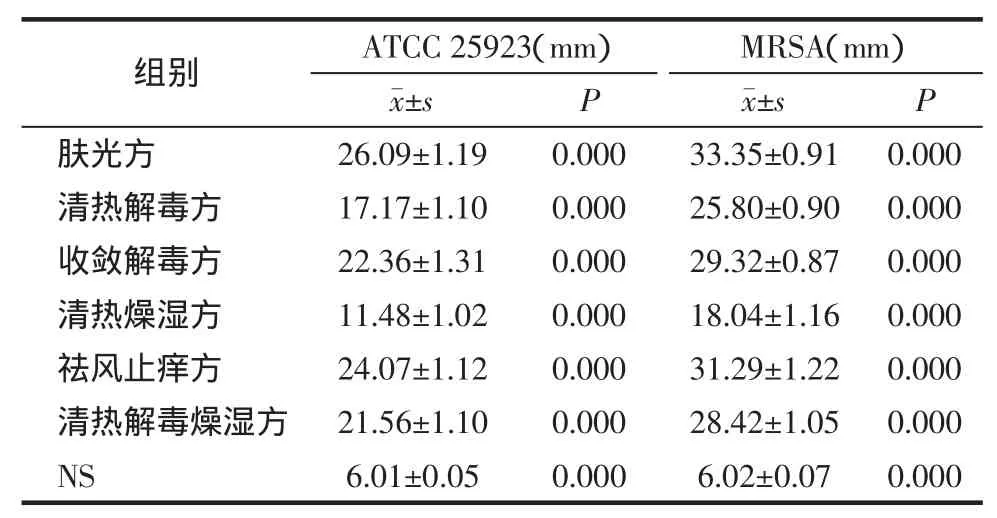
表2 打孔法各组方对金葡菌ATCC 25923和MRSA株的抑菌圈直径 (±s)
注:抑菌圈直径<10 mm为耐药,10~15 mm为中度敏感,15 mm以上为高度敏感。P为各组与生理盐水组(NS)之间两两比较的P值。检验水准α=0.05,P<0.05为差异有统计学意义。
组别 ATCC 25923(mm) MRSA(mm)±s P ±s P肤光方 26.09±1.19 0.000 33.35±0.91 0.000清热解毒方 17.17±1.10 0.000 25.80±0.90 0.000收敛解毒方 22.36±1.31 0.000 29.32±0.87 0.000清热燥湿方 11.48±1.02 0.000 18.04±1.16 0.000祛风止痒方 24.07±1.12 0.000 31.29±1.22 0.000清热解毒燥湿方 21.56±1.10 0.000 28.42±1.05 0.000 NS 6.01±0.05 0.000 6.02±0.07 0.000

表3 琼脂稀释法测各组方对金葡菌ATCC 25923和MRSA株的MIC值 (g/L)
3 讨论
湿疹是一种常见的由多种内外因素引起的表皮及真皮浅层炎症性皮肤病,发病原因复杂。研究发现,湿疹和特应性皮炎(Atopic dermatitis,AD)皮损处微生物感染因素尤其是金葡菌是这些疾病激发和加重的重要因素之一[2-3]。90%以上的AD患者皮损处可分离到金葡菌,而健康对照组仅为5%。AD患者急性渗出性皮损处的金葡菌定植密度达到107/cm,皮损严重程度越高,定植数量越多[4-5]。金葡菌可以通过分泌外毒素使特应性皮炎病情恶化。这些外毒素的作用类似于超抗原,这些超抗原可以渗透到皮肤真皮层[8],通过激活T淋巴细胞、抗原递呈细胞(Antigen presenting cell,APC)、巨噬细胞和角质形成细胞发挥作用[6]。一些特应性皮炎患者还会产生直接作用于金葡菌超抗原的特异性IgE抗体,这种抗体的产生在一定程度上和皮肤的严重程度密切相关[7]。在斑贴实验中,大剂量超抗原可以引起皮肤炎症[9]。低剂量超抗原虽然不能直接引起肉眼可见的炎症,但可以增强吸入性过敏原在点刺试验中的反应[10]。另外,超抗原可诱发T细胞上糖皮质激素β受体的基因表达,β受体主要由15个专有氨基酸组成,其活性与糖皮质激素α受体的活性恰恰相反,β受体不能直接和激素结合,但可作为激素激活的转录因子,下调激素敏感基因的表达,降低AD对激素的敏感性[11]。目前,针对金葡菌的抗生素局部治疗得到了广泛认可,早期运用抗菌药物可提高疗效。抗生素治疗不仅可以有效祛除AD中的细菌,减少超抗原的产生,还可以增加激素治疗的敏感性,减轻AD炎症反应,有效地控制病情[12-13]。
本实验观察到,肤光方及其加减方对金葡菌甲氧西林敏感菌株ATCC 25923表现出了显著的抑菌活性。同时,对MRSA菌株也表现出很强的抑制作用。提示肤光方可能部分通过抑制湿疹及AD患者皮肤表面金葡菌生长来发挥作用。肤光方主要由野菊花、蒲公英、白藓皮、苦参、地肤子、蛇床子等组成,具有清热燥湿解毒、祛风止痒的功效。现代药理研究表明,野菊花、蒲公英、苦参、蛇床子对金葡菌均有抑制作用,其中野菊花、蒲公英作用较强。白鲜皮、地肤子主要是对真菌有抑制作用而对细菌无明显抑制作用[14]。本实验中发现,肤光方及其加减方的抑菌活性由强到弱依次为肤光方、祛风止痒方、收敛解毒方、清热解毒燥湿方、清热解毒方、清热燥湿方,其中收敛解毒方和清热解毒燥湿方活性相似。肤光方的抑菌作用强于其他不含白藓皮、地肤子的方剂组合。这可能与中药为复方制剂,从单方面或单味药的现代药理研究难以全面评价其疗效,各药物之间存在一定的配伍关系有关。
综上,本实验不仅为肤光方的临床应用提供了一定的理论依据,也为肤光方的作用机制研究提供新的思维方向。
[1]李仪奎.中药药理实验方法学 [M].上海;上海科学技术出版社,1991:288-293.
[2]Breuer K,Kapp A,Werfel T.Bacterial infections and atopic dermatitis[J].Allergy,2001,56:1034-1041.
[3]Leung DY.Atopic dermatitis and the immune system:the role of superantigens and bacteria[J].J Am Acad Dermatol,2001,45:S13-S16.
[4]毕志刚,田美华,林麟,等.湿疹与特应性皮炎皮损处细菌学研究[J].中华皮肤科杂志,2004,37(9):595-597.
[5]弓娟琴,林麟,郝飞,等.湿疹及特应性皮炎皮损处细菌定植情况及药物联合治疗的分析[J].中华皮肤科杂志,2004,37(10):515-518.
[6]Werfel T.The role of leukocytes,keratinocytes,and allergenspecific IgE in the development of atopic dermatitis[J].J Invest Dermatol,2009,129:1878-1891.
[7]Breuer K,Wittmann M,Bosche B,et al.Severe atopic dermatitis is associated with sensitization to staphylococcal enterotoxin B(SEB)[J].Allergy,2000,55:551-555.
[8]Skov L,Olsen JV,Giorno R,et al.Application of Staphylococcal enterotoxin B on normal and atopic skin induces up-regulation of T-cells by a superantigen-mediated mechanism[J].J Allergy Clin Immunol,2000,105:820-826.
[9]Strange P,Skov L,Lisby S,et al.Staphylococcal enterotoxin B applied on intact normal and intact atopic skin induces dermatitis[J].Arch Dermatol,1996,132:27-33.
[10]Langer K,Breuer K,Kapp A,et al.Staphylococcus aureus-derived enterotoxins enhance house dust mite-induced patch test reactions in atopic dermatitis[J].Exp Dermatol,2007,16:124-129.
[11]Hauk PJ,Hamid QA,Chrousos GP,et al.Induction of corticosteroid insensitivity in human PBMCs by microbial superantigens[J].J Allergy Clin Immunol,2000,105:782-787.
[12]Lever R,Hadley K,Downey D,et al.Staphylococcal colonization in atopic dermatitis and the effect of topical mupirocin therapy[J].Br J Dermatol,1988,119:189-198.
[13]Nilsson EJ,Henning CG,Magnusson J.Topical corticosteroids and Staphylococcus aureus in atopic dermatitis[J].J Am Acad Dermatol,1992,27:29-34.
[14]张廷模.临床中药学 [M].北京:中国中医药出版社,2004:182,184,193,198,302,607.

