睾酮对AMI大鼠病死率及心室重构的影响
张博雅,李永健,党 群,金 喆
(天津市南开医院,天津300100)
男性是冠心病的独立危险因素之一,但迄今为止没有证据显示雄激素可以使冠心病的发病率增高。研究发现,男性性激素水平随其衰老而降低,而睾酮水平越低冠心病发病率越高。最近,已有丙酸睾酮治疗心衰的大规模临床观察研究,并显示出良好的治疗效果。2005年7月~2006年7月,我们在行去势术的雄性SD大鼠急性心肌梗死(AMI)后6 h开始应用大、小剂量睾酮,观察其对AMI病死率及心室重构的影响。现报告如下。
1 材料与方法
1.1 实验动物及分组 雄性清洁SD大鼠85只,体质量250~350 g,购自中国人民解放军军事医学科学院实验动物中心,饲养条件:常温、普通饲料、自由饮水。随机选取10只行睾丸切除假手术;其余75只均行睾丸切除术。所有去势及假去势大鼠均行冠脉结扎术。术后6 h大鼠正式分组并第1次给药:其中睾丸切除假手术大鼠给予安慰剂,为假手术对照组;去势术+冠脉结扎术大鼠随机分为3组,其中一组给予安慰剂,为安慰剂对照组;一组给予睾酮肌注37.5 mg/kg,每周2次,为大剂量试验组;一组给予睾酮肌注10 mg/kg,每周2次,为小剂量试验组;共给药6周。安慰剂为生理盐水,肌注0.4 mL/kg,每周2次。观察6周,记录大鼠死亡例数。
1.2 大鼠生存情况观察 清洁饲养各组冠脉结扎心梗术后的SD大鼠,6周后记录各组存活大鼠及死亡大鼠数量,计算各组大鼠存活率。
1.3 大鼠心脏标本留取及左室游离壁梗死区厚度心肌横断面积(MCSA)的测量 开腹分离腹主动脉,在两侧髂总动脉分叉处,进针放血,同时于下腔静脉放置滞留针,闭合下腔静脉远端,通过滞留针推注4℃的预冷PBS液约50 mL,直至动脉出血处血液颜色变淡。迅速开胸,打开心包,从主动脉根部离断心脏,取出心脏,迅速放置于4℃ PBS液中洗净残血。沿冠状动脉沟分离心房和心室组织,将心室组织放置于滤纸上1 min去除残存水滴。称量心室总重量,而后分离左、右心室,室间隔保留于左室,分别称量二者重量。将左室放置于10%甲醛溶液中固定10~14 d,切片,进行HE染色。①左室游离壁梗死区厚度的测量:在40倍视野下,每张切片随机选取5~6个完全包含梗死区游离壁自心内膜至心外膜的区域,应用Image Pro Plus4.5图像分析软件计算其平均厚度;②MCSA的测量:在彩色图像下选取细胞核位于中心且较圆的细胞进行分析,以保证其测量的均一性[1,2]。
1.4 统计学方法 采用SPSS11.5统计软件。计量资料以±s表示,多组间均数比较采用One-way ANOVA的 LSD法,如方差不齐,用 Tamhane's T2法。计数资料比较用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 睾酮对AMI大鼠病死率的影响 4组行冠脉结扎心梗术大鼠共计85只,6周后存活42只,存活率为49.41%。其中,假手术对照组6周后存活6只,存活率为60.00%;安慰剂对照组33只,存活11只,存活率为33.33%;大剂量试验组20只,存活13只,存活率为65.00%;小剂量试验组22只,存活12只,存活率为54.55%。大剂量试验组较安慰剂对照组存活率高(P<0.05)。
2.2 睾酮对AMI大鼠心室重构的影响 左室心肌切片HE染色大体观见图1。梗死区室壁厚度、MCSA比较见表1。
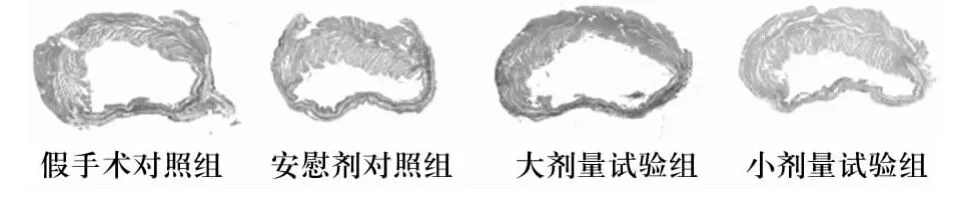
图1 各组大鼠左室心肌切片HE染色
表1 各组大鼠心肌梗死区室壁厚度及MCSA比较(±s)

表1 各组大鼠心肌梗死区室壁厚度及MCSA比较(±s)
注:与安慰剂对照组比较,*P<0.05
组别 n 梗死区厚度(mm) MCSA(μm2)假手术对照组6 2.62 ±0.28 307.25 ±70.74安慰剂对照组 11 2.97 ±0.42 275.09 ±15.10大剂量试验组 13 3.01 ±0.88 295.98 ±49.67小剂量试验组 12 2.94 ±0.39 319.78 ±52.42*
3 讨论
越来越多的证据显示,雄激素与心血管疾病和衰老的关系密切。高TC、LDL、TG血症是动脉粥样硬化的独立危险因素之一,而高HDL则具有保护作用。在临床上常用LDL/HDL即动脉粥样硬化指数进行冠心病一级预防的危险分层[3]。
关于睾酮对血脂影响的研究迄今为止已有很多,观点比较一致,大部分横断面研究显示:内源性睾酮与 HDL 呈正相关[4~6],与 TC、TG、LDL 呈负相关[7,8]。近年研究结果显示,去势术对心梗大鼠血浆脂蛋白水平无显著性影响。在大多数人群中,外源性睾酮治疗会导致HDL减低[9],但对于老年患者或性腺机能低下者,这种影响并不显著。有研究显示,其可能与此类患者多存在肥胖及胰岛素抵抗有关。睾酮水平与肥胖呈负相关[10],而肥胖与HDL水平也呈负相关,外源性睾酮治疗可显著减少内脏及皮下脂肪。一般来说,青年男性及运动员脂肪含量较低,且无胰岛素抵抗,而老年人或性腺机能低下者脂肪含量高,并且多有不同程度的胰岛素抵抗,所以减低了睾酮对HDL的抑制作用。这就可以解释为什么睾酮对HDL的抑制作用在青年男性或运动员要比老年人或性腺机能低下者显著的多。动物实验[11]显示,给予外源性雄激素可改善冠脉血流,增加心室缩短分数和心肌耗氧峰值,因而具有改善心功能的作用,而去势则会导致心室射血分数和舒张功能降低。临床研究[12]发现,冠心病患者补充雄激素可使其冠脉血流增加,运动耐量加强。临床观察资料显示,AMI时所有男性患者血浆睾酮水平均显著降低[13],因此,AMI时补充睾酮治疗,具有合理的病理生理依据。但是,迄今为止国内外关于雄激素治疗AMI的动物实验研究很少,国内尚未见报道,而且尚未见雄激素治疗AMI的临床研究报道。目前,已有2个研究组在动物实验中尝试应用雄激素治疗AMI,但是他们的实验结果几乎对立。Nahrendorf等[14]在雄性大鼠去势后给予十一酸睾酮替代治疗,2周后行左前降支结扎,观察十一酸睾酮对心室重构的影响,结果发现,大鼠左室重量显著增加,心房钠尿肽(ANP)mRNA无显著变化,α/β-肌球蛋白重链(MHC)表达增加,心脏胶原含量无显著改变。因此,Nahrendorf等认为,睾酮治疗可直接作用于心肌细胞而引发一种类似“生理性”心肌肥厚,而并非由心脏负荷改变所致;并且,睾酮治疗可有效降低左室舒张末期压力(对心梗后心室重构没有产生有害影响,甚至具有改善心功能的作用。而Cavasin等[15]在雄性小鼠去势后给予睾酮替代治疗6周,而后行左前降支结扎术。结果显示,与对照组相比,睾酮治疗组心室腔显著扩大,心脏射血功能下降,心脏破裂发生率明显增加。因而,Cavasin等认为,雄激素治疗对心梗后心室重构是有害的。基于上述资料,因此,雄激素对AMI心室重构的影响目前尚无定论,其作用机制更不明确。
本研究结果显示,雄性去势大鼠AMI后,大剂量睾酮治疗可降低AMI的致死率,对梗死区室壁厚度及MCSA无显著影响;小剂量睾酮治疗使MCSA增加,对梗死区室壁厚度无显著影响。因此,睾酮对AMI心室重构影响具有剂量依赖性的特点。
[1]Delyani JA,Robinson EL,Rudolph AE.Effect of a selective aldosterone receptor antagonist in myocardial infarction[J].Am J Physiol Heart Circ Physiol,2001,281(2):H647-654.
[2]Spinale FG,Coker ML,Thomas CV,et al.Time-dependent changes in matrix metalloproteinase activity and expression during the progression of congestive heart failure:relation to ventricular and myocyte function[J].Circ Res,1998,82(4):482-495.
[3]Ramsay LE,Haq IU,Jackson PR,et al.The Sheffield table for primary prevention of coronary heart disease:corrected[J].Lancet,1996,348(9036):1251.
[4]赵艳芳,徐彧,王砚青,等.血脂及部分血脂比值对冠心病的诊断价值[J].山东医药,2012,52(48):94-95.
[5]林书坡,周更苏,孙孟军,等,冠心病患者血清脂联素水平与氧化型低密度脂蛋白及血脂的关系[J].山东医药,2013,53(17):36-37.
[6]Hromadová M,Hácik T,Malatinský E,et al.Alterations of lipid metabolism in men with hypotestosteronemia[J].Horm Metab Res,1991,23(8):392-394.
[7]Simon D,Charles MA,Nahoul K,et al.Association between plasma total testosterone and cardiovascular risk factors in healthy adult men:The Telecom Study[J].J Clin Endocrinol Metab,1997,82(2):682-685.
[8]Haffner SM,Mykkänen L,Valdez RA,et al.Relationship of sex hormones to lipids and lipoproteins in nondiabetic men[J].J Clin Endocrinol Metab,1993,77(6):1610-1615.
[9]Dobs AS,Bachorik PS,Arver S,et al.Interrelationships among lipoprotein levels,sex hormones,anthropometric parameters,and age in hypogonadal men treated for 1 year with a permeation-enhanced testosterone transdermal system [J].J Clin Endocrinol Metab,2001,86(3):1026-1033.
[10]Vermeulen A,Kaufman JM,Giagulli VA.Influence of some biological indexes on sex hormone-binding globulin and androgen levels in aging or obese males[J].J Clin Endocrinol Metab,1996,81(5):1821-1826.
[11]Scheuer J,Malhotra A,Schaible TF,et al.Effects of gonadectomy and hormonal replacement on rat hearts[J].Circ Res,1987,61(1):12-19.
[12]English KM,Steeds RP,Jones TH,et al.Low-dose transdermal testosterone therapy improves angina threshold in men with chronic stable angina:A randomized,double-blind,placebo-controlled study[J].Circulation,2000,102(16):1906-1911.
[13]Malkin CJ,Pugh PJ,Jones TH,et al.Testosterone for secondary prevention in men with ischaemic heart disease[J].QJM,2003,96(7):521-529.
[14]Nahrendorf M,Frantz S,Hu K,et al.Effect of testosterone on post-myocardial infarction remodeling and function[J].Cardiovasc Res,2003,57(2):370-378.
[15]Cavasin MA,Sankey SS,Yu AL,et al.Estrogen and testosterone have opposing effects on chronic cardiac remodeling and function in mice with myocardial infarction[J].Am J Physiol Heart Circ Physiol,2003,284(5):H1560-1569.

