56例疑诊颅内感染患者脑脊液中病原菌的基因芯片技术检测结果
丁锦荣,管义祥,吴德模,张春秀
(1南通大学附属海安医院,江苏南通226600;2生物芯片上海国家工程研究中心研发部)
目前,颅内细菌感染的诊断主要依靠脑脊液细菌培养,但细菌培养周期长,且细菌极易受环境影响,出现标本污染、细菌坏死等可能。单纯依靠脑脊液细菌培养进行致病菌的鉴定明显滞后于临床治疗[1]。基因芯片技术是20世纪90年代发展起来的一项新型生物技术,具有快速、高效、敏感度及准确性高、操作简单等优点,能同时对常见致病菌特异性的DNA 进行检测[2,3]。2010年1月~2013年6月,我们选择颅内感染常见致病菌的DNA特异序列设计并制作复合基因芯片,用于56例疑诊颅内感染患者脑脊液中病原菌的检测。现将结果报告如下。
1 资料与方法
1.1 临床资料 疑诊颅内感染患者56例,男40例,女16例;年龄23~72(46.8±12.8)岁。颅内感染的临床诊断参照Harrison标准[4]及神经外科特点[5],其中脑脊液鼻漏患者2例,开放性脑外伤患者8例,手术时间超过4 h者26例,2次手术患者18例,脑出血脑室引流术后患者2例。临床表现为高热48例,脑膜刺激征32例,颅内高压18例,所有病例脑脊液常规检查均提示WBC>1.18×109/L。
1.2 主要仪器及试剂 PMC-082芯片离心机,OmniGridTM100微阵列点样器,分子杂交箱,GenPix 400B共聚焦激光扫描仪,GenPix Pro 6.0图像扫描和分析软件,DNeasy Blood&Tissue Kit,光学级醛基化修饰芯片。
1.3 脑脊液标本采集 严格无菌操作下腰穿留取脑脊液标本,其中送脑脊液培养留取5~8 mL,送基因芯片检测脑脊液标本约2 mL。为避免标本污染及细菌凋亡或坏死,所送脑脊液标本要求在1 h内送检。
1.4 脑脊液细菌培养 应用接种环挑取脑脊液样本并接种于血琼脂平板及巧克力琼脂平板上,于35℃、5%CO2培养箱中培养24~48 h后涂片检查,观察菌群形态,鉴定细菌种类。
1.5 基因芯片技术应用方法 取约2 mL脑脊液标本在离心机中以8 000 r/min离心10 min,弃上清;加等量灭菌生理盐水充分震荡,悬浮沉淀后再次以8 000 r/min离心10 min,弃上清;加入DNA裂解液180 μL,充分震荡混匀,于37℃温浴30 min;加入25 μL 蛋白酶 K,56 ℃ 下温浴 30 min;加入 200 μL乙醇,采用离心柱提取脑脊液细菌DNA。在Genbank数据库中筛选出4种颅内感染常见细菌[金黄色葡萄球菌(SA)、肺炎克雷伯菌(KNP)、大肠杆菌(E.coli)、肺炎双球菌(PC)]的特异DNA序列及靶序列。用 Primer Premier 5.0软件设计出菌株的PCR引物,同时选择所有细菌共有的16S基因设计引物和探针作为阳性对照。将提取的DNA用聚合酶链反应技术扩增,在反应底物中加入一定浓度的Cy3-dUTP荧光标志物,使其混入聚合酶链反应扩增产物中,作为杂交后激光扫描仪扫描检测的标记。扩增产物行琼脂糖凝胶电泳及结果判定(2%琼脂糖,150 V,电泳时间15 min)。结果可见相应的清晰条带(图1),设计的引物序列特异、有效。进行基片的活化处理,将合成的Oligo(探针)用点样液稀释至浓度50 mmol/L,并放入 384孔板中,每孔 10 μL。用点样仪点样探针于活化的基片上,点样矩阵为6×6,各点随机排列,每个探针位点重复4次(表1)。点样后将芯片固定、洗净,并离心甩干,置于干燥箱中保存备用。在48℃下将备用的Cy3荧光标记聚合酶链反应产物与杂交液按1∶2比例离心机下混匀后的混合液进行热变性2 h,冰浴骤冷后,加样于芯片上的点样区。封片后在42℃下水浴杂交2~3 h,杂交结束后清洗甩干,应用GenPix 400B共聚焦激光扫描仪进行扫描(波长532 nm)。用GenPix Pro 6.0图像扫描和分析软件提取每个探针位点的荧光信号强度值,去除低信号位点,高于cut off值(SNR=3.0)的探针信号为有效信号。
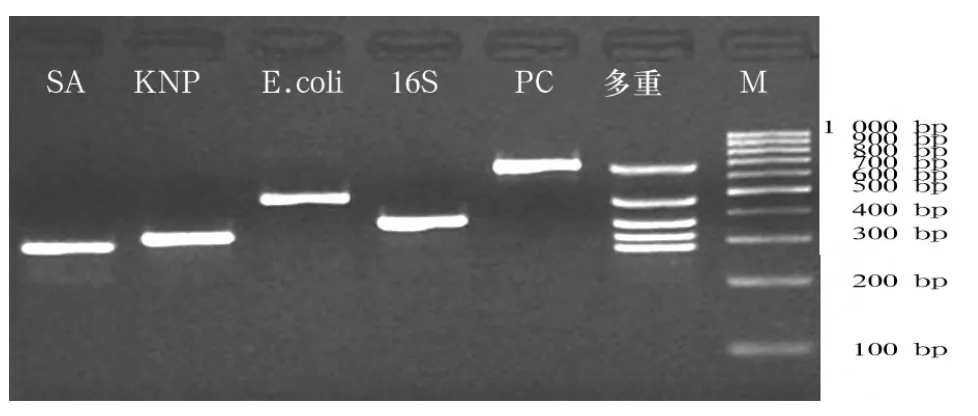
图1 常见颅内感染细菌基因检测的PCR产物电泳图

表1 细菌基因检测芯片排布图
2 结果
聚合酶链反应产物与特异性探针杂交后,在基因芯片上相应的位点显示出绿色荧光,从而鉴定出相应的细菌种类(图2)。

图2 基因芯片鉴定菌种
56例实验标本中,经脑脊液细菌培养确诊颅内感染18例,诊断阳性率为32.14%,病原菌为金黄色葡萄糖球菌6例,肺炎克雷伯菌3例,大肠杆菌2例,肺炎双球菌2例,鲍曼不动杆菌2例,铜绿假单胞菌2例,耳葡萄糖球菌1例;基因芯片技术确诊颅内感染38例,诊断阳性率为39.29%,明确颅内感染致病菌22例,其中金黄色葡萄糖球菌8例,肺炎克雷伯菌5例,大肠杆菌5例,肺炎双球菌4例,与脑脊液细菌培养阳性标本结果完全符合;16例未能鉴定出致病菌,但检出16S基因。
3 讨论
脑脊液细菌培养以其高特异性作为颅内感染的诊断金标准。但脑脊液细菌培养所需时间长(常需2~3个工作日,如果为霉菌、结核杆菌,则时间更长[6]),且容易受到各种因素干扰,存在诸多不足,比如肺炎双球菌,虽是颅内细菌感染常见菌,但因其对营养的要求高,送检过程中容易出现细菌坏死或凋亡,以致培养阳性率很低。
基因芯片技术操作简单,检测迅捷,其所用聚合酶链反应技术对标本中细菌要求低,即使菌落数很少,细菌已坏死或凋亡,只要标本中含有微量的目的DNA,甚至于只要存在部分降解的DNA序列,也可通过聚合酶链反应技术实施样本的扩增,从而检测出相应的致病菌[7,8]。基因芯片技术发展有以下趋势:①基因芯片的高密度化,将更多致病菌的特异DNA序列加入基因芯片中,使得探针的效率提高,同一张基因芯片可以更高效的同时探测更多种类的致病菌;②基因芯片的商品化[9],随着临床需求的增多,更多的基因芯片生产厂家加入到颅内感染致病菌基因芯片的制备中,将会有更多商品化的颅内感染细菌基因检测试剂盒问世,在基因芯片小型化,所需样本微量化上一定会取得长足的进展,将会大大降低目前基因检测的成本,提高检测的灵敏度,促进基因芯片技术在临床快速诊断颅内细菌感染中的应用。
本研究中38例经基因芯片技术确诊颅内感染病例中有16例未能鉴定出致病菌,但仍检出16S基因,其原因在于我们所制备的聚合酶链反应底物不包括这些致病菌的特异性DNA序列,但这些细菌仍保留着16S rDNA基因。有20例脑脊液标本未能培养出致病菌,而基因芯片技术鉴定出菌种,而这些病例均有着明显的颅内感染征象,考虑以下可能:①颅内感染早期,脑脊液中细菌含量低,而目前细菌培养所用的乳胶凝集实验对最低菌落数有最低要求[10],要提高阳性率就需要更多的检测样本;②目前临床早期经验型抗生素的治疗一定程度上降低了脑脊液培养的阳性率。另有18例临床诊断为颅内感染,但未能通过基因芯片技术证实致病菌的存在。可能原因:①部分样本的DNA含量过低,虽经多次扩增,仍未获得荧光标记所需要的最少DNA量;②实验所用荧光标记法自身存在敏感度不高的缺陷;③临床存在一定量的假性脑膜炎病例,虽有颅内感染表现,但无感染病原菌的存在。
本研究选取4种常见颅内感染致病菌的特异DNA序列制作复合基因芯片,通过基因芯片技术,1 d内完成了对可疑脑脊液标本的检测,检测结果与脑脊液细菌培养一致,而且检测出脑脊液培养阴性的颅内细菌感染[11]。可见,基因芯片技术对颅内感染的诊断阳性率及金黄色葡萄球菌、肺炎克雷伯菌、大肠杆菌、肺炎双球菌的检出率高于细菌培养,值得借鉴。
[1]张玉云,吴金英,范小莉.32份脑脊液细菌培养阳性菌株分布及耐药性分析[J].中华神经外科杂志,2011,27(12):1247-1250.
[2]Cheung VG,Morley M,Aguilar F,et al.Making and reading microarrays[J].Nat Genet,1999,21(1 Suppl):15-19.
[3]刘彦轩,贾安奎,郭盛菊,等.FQ-PCR技术在小儿结核性脑膜炎诊断中的应用[J].山东医药,2012,52,(27):63-64.
[4]周强,邢俭,任铭,等.万古霉素脑室内灌注治疗儿童脑室感染[J].中华神经外科杂志,2009,25(9):838-839.
[5]赵继宗,王孝蓉.应用抗菌药物防治外科感染的指导意见(草案)Ⅻ[J].中华外科杂志,2004,42(13):823-825.
[6]张俊仙,吴雪琼.基因芯片技术及其在结核分枝杆菌菌种鉴定及耐药性检测方面的研究进展[J].实用医学杂志,2009,25(21):3718-3720.
[7]Palka-Santini M,Pützfeld S,Cleven BE,et al.Rapid identification,virulence analysis and resistance profiling of Staphylococcus aureus bygene segment-based DNA microarrays:application to blood culture post-processing[J].J Microbiol Methods,2007,68(3):468-477.
[8]戈海泽,梁慧敏,卢晋英,等.基因芯片技术在常见肠道致病菌感染检测中的应用[J].山东医药,2013,53(4):24-28.
[9]农朝赞.生物芯片技术在医学检验中的应用进展[J].广西医学,2011,33(8):1038-1042.
[10]Bingen E,Lambert Z,Mariani K,et al.Bacterial counts in cerebrospinal fluid of children with meningitis[J].Eur Infect Dis,1990,1(9):278.
[11]Shi J,Wu Y,Cai M,et al.Rapid diagnosis of herpetic encephalitis in children by PCR-microarray technology for simultaneous detection of seven human herpes viruses[J].Eur J Pediatr,2010,169(4):421-425.

