基于AFLP技术对桢楠实生白化苗与正常苗的比较研究
张 炜,陈 忠,龙汉利,庄国庆,李晓清
(1.四川省林业科学研究院,四川成都 610081,2.内江市东兴区双才林业工作站,四川内江 641100)
白化苗是是叶片中含叶绿素较少或不含叶绿素的植物幼苗。叶绿素的缺失导致植物不能进行正常的光合作用和生长发育。光合作用对植物来说是必不可少的,光合作用正常与否,对植物生长有重要影响。研究白化苗的成因进而控制其形成是当前作物育种中亟待解决的一个问题。很多研究发现在多种农作物的实生苗或组培苗中存在白化苗,如水稻(Oryza sativa L.)[1]、小麦 (Triticumaestivum L.)[2]、大麦 (Hordeumvulgare L.)[3]、高粱 (Sorghum bicolor(L.)Moench)[4]、玉米 (Zea mays L.)[5]、烟草(Nicotianatabacum L.)[6]、棉花 (Gossypiumhirsutum L.)[7]、甘蔗 (Saccharumsinensis Roxb.)[8]、薏苡(Coixlacrymajobi L.)[9]、雷竹(Phyllostachys praecox C.D.Chu et C.S.Chao)[10]。白化苗不但在农作物中较为普遍,在树木中也有发现,如苏铁(Cycasrevoluta Thunb.)[11]、蓝桉 (Eucalyptus globulus Labill.)[12]、版纳省藤 (Calamus nambariensis Becc.var. xishuangbannaensis S. J. Pei etS. Y.Chen)[13]、椰子树(Cocos nucifera)[14]。白化苗产生的原因有两种,一种是由于生理上的变化引起的;另一种是DNA序列产生了突变。生理上的变化是白化苗形成的外因,包括抗生素[15]、磷和锌[5]、预处理[16]、低温[17]、脉动磁场[18]、不同杂交材料[19]和不同倍性[20]等因素对植物产生白化苗的影响。DNA序列的变异可导致白化苗与正常绿苗叶片的超微结构[11,21]、过氧化物同工酶[22,23,9]、脂酶同工酶[9,22]、可溶性蛋白质[22,24]和质体亚显微结构[25]等方面具有明显的差异,这些差异可能与白化苗的形成有关。遗传学上的研究表明,白化苗遵从单基因分离规律,认为白化苗可以作为评估树木远亲繁殖率的指标[12],但也有相反的研究结果[26]。桢楠(Phoebe zhennan S.Lee&F.N.Wei)是我国重要的经济树种,但目前有关桢楠的研究较少,有关桢楠白化苗的研究迄今还未见有报道。基于此,本文对桢楠白化苗与正常苗的AFLP谱带进行了比较分析。
1 材料
本研究的试验材料为桢楠实生苗。2011年10月份由四川省林业科学研究院在四川、云南、重庆、贵州、湖北和湖南6个省采集苗木种子。按棵采集,每一棵上采到的种子作为一个家系,共采集92个家系,每个家系50棵,2012年3月份将种子播于装有土壤的塑料花盆中,采用相同的营养土质栽培、相同的营养液浇灌,以及相同的光照、温度与湿度管护。

图1 桢楠正常苗(左)和白化苗(右)
实验所用的试剂有购自Biolabs的限制性内切酶EcoRI和 MseI;购自天根生物科技有限公司(Tiangen,北京)的 T4连接酶、TaqDNA聚合酶、dNTPs和甲酰胺、丙烯酰胺、甲叉双丙烯酰胺、尿素,琼脂糖、Tris饱和酚等有机试剂;购自Solarbio公司的亲和硅烷、剥离硅烷;由英潍捷基(上海)贸易有限公司合成引物。
实验所用到得仪器有电子天平(Sartorious)、高速冷冻台式离心机(Thermo)、蒸汽灭菌器、Bio-Rad(MC013208)PCR扩增仪、水平电泳仪(BIO-RAD)和Gene Genius Bio-imaging System凝胶成像凝胶成像系统、北京六一仪器厂生产的DYCZ-20C型垂直电泳系统,UV-VIS Spectrophotometer(Tu-1901型)紫外分光光度仪、摇床以及其它一些常用的实验设备。
2 研究方法
2.1 测定白化苗发生率
2012年7月统计每个家系白化苗的株数和该家系的总株数。
白化苗发生率=每个家系白化苗的株数/该家系的总株数·100%。
2.2 基因组DNA的提取
供试材料种子发芽后,分别取白化苗和正常苗的新鲜嫩叶,基因组DNA提取参照Zhang等的实验方法[21],所得的白化苗基因组DNA和正常苗基因组DNA分别用1%琼脂糖凝胶上电泳检测,用Gene Genius Biolmaging Sysetm凝胶成像系统在紫外光下拍照,可以粗略估算出各样品的DNA浓度,同时还可检测总DNA分子的大小以及是否降解。最后统一将DNA浓度调整为40 ng·μl-1,均保存于 -20℃冰箱备用。
2.3 AFLP扩增
利用实生苗、白化苗的DNA样品对56个引物组合进行了筛选,根据最终聚丙烯酰胺凝胶上反映出的条带数目、清晰度、多态性以及重复性情况来筛选适用的AFLP引物。
PCR 反应体系:体积为 25 μl,3 μl模板 DNA,扩增引物(50 pm·μl-1)各 1.0 μl,2 μl dNTPs(10 mM·μl-1),0.2 μl Taq DNA 聚合酶 (5 U·μl-1),1.5 μl MgCl2(25 mM),补充超纯水至 25 μl。PCR反应程序:94℃预变性2 min;94℃变性30 s,65℃退火(每个循环降低0.7℃)30 s,72℃延伸1 min,12个循环;94℃变性30 s,56℃退火30 s,72℃延伸1 min,23个循环;最后72℃延伸5 min;置于4℃保存备用。
2.4 聚丙烯酰胺凝胶电泳
反应结束后,选择性扩增产物与上样缓冲液(98%甲酰胺;10 retool/L EFrA,pH8.0;0.250k溴酚蓝;0.25%二甲苯青FF)等体积混合,95℃变性6 min.立刻将PCR管放到冰上待用。本实验中采用聚丙烯酰胺凝胶电泳和银染的方法进行检测执。银染后的板晾干后在胶片观察灯下观察,选择那些具有清晰、电泳带易计数的引物作为AF'LP反应的最佳引物。
3 结果与分析
3.1 白化苗发生率
在收集的92个家系中有5个家系出现1株~2株白化苗,其白化苗发生率在2%~4%之间,这与高梁和玉米实生苗的5%以下的白化苗发生率相近[4,5]。
3.2 引物筛选结果
利用实生苗、白化苗的DNA样品对56个引物组合进行了筛选,根据最终聚丙烯酰胺凝胶上反映出的条带数目、清晰度、多态性以及重复性情况,选择出了16个引物组合,利用这16对引物检测白化苗与正常绿色苗的DNA差异条带的筛选引物,具体情况见表1。
3.3 AFLP谱带分析
16对AFLP引物中,发现有两对引物组合(P6和P11)能在正常苗和白化苗中产生差异条带。其中引物P6在白化苗样品中扩增的条带比在正常绿苗少一条,即白化苗缺失一条带,缺失的这条带大小为950 bp左右(图2左)。而引物P11在白化苗样品中扩出的条带比正常绿苗多一条,即白化苗多一条带,多出的这条带的大小为1 150 bp左右(图2右)。差异条带的出现说明白化苗与正常苗在DNA序列上是有差异的。
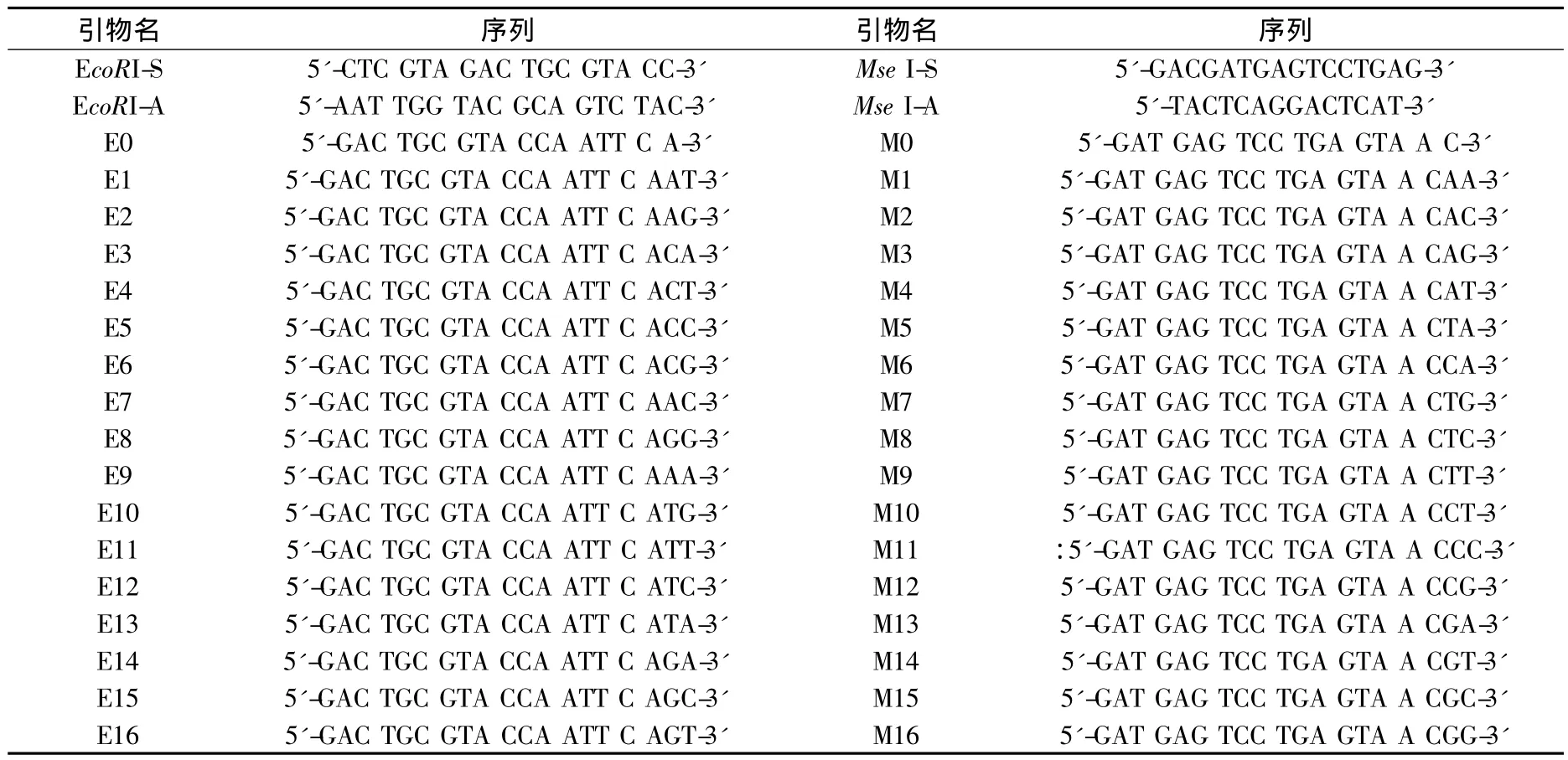
表1 AFLP引物筛选结果表
4 讨论
本研究中两对差异性筛选引物P6(EACG/MCCG)和 P11(EATC/MCGT),获得了两条差异性DNA片段,重复验证实验证明这两条多态性条带能够稳定区分桢楠的白化苗与绿色苗。植物中白化苗性状成因主要有两个,第一是跟DNA序列的突变相关,另外还可能与植物所处的环境以及生理上的变化相关,目前还缺乏两者相关的直接证据。根据本单位关于桢楠种子萌发与幼苗栽培的实验,我们使用采集的桢楠种子,在四川省林业科学研究院繁殖花圃中萌发并管护,实施相同的营养土质栽培、相同的营养液浇灌,以及相同的光照、温度与湿度管护,依然发现了部分白化苗性状的出现,因此推测桢楠白化苗的产生可能与环境生理的差异性原因无太大关联,而主要源于其体内DNA的突变。这也是我们采用AFLP方法,从分子生物学的基因组学角度入手研究桢楠白化苗成因的理由。
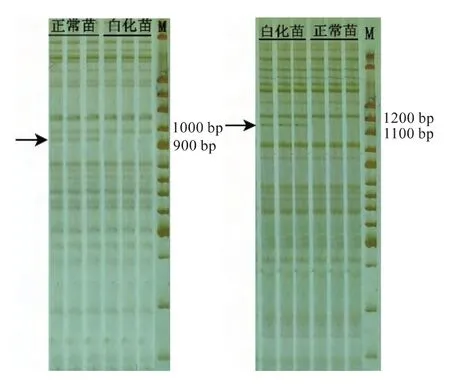
图2 引物P6在正常苗中扩出的特异性条带(左)、引物P11在白化苗中扩出的特异性条带(右)
DNA序列发生差异可能是由碱基突变,碱基或片段的插入,碱基或片段的缺失等引起的。Ellis(1985)研究发现小麦白化苗的质体DNA有大段缺失,不同的白化苗缺失片段及缺失量不同[27]。杨莉等(1998)利用RFLP技术研究了小麦返白系叶绿体DNA的多态性,发现亲缘关系较近的两个小麦品种的白化苗的Hind Ш 酶切片段有差异,他们认为这种差异可能是由于cDNA发生点突变,小片段插入或缺失所造成的[28]。张汉尧等(2005)研究表明矮牵牛的白化可能是由于叶绿体DNA水平上的碱基变化所引起的[29]。本研究中,究竟是碱基的突变,还是缺失或插入导致白化苗与正常绿苗的AFLP谱带发生差异,还需进一步的测序比较分析,从核苷酸序列水平真正揭开桢楠白化苗的基因组突变成因。
[1]李良材,陈一明,陈英.水稻原生质体培养及植株再生的研究[J].遗传学报,1988,15(5):321~328.
[2]朱祯,孙宝林,刘春明,等.转化脂介质小麦原生质体转化及转基因白化苗的再生[J].生物工程学报,1993,9(4):320~323.
[3]代庆阳,汤泽生,王祖秀,等.大麦白化苗叶的组织学和超微结构[J].四川师范学院学报(自然科学版),1992,13(4):291~293.
[4]胡希远,王国栋.脉动磁场对高梁生长发育的影响[J].陕西农业科学,1993(3):7~8.
[5]肖桂秀,李传俊,王蕾,等.玉米减量施肥研究[J].土壤肥料,2003(6):37~40.
[6]Bae C H,Abe T,Mats uyama T,et al.Regulation of chloroplas t gene expression is affected i n ali,a novel t obacco albino mut ant[J].Annals of Bot any,2001,88:545~553.
[7]张宝红,李秀兰,李凤莲,等.棉花组织培养中异常苗的发生与转化[J].植物学报,1996,38(11):845~852.
[8]林俊芳,张银东,陈如凯,等.基因枪法转化甘蔗胚性愈伤组织获得转基因甘蔗白化苗[J].福建农业大学学报,1997,26(1):18~23.
[9]乔亚科,李桂兰,高书国,等.薏苡正常幼苗与白化苗的同工酶分析[J].河北农业技术师范学院学报,1992,6(4):1~3.
[10]付顺华,吴家森,余永清,等.雷竹种子特性及苗期生长观察[J].山东林业科技,2002(1):11~12.
[11]傅瑞树,卢健.苏铁白化苗叶片细胞的超微结构[J].亚热带植物通讯,1997,26(1):29~31.
[12]Patterson B,Wolbang CM,Vaillancourt R E,et al.Inheritance of two chlorophyll mutants in Eucalyptus globules[J].SilvaeGenetica,2000,49(6):290~292.
[13]李荣生,尹光天,许煌灿,等.版纳省藤实生白化苗与正常苗的比较研究[J].林业科学研究,2004,17(6):819~823.
[14]曹红星,陈良秋,孙程旭,等.不同椰子品种正常绿苗与白化苗形态和生理生化指标的差异.西南农业学报[J],2009,22(2):304~307.
[15]刘志勇,孙其信,黄铁诚,等.抗生素诱变小麦雄性不育研究:I.链霉素诱变小麦雄性不育的诱变效应[J].中国农业大学学报,1996,1(5):1~7.
[16]钟华鑫,潘向群,陈汉民,等.BA田间预处理对大麦花药若干生理性状和培养效率的影响[J].云南植物研究,1992,14(2):179~186.
[17]许智宏,Sunderland N.大麦花粉在低温预处理及培养中DNA含量的显微光度测定[J].植物生理学报,1986,12(1):140~147.
[18]胡希远,王国栋.脉动磁场对高梁生长发育的影响[J].陕西农业科学,1993(3):7~8.
[19]凌定厚,陈梅芳,马镇荣,等.光敏感雄性不育水稻花药培养研究[J].中国科学院华南植物研究所集刊,1990(6):152~158.
[20]舒理慧,张廷壁,周明杰.水稻不同倍性的幼穗在离体培养中的反应[J].科学通报,1985(3):221~224.
[21]陈湘宁,李玉湘,李继耕.水稻、小麦花药培养白化苗质体亚显微结构和蛋白质的研究[J].遗传学报,1988,15(2):95~101.
[22]傅瑞树.苏铁白、绿苗可溶性蛋白质及若干同工酶分析[J].福建林学院学报,1999,19(3):235~237.
[23]赵亚华,郭蔼光,汪沛洪,等.小麦返白系与不同基因型小麦品种杂交后代 IPO表达的研究[J].西北植物学报,1996,16(2):142~148.
[24]代庆阳,汤泽生,王祖秀,等.大麦白化苗叶的组织学和超微结构[J].四川师范学院学报(自然科学版),1992,13(4):291~293.
[25]马闻师,郭蔼光,汪沛洪.小麦返白系返白期间类囊体膜多肽的变化研究[J].华北农学报,1998,13(增刊):56~58.
[26]付秀林.水稻花培中白化苗成因的探讨[J].农业与技术,1996(4):8~9,12.
[27]Ellis J R,Leech R M.Cell size and chloroplast size in relation to chloroplast replication in light-graon wheat leaves[J].Plauta,1985,165:120~125.
[28]杨莉,范三红,郭蔼光.小麦返白系叶绿体DNA多态性研究[J].西北农业大学学报,1998,26(6):14~16.
[29]张汉尧,刘小珍,杨宇明.矮牵牛组培白化苗与正常苗叶绿体DNA多态性研究[J].湖北农业科学,2005(2):15~16.

