醛糖还原酶基因多态性与2型糖尿病视网膜病变的关系
任 珉,赵莉莉,张 莹,师 莹,毛用敏,齐秀英
(1天津市心血管病研究所,天津300222;2天津市胸科医院;3天津医科大学公共卫生学院)
糖尿病视网膜病变(DR)是糖尿病最常见的微血管并发症之一,是糖尿病患者视力受损和致盲的重要原因[1~4]。除高血糖和环境因素影响之外,遗传因素在视网膜病变的发生发展中也起重要作用。醛糖还原酶(AR)是葡萄糖代谢多元醇通路上的限速酶,该酶基因表达异常与DR的发生发展密切相关[5]。既往对AR的研究多集中于其5'端的(AC)n核苷酸重复序列的多态性,近年来AR基因上游启动区-106 C/T单核苷酸多态性开始受到关注。为探讨AR基因上游启动区-106 C/T单核苷酸多态性与DR发病的关系,我们于2009年6月~2011年3月进行了如下研究。
1 资料与方法
1.1 临床资料 选择2009年6月~2010年10月收治的2型糖尿病患者374例,均经1997年美国糖尿病协会(ADA)糖尿病诊断标准[6]确诊。其中病例组 161例,男 84例,女 77例,年龄(59.93±10.68)岁,病程7~16年,有DR病史或住院期间眼底镜检查有视网膜病变,排除其他原因引起的视觉损害、视力下降;对照组213例,男114例,女99例,年龄(58.40±12.96)岁,病程2~12年,无 DR 病史且住院期间眼底镜检查未发现视网膜病变,排除其他原因引起的视觉损害、视力下降者。病例组与对照组年龄和性别分布差异无统计学意义(P均>0.05)。
1.2 DNA的提取与扩增 两组均于入院次日清晨采集空腹静脉血5 mL,加EDTA抗凝,-80℃保存。采用血液DNA快速提取法(TKM法,TaKaRa公司)提取全血DNA,紫外分光光度计下测定OD260/OD280大于1.7,且琼脂糖凝胶电泳显示DNA完整性良好。采用PCR法行DNA扩增。AR基因上游引物序列为5'-CCT TTC TGC CAC GCG GGG CGC GGG-3',下游引物序列为 5'-CAT GGC TGC TGC GCT CCC AG-3'(由TaKaRa公司合成)。PCR反应体系中各组分的终浓度为 DNA样本0.5 μg,10×PCR Buffer 2.5 μL,Taq DNA 聚合酶 2.5 U,dNTPs 0.25 μmol/L,上下游引物各 0.4 μmol/L,灭菌纯净水补足体积至25 μL。扩增条件:95℃预变5 min,95℃1 min,66 ℃ 1 min,72 ℃ 1 min,循环35次,72 ℃延伸7 min。于2%琼脂糖凝胶电泳,恒定电压90 V,紫外透射反射仪下观察结果。
1.3 AR基因-106CT多态性检测 取10 μL PCR产物,加限制性内切酶 BfaⅠ(10 U)1.0 μL,10 ×Buffer K 2.0 μL,双蒸水(ddH2O)7.0 μL,组成 20 μL的反应体系。置于37℃恒温水浴箱中反应6 h。酶切反应结束后,取10 μL酶切产物与2 μL上样缓冲液混合均匀,置于3.5%琼脂糖凝胶,在恒定电压90 V、紫外透射反射仪下观察结果。计算AR基因-106 bp C/T等位基因频率,等位基因频率=(2×纯合子数+杂合子数)/(2×受检者例数)。分析AR基因-106 C/T多态性与DR的关系。
1.4 统计学方法 采用SPSS16.0统计软件进行统计学分析。计量资料以±s表示,组间比较用t检验。计数资料用率或构成比表示,组间比较采用χ2检验。采用单因素Logistic回归分析对DR发病的危险因素进行分析,计算OR及其95%CI,并对可能的混杂因素进行调整。P<0.05为差异有统计学意义。
2 结果
2.1 AR基因-106 C/T多态性 AR基因PCR扩增产物为263 bp,其中含有一个非特异性BfaⅠ酶切位点,经酶切后产生206、57 bp的两个片段。AR基因启动子区域-106 bp C/T为SNP基因多态位点(在206 bp片段中)。当此位点为C时PCR产物不存在BfaⅠ酶切位点,电泳显示为206 bp的条带,此为CC型(野生型);为T时产生BfaⅠ酶切位点,206 bp DNA片段被切成147、59 bp的两条片段,此为TT型(变异型);出现206、147、59 bp三个片段,此为杂合子。见图1。病例组中,AR基因型频率CC型为53.42%,CT 型为35.40%,TT 型为11.18%;对照组分别为 39.91%、47.88%、12.21%。病例组 CT/TT基因型频率低于对照组(χ2=7.104,P=0.029)。病例组等位基因C频率为71.12%,T为 28.88%;对照组分别为63.85%、36.15%。病例组T等位基因频率低于对照组 (χ2=4.380,P=0.036),见表1。
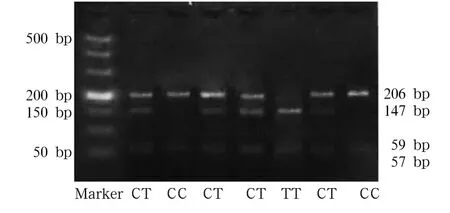
图1 AR基因PCR限制性酶切产物电泳结果
2.2 AR基因Hardy-Weinberg遗传平衡性检验对照组中CC、CT、TT基因型分布频率与期望频率差异无统计学意义(P均>0.05),符合Hardy-Weinberg定律,说明达到遗传平衡,具有群体代表性。详见表2。

表1 病例组与对照组AR基因型和等位基因分布[例(%)]

表2 AR基因型频率的Hardy-Weinberg遗传平衡性检验
2.3 AR基因-106 C/T多态性与DR的关系 单因素Logistic回归分析结果显示,-106C/T的CT/TT基因型与 DR 发病有关(OR=0.579,95%CI:0.383~0.876),且经糖尿病家族史调整后二者间的统计学关联仍然存在。携带T等位基因的2型糖尿病患者发生 DR 的危险性降低(OR=0.717,95%CI:0.525~0.980)。见表3。

表3 AR基因-106C/T多态性与AR的关系
3 讨论
AR基因位于人类染色体7q35,全长约18 kb,含有10个外显子和9个内含子,存在多个多态性位点。已有研究证明,葡萄糖代谢多元醇通路与糖尿病微血管并发症的发生发展有关[7]。AR作为还原型辅酶Ⅱ依赖型醛酮还原酶家族的单体酶,是多元醇通路中的限速酶,对葡萄糖的亲和力较低。在正常血糖浓度下,该酶活性不高,葡萄糖进入细胞后很快被分解,进入三羧酸循环,氧化供能。在高血糖状态下,AR活性增高将导致大量葡萄糖转化为山梨醇,由于山梨醇极性很强,难以透过细胞膜,而在细胞内堆积,并引起还原型辅酶Ⅱ、肌醇和Na+-K+-ATP酶活性降低,干扰细胞代谢,破坏组织结构,影响血管通透性,使毛细血管基底膜增厚,导致视网膜微动脉和毛细血管结构改变(如周细胞变性、基底膜增厚和内皮细胞增生等),最终导致 DR 的发生[8,9]。
近年来,AR基因启动子-106 C/T多态性与DR的关系逐渐受到学者们的关注。澳大利亚学者[10]率先发现AR基因上游启动区-106 C/T碱基突变,携带C等位基因的糖尿病患者发生DR的危险性增加。有学者[11~15]分别对中国北方汉族、美国、巴西及日本的2型糖尿病患者进行研究,均发现-106C/T的CC基因型与DR的易感性有关。但也有研究[6,16]报道未发现AR基因-106 C/T的多态性与DR的发生有关。本研究结果显示,携带CC基因型和C等位基因的糖尿病患者发生DR的危险性高于CT/TT基因型和T等位基因携带者,经DM家族史调整后这种关联仍然存在,提示AR基因-106C/T的这两种基因型与DR发病有关。AR基因-106C/T的多态性可能会引起AR表达增加,导致多元醇代谢通路激活,使大量山梨醇在细胞内蓄积,形成细胞内高渗状态,大量细胞外液渗入,导致细胞水肿。同时,山梨醇改变了细胞膜的通透性,使K+、肌醇等大量丢失,引起组织结构和功能异常,最终导致DR的发生。由于不同研究人群、样本量不同等原因的影响,本研究结论与相关研究尚存在一定差异,关于AR基因-106 C/T多态性与DR的关联性,还有待进一步深入研究。
[1]Zheng Y,He M,Congdon N.The worldwide epidemic of diabetic retinopathy[J].Indian J Ophthalmol,2012,60(5):428-431.
[2]Oster G,Lamerato L,Glass AG,et al.Use of intravenous bisphosphonates in patients with breast,lung,or prostate cancer and metastases to bone:a 15-year study in two large us health systems[J].Supportive Care in Cancer,2014,22(5):1363-1373.
[3]伍春荣,许樟荣,胡莲娜,等.2型糖尿病发生增生性糖尿病视网膜病变的危险因素[J].中华眼底病杂志,2003,19(6):338-340.
[4]张春元.青海高原地区糖尿病视网膜病变调查[J].中华流行病学杂志,2003,24(9):773.
[5]梁舒,管怀进,陈辉,等.醛糖还原酶基因启动区C(-106)T多态性与糖尿病视网膜病变相关研究[J].现代生物医学进展,2009,9(1):77-79.
[6]Guillausseau PJ.Classification and diagnostic criteria of diabetes:propositions of ADA and WHO[J].Diabetes Metab,1997,23(5):454-455.
[7]Abhary S,Burdon KP,Laurie KJ,et al.Aldose reductase gene polymorphisms and diabetic retinopathy susceptibility[J].Diabetes Care,2010,33(8):1834-1836.
[8]He NH,Liu M,Hsu J,et al.Hiv-1 tat and host aff4 recruit two transcription elongation factors into a bifunctional complex for coordinated activation of hiv-1 transcription[J].Mol Cell,2010,38(3):428-438.
[9]张继惠,王红艺,李曙远.醛糖还原酶基因多态性与2型糖尿病及视网膜病变的相关性[J].山东大学学报(医学版),2008,46(4):399-402.
[10]Kao YL,Donaghue K,Chan A,et al.A novel polymorphism in the aldose reeducate gene promoter region is strongly associated with diabetic retinopathy in adolescents with type 1 diabetes[J].Diabetes,1999,48(6):1338-1340.
[11]邹效漫,马芳玲,陆菊明.醛糖还原酶基因启动子区-106T多态性与2型糖尿病患者视网膜病变易感性的研究[J].中国糖尿病杂志,2003,11(3):200-203.
[12]Ying W,Maggie CY,Lee SC,et al.Phenotypic heterogeneity and associations of two aldose reductase gene polymorphisms with nephropathy and retinopathy in type 2 diabetes[J].Diabetes Care,2003,26(8):2410-2415.
[13]Olmos P,Bastias MJ,Vollrath V,et al.C(-106)T polymorphism of the aldose reductase gene and the pregression of diabetic retinopathy[J].Diabetes Res Clin Pract,2006,74(2):175-182.
[14]Santos KG,Canani LH,Gross JL,et al.The-106CC genotype of the aldose reductase gene is associated with an increased risk of proliferative diabetic retinopathy in Caucasian-Brazilians with type 2 diabetes[J].Mol Genet Metab,2006,88(3):280-284.
[15]Katakami N,Kaneto H,Takahara M,et al.Aldose reductase C-106T gene polymorphism is associated with diabetic retinopathy in Japanese patients with type 2 diabetes[J].Diabetes Res Clin Pract,2011,92(3):57-60.
[16]Santos KG,Tschiedel B,Schneider J,et al.Diabetic retinopathy in Euro-Brazilian type 2 diabetic patients:relationship with polymorphisms in the aldose reductase,the plasminogen activator inhibitor-1 and the methylenetetrahydrofolate reductase genes[J].Diabetes Res Clin Pract,2003,61(2):133-136.

