芍药苷预处理对脑缺血再灌注损伤大鼠脑组织细胞凋亡及CHOP蛋白表达的影响
毛森林,马翊竑,张海东,齐 军,李 峰
(哈尔滨医科大学附属第二医院,哈尔滨150086)
脑缺血/再灌注损伤(CIR)最终会导致神经元 凋亡[1],凋亡的通路主要有死亡受体活化途径(外源性途径)、线粒体损伤途径(内源性途径)和内质网应激启动的凋亡途径,其中内质网应激途径(ERS)是目前发现的一种新的凋亡途径[2,3]。有研究显示,ERS在CIR过程中处于核心地位,预处理可以减轻组织损伤[4,5],而上调 CHOP 蛋白表达是ERS诱导细胞神经元凋亡的途径之一。有研究报道,芍药苷(PA)不仅具有降低血黏度、抗血小板聚集、抗炎、免疫抑制及抗肿瘤等作用[6~9],还对 CIR有一定的保护功能[10]。2014年1~3月,我们观察了PA预处理对CIR大鼠组织细胞凋亡及CHOP蛋白表达的影响。现报告如下。
1 材料与方法
1.1 材料 SD雄性大鼠72只,体质量(250±10)g,均来自哈尔滨医科大学附属第二医院动物实验中心。水合氯醛购于 Sigma公司,DMSO购于美国Amresco公司,冰冻切片快速抗原修复液购于碧云天生物技术研究所,DAB显色试剂盒购于武汉博士德生物工程有限公司,TUNEL细胞凋亡检测试剂盒购于德国Roche公司。
1.2 方法
1.2.1 分组预处理与造模 将72只SD雄性大鼠随机分为预处理组、模型组、假手术组各24只。预处理组给予0.2 mg/kg PA灌胃,模型组及假手术组给予等量PBS灌胃,1次/d,连续3 d。于给药后第4天,参照Longa等[11]的方法并加以改良,建立大鼠CIA模型。造模前禁食12 h,不禁水。预处理组、模型组根据体质量腹腔注射水合氯醛0.3 mL/100 g,固定、备皮;后颈前正中旁开2 mm做纵行小切口,分离左侧颈外动脉(ECA)、颈内动脉(ICA)及颈总动脉(CCA)。结扎ECA远端,分别在ICA及CCA上放置显微血管夹,在ECA距CCA分叉部约7 mm处剪一斜行小切口,将线栓自ECA切口插入;用电凝器将剪口处电凝处理,切断ECA,分别松开ICA及CCA上显微动脉夹;调转线栓头端方向,将线栓在直视下插入ICA约17 mm,从而阻断大脑中动脉(MCA)主干血流;将大鼠切口处用纱布蘸取少量生理盐水覆盖,保留线栓90 min后拔出,缝合切口。假手术组仅暴露各动脉,不做切口与线栓插入。在模型制作过程中,凡手术中动物死亡、蛛网膜下腔出血或无对侧偏瘫体征均视为模型制作失败,用同一批次的大鼠造模成功后补足数目。
1.2.2 脑组织细胞凋亡检测 采用TUNEL法。各组分别于再灌注1(T0)、4(T1)、24(T2)h各取6只大鼠快速断头取脑,制作脑组织冰冻切片,片厚7 μm。4%多聚甲醛固定,PBS洗涤、孵育,加50 μL生物素标记液,37℃孵育60 min;加0.1~0.3 mL标记反应终止液,室温孵育10 min;加50 μL Streptavidin-HRP工作液,湿盒室温孵育30 min;加0.2~0.5 mL DAB显色液,室温孵育;常规乙醇脱水,二甲苯透明后封片。细胞核或细胞质染成棕黄色颗粒者为阳性细胞,即为凋亡细胞。于200倍显微镜下随机选取6个视野,每个视野采用IPP6.0软件计数凋亡细胞。细胞凋亡指数=凋亡细胞/细胞总数×100%,取平均值。
1.2.3 脑组织CHOP蛋白检测 采用免疫组化法。切片经4%PFA固定20 min,30%H2O2和纯甲醇以1∶50的比例固定30 min,抗原修复液修复5 min,5%BSA封闭 30 min。加 CHOP抗体(兔 IgG 1∶100)4℃过夜,及生物素化山羊抗兔IgG(1∶200)37℃孵育20 min。SABC封闭30 min后DAB显色,常规乙醇梯度脱水,二甲苯透明,树胶封片。以PBS代替CHOP抗体作为对照,细胞核及细胞质呈棕黄色为阳性表达。显微镜下每张切片随机选取6个视野进行观察拍照,使用IPP6.0软件进行细胞计数。CHOP蛋白表达=阳性细胞数/细胞总数×100%。1.2.4 神经功能评分 每组于缺血再灌注后24 h各取6只大鼠,由不知分组情况的观察者在相同条件下参照Bederson等[12]的方法进行神经功能评分:0分:正常,未见任何神经功能缺损表现;1分:垂直提起时缺血对侧前爪不能伸直;2分:行走时向偏瘫侧转圈;3分:行走时身体向偏瘫侧倾倒;4分:不能自发行走或有意识障碍。评分为0、4分者剔除实验。
1.2.5 统计学方法 采用SPSS17.0统计软件。计量资料以±s表示,组内比较采用配对t检验,组间数据比较采用单因素方差分析(One-way ANOVA)。P≤0.05为差异有统计学意义。
2 结果
2.1 各组脑组织细胞凋亡指数和CHOP蛋白表达比较 见表1。
2.2 各组神经功能评分比较 预处理组神经功能评分为(1.33 ±0.52)分,模型组(2.50 ±1.05)分,假手术组为0分;预处理组和模型组的神经功能评分均高于与假手术组,P分别 <0.05、0.01;预处理组和模型组比较,P <0.01。
3 讨论
缺血性脑卒中是由各种原因所致急性脑动脉血液供应障碍,导致脑组织缺血缺氧性坏死,出现相应神经功能损害的综合征[13];是严重威胁人类健康的疾病之一,具有高发病率、高致残率、高复发率的特点。正常生理状态下,流经脑组织的血液为750~1 000 mL/min,为心脏每搏输出量的1/5,脑组织耗氧量占全身耗氧量的20%~30%,脑细胞的主要能量来源为有氧代谢产生的葡萄糖,几乎没有能量储备,因此脑组织对缺血、缺氧性损害十分敏感。如果脑动脉血流持续中断10~15 min,神经元就会发生不可逆性损害而坏死[14]。因此,在CIR超急性期采取积极的治疗措施恢复血供尤为重要。溶栓治疗可以实现闭塞脑动脉再通,重建脑血流,使受损脑组织的血液重新再灌注,从而挽救缺血半暗带,迅速恢复受损伤的神经功能,被认为是最有效的脑卒中治疗方法[15]。而溶栓治疗除有出血的并发症外,再灌注损伤对脑细胞的损害也不可忽视。
表1 各组脑组织细胞凋亡指数和CHOP蛋白表达比较(%,±s)
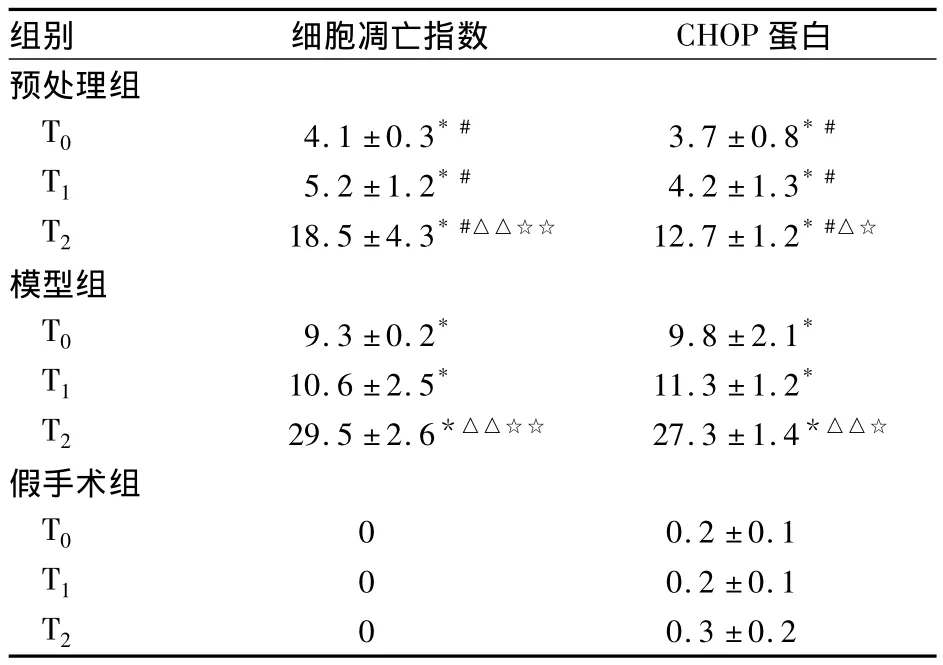
表1 各组脑组织细胞凋亡指数和CHOP蛋白表达比较(%,±s)
注:与假手术组同时点比较,*P<0.01;与模型组同时点比较,#P <0.05;与同组T0时点比较,△P <0.05,△△P <0.01;与同组 T1时比较,☆P <0.05,☆☆P <0.01
组别 细胞凋亡指数 CHOP蛋白0.3 ±0.2预处理组T0 4.1 ±0.3*# 3.7 ±0.8*#T1 5.2 ±1.2*# 4.2 ±1.3*#T2 18.5 ±4.3*#△△☆☆ 12.7 ±1.2*#△☆模型组T0 9.3 ±0.2* 9.8 ±2.1*T1 10.6 ±2.5* 11.3 ±1.2*T2 29.5 ±2.6*△△☆☆ 27.3 ±1.4*△△☆假手术组T0 0 0.2 ±0.1 T1 0 0.2 ±0.1 T20
ERS主要通过以下3种方式诱导细胞神经元凋亡:①CHOP基因激活ATF4转录因子持续表达促使编码细胞凋亡的诱导因子,上调 CHOP表达;CHOP可诱导氧自由基,促使细胞凋亡。②JNK激活途径激活JNK诱导细胞凋亡。③ Caspase-12激活通路激活IRE后,激活Caspase-9、Caspase-3导致细胞凋亡。本研究采用PA对CIR大鼠进行预处理后发现,同时点脑组织细胞凋亡指数、CHOP蛋白表达比较,模型组 >预处理组 >假手术组,P均 <0.05;预处理组和模型组脑组织细胞凋亡指数、CHOP蛋白表达在缺血再灌注初期表达量很少,均于再灌注24 h达到峰值;且预处理组和模型组的神经功能评分均高于对照组。不仅说明缺血再灌注过程中CHOP蛋白表达的上调启动了ERS,还证明了PA对于CIR大鼠的神经细胞具有保护作用,可以拮抗CHOP的表达,维持细胞的稳态,阻断ERS诱导的细胞凋亡,进而减轻神经细胞的凋亡。
综上所述,PA预处理可以显著降低CIR大鼠脑组织细胞凋亡、CHOP蛋白表达及神经功能评分,可能与阻断ERS引发的细胞凋亡有关。但是由于CIR机制很复杂,有诸多的环节共同作用,而且本研究以大鼠作为研究对象,和人体有很大的差异,所以PA预处理是否能在临床上具有相同的效果仍有待于进一步研究。
[1]Maslov LN.Signaling mechanism of neuroprotective effect of ischemic preconditioning of brain[J].Patol Fiziol Eksp Ter,2013(3):73-80.
[2]Tsai WH,Yang CC,Li PC,et al.Therapeutic potential of traditional chinese medicine on inflammatory diseases[J].J Tradit Complement Med,2013,3(3):142-151.
[3] Takada K,Hirose J,Yamabe S,et al.Endoplasmic reticulum stress mediates nitric oxide-induced chondrocyte apoptosis[J].Biomed Rep,2013,1(2):315-319.
[4] Ye Z,Wang N,Xia P,et al.Parecoxib suppresses CHOP and Foxo1 nuclear translocation,but increases GRP78 levels in a rat model of focal ischemia[J].Neurochem Res,2013,38(4):686-693.
[5] Connell BJ,Di IP,Sayeed I,et al.Guanosine protects against reperfusion injury in rat brains after ischemic stroke[J].J Neurosci Res,2013,91(2):262-272.
[6] Iadecola C.The pathobiology of vascular dementia[J].Neuron,2013,80(4):844-866.
[7]孙丽荣,曹雄,侯凤青,等.芍药苷研究进展[J].中国中药杂志,2008,33(18):2028-2032.
[8]胡南,许惠玉,陈志伟,等.芍药苷的药理学研究进展[J].齐齐哈尔医学院学报,2007,28(9):1093-1095.
[9]吴玉梅,许汉鹏,王春婷,等.芍药苷对培养小鼠皮层神经元的保护作用[J].中国药理学与毒理学杂志,2002,16(3):172-175.
[10]Chen JC,Li LJ,Wen SM,et al.Quantitative analysis and simulation of anti-inflammatory effects from the active components of Paino Powder in rats[J].Chin J Integr Med,2011,Dec8.[Epub ahead of print].
[11]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[12]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[13]Wang YD,Lu RY,Huang XX,et al.Human tissue kallikrein promoted activation of the ipsilesional sensorimotor cortex after acute cerebral infarction[J].Eur Neurol,2011,65(4):208-214.
[14]NINDS rt-PA Stroke Study Group.Tissue plasminogen activator for acute ischemic stroke[J].N Engl J Med,1995,(333):1581-1587.
[15]贾建平.神经病学[M].6版.北京:人民卫生出版社,2008:175.

