2012年春季和秋季长江口无脊椎动物群落结构及其与环境因子的关系*
徐 勇,线薇微,李文龙
(1.中国科学院海洋研究所海洋生态与环境科学重点实验室,山东 青岛 266071;2.中国科学院大学,北京 100049)
长江口是一个半封闭的海岸水体,与海洋自由沟通,海水被陆域来水所冲淡[1]。长江口水域径流、潮流、风浪共存,水流、泥沙运动具有很强的非恒定性,物理、化学、生物和地质过程耦合多变,演变机制复杂,生态环境敏感脆弱,形成了有别于淡水和海洋独特的河口环境[2]。同时长江口是我国生长力最高的河口生态系统,是海洋生物营养生物资源的重要来源地,也是最敏感和最重要的生物栖息地之一,众多生物种类在这里完成部分和全部生活史,尤其是许多鱼类和无脊椎动物重要的觅食、繁衍和栖息场所[3]。
长江口渔场是我国最大的河口渔场,渔业生物群落特征与邻近的舟山渔场、吕泗渔场及东海渔场紧密相连。长江口无脊椎动物是渔业资源的重要组成部分,随着鱼类资源的衰退,无脊椎动物对渔业资源的贡献逐步加强。国内学者针对无脊椎动物重要类群如蟹类[4-5]、虾类[6-8]、头足类[9-12]种群动态进行了大量研究,研究区域包括渤海[13-14]、黄海[15-17]和东海水域[18-20]。长江口无脊椎动物群落结构调查时间限于1980年代[21]和2006年[22-23]。目前,对无脊椎动物群落整体结构特征研究较少,其群落变异与环境变化间关系研究还未见报导。本文通过2012年春季和秋季对长江口及邻近海域底层拖网调查数据,探讨该海域无脊椎动物群落结构特征及其与环境因子的关系,以期为长江口及邻近海域无脊椎动物资源的可持续利用提供科学依据。
1 材料与方法
1.1 调查方法
2012年5 和11 月在122°30′E以东长江口及邻近海域15个站点完成底层双拖网定点调查(见图1)。无脊椎动物资源调查根据《海洋调查规范》(GB12763)实施。调查船为147吨位底层双拖网渔船,调查网具为150.5m×96.5m轻拖网,网口周长150.5m,上纲长66m,下纲长73m,网衣最大网目200mm,网目大小自网身随后沿轴线向囊网递减,囊网部30mm。经海上实测,拖网时网口张开高度在9~11m之间,平均网袖间距18m,拖网速度2~3节。每站拖网0.5~1h,将所获无脊椎动物鉴定分类[24-25],记录每种的数量、重量。
各站位同步调查的环境因子,包括深度、盐度、温度、pH、溶解氧、化学需氧量、5项营养盐(硝酸盐、亚硝酸盐、铵盐、磷酸盐和硅酸盐)、总氮、总磷、悬浮物、叶绿素a等。其中水深采用声波反射法测定,盐度和温度采用Sea-Bird CTD测定,pH采用pH计测定,溶解氧采用碘量滴定法测定,化学需氧量采用酸性高锰酸钾法测定,营养盐采用QuAAtro营养盐流动分析仪测定,悬浮物采用重量法测定,叶绿素a采用萃取荧光法测定。

图1 长江口及邻近海域取样调查站位Fig.1 Location of study area in the Yangtze River Estuary and its adjacent waters,trawl sites of invertebrate surveys in the dotted line area
1.2 数据处理
无脊椎动物资源量(丰度和生物量)采用以下公式计算[24]:

其中:R表示资源量;y表示平均每小时拖网的捕获量;a表示平均每小时拖网的扫海面积;q表示可捕系数;可捕系数定为0.6。
采用 Margalef物种丰富度指数(D)、Shannon-Wiener多样性指数(H′)以及Pielou均匀度指数(J′)来计算无脊椎动物群落多样性[25-27]。
Margalef丰富度指数:D=(S-1)/lnn,
Shannon-Wiener多样性指数:H′=-∑PilnPi,
Pielou均匀度指数:J′=H′/lnS,
式中:S为种类数;n为总丰度;Pi为第i种无脊椎动物丰度占总丰度的比例。
在进行群落结构分析之前,将出现总频率小于5%的物种从丰度-站位数据矩阵去除[28],以减少稀有种效应。构建Bray-Curtis相似性系数矩阵,数据经过四次方根转化,采用等级聚类分析(CLUSTER)和非参数的多维标度排序(NMDS)研究长江口及邻近海域无脊椎动物群落结构。t检验分析不同组群间资源量以及多样性指数差异的显著性。采用单因子相似性分析(ANOSIM)研究不同组群之间差异的显著性。应用相似性百分比(SIMPER)分析造成各组群内群落结构相似的典型种和各组群间群落结构相异的分歧种[29]。采用典型对应分析(CCA)研究群落结构与环境因子之间的关系[30]。
群落结构分析采用 PRIMER 5.0软件[31],CCA 排序采用CANOCO 4.5软件,站位图的绘制采用Surfer 8.0软件,t检验采用SPSS软件进行。
2 结果分析
2.1 环境因子
在调查的28种环境因子中,季节差异达到显著性水平(P<0.05)的环境因子包括:表层盐度、表层和底层温度、表层溶解氧、表层和底层pH、表层COD、表层和底层磷酸盐、表层和底层硅酸盐、表层和底层硝酸盐、表层亚硝酸盐、表层和底层总磷以及叶绿素a。可以看出,在长江口及邻近海域大部分环境因子存在季节变异,主要体现在水体温度、盐度、pH、营养盐和初级生产力水平上。

表1 2012年春、秋季长江口及邻近海域的环境因子Table 1 Environmental factors in the Yangtze River Estuary and its adjacent waters in spring and autumn,2012

续表1

表2 2012年春、秋季长江口及邻近海域无脊椎动物的丰度和生物量(出现总频率大于5%)Table 2 Abundance and biomass of invertebrates in the Yangtze River Estuary and its adjacent waters during spring and autumn in 2012(total frequency>5%)
2.2 无脊椎动物种类组成和资源量
长江口及邻近海域春、秋季调查中共捕获无脊椎动物5目14科25种。其中,节肢动物甲壳纲种类最多(2目7科16种),占总种类数的64%,软体动物头足纲次之(3目6科8种),占32%。不同季节捕获的无脊椎动物种类数略有差异:春季捕获17种,秋季捕获19种。其中,春季和秋季均出现的无脊椎动物有4目7科11种,占总种类数的44%。春、秋季长江口及邻近海域无脊椎动物种类数量差异不大,秋季略高于春季。
表2显示2012年长江口及邻近海域无脊椎动物的丰度和生物量。春季的总丰度和生物量均高于秋季,但季节差异均不显著(P>0.05)。春季,丰度贡献最大的为脊腹褐虾(Crangonaffinis),占总丰度的78.49%;生物量较高的有细点圆趾蟹(Ovalipespunctatus)和脊腹褐虾,占总生物量的42.77%和31.31%。秋季,三疣梭子蟹(Portunustrituberculatus)丰度和生物量远高于其他种类,分别占总丰度和总生物量的42.59%和75.85%,其丰度是排名第2的鹰爪虾(Trachypenaeuscurvirostris)的2.33倍,生物量是排名第2的红线黎明蟹(Matutaplanipes)的10.09倍。
长江口及邻近海域无脊椎动物资源量的季节差异不显著,但季节间资源量贡献最大的种类有演替现象,这说明长江口春季和秋季无脊椎动物种类组成和分布存在季节差异。
2.3 无脊椎动物群落多样性
图2显示长江口及邻近海域春、秋季无脊椎动物群落多样性。可以看出,D值和H′值春季较秋季略高,J′值春季较秋季略低。各站次的Margalef丰富度指数D值的均值为1.05,范围在0.31~2.02之间。Shannon-Wiener多样性指数H′值的均值为1.02,范围在0.37~1.92之间。Pielou均匀度指数J′的均值为0.58,范围在0.17~0.95之间。t检验显示春季D值、H′值以及J′值与秋季均无显著性差异(P>0.05)。可以看出,长江口及邻近海域无脊椎动物多样性的季节变异不显著。
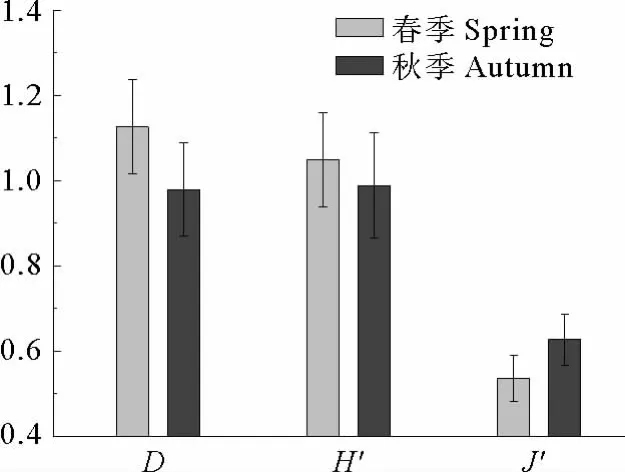
图2 长江口及邻近海域春、秋季无脊椎动物群落多样性(平均值±标准误差)Fig.2 Diversity of invertebrate community in the Yangtze River Estuary and its adjacent waters during spring and autumn(Mean±Error)
2.4 无脊椎动物群落结构
图3显示等级聚类分析(CLUSTER)和非度量多维标度排序(NMDS)群落结构划分结果。可以看出,2种方法给出的群落结构较为一致(见图3)。长江口及邻近海域春、秋季无脊椎动物群落可分为春季组和秋季组2个季节组群。春季组包括所有春季站位,秋季组包括所有秋季站位。春季组和秋季组之间的无脊椎动物组成的平均相异性为72.67%。ANOSIM分析表明,春季组和秋季组群落之间差异极显著(R=0.68,P<0.01)。由此可见长江口无脊椎动物群落结构存在显著的季节变异。

图3 长江口及邻近海域春、秋季无脊椎动物群落等级聚类图(左)和NMDS图(右)Fig.3 Hierarchical clustering plot(left)and NMDS plot(right)of invertebrate community in the Yangtze River Estuary and its adjacent waters during spring and autumn
表3列出了在长江口及邻近海域春、秋季无脊椎动物群落中,对组内相似性和组间相异性贡献超过5%的物种及其贡献率。春季组的典型种有葛氏长臂虾(Palaemongravieri)、三疣梭子蟹、细点圆趾蟹、鹰爪虾、脊腹褐虾、双喙耳乌贼(Sepiolabirostrat)、双斑蟳(Charybdisbimaculata)和日本枪乌贼(Loligojaponica),它们对组内平均相似性贡献达96.9%。秋季组的典型种有三疣梭子蟹、口虾蛄(Oratosquillaoratoria)、日本枪乌贼、红线黎明蟹,双斑蟳和中华管鞭虾(Solenoceracrassicornis),对组内平均相似性贡献达93.5%。春季组和秋季组间的分歧种包括葛氏长臂虾、脊腹褐虾、细点圆趾蟹、鹰爪虾、双喙耳乌贼、口虾蛄、日本枪乌贼、双斑蟳和三疣梭子蟹,对组间平均相异性贡献达89.9%。春季组与秋季组典型种的差异表明长江口及邻近海域无脊椎动物群落的季节演替剧烈。

表3 长江口及邻近海域春、秋季无脊椎动物群落组内典型种和组间分歧种及其贡献率(>5%)Table 3 Typifying species within groups/discriminating species between groups and their contribution percentage for invertebrate assemblage in the Yangtze River Estuary and its adjacent waters during spring and autumn(>5%)
2.5 与环境因子的关系
对春季无脊椎动物物种-丰度矩阵进行去趋势对应分析(DCA),梯度长度的最大值为3.294SD,选用非线性的CCA排序方法探讨群落结构与环境因子的关系。28个环境因子经过forward筛选(使用Monte-Carlo检验来测试每个环境因子的重要性和显著性,以P<0.05来作为显著性标准)后,保留4个环境因子,按其解释比例的大小依次为:表层磷酸盐、底层溶解氧、底层硅酸盐、底层硝酸盐。利用4个环境因子进行CCA排序,结果显示,前4个轴共解释了物种变异的43.8%。所有28个环境因子的特征值之和为2.116,保留的4个环境因子的典范特征值之和为0.926,保留的可解释差异占物种数据中差异的43.76%。
环境因子的解释能力体现在CCA轴的双序图得分(负载值)上(见表4),在CCA第1轴上负载最高的是表层磷酸盐和底层硅酸盐(其负载值分别为0.921 3和0.733 8),第2轴为底层溶解氧(-0.883 1),第3轴为底层硝酸盐(-0.930 1)。可以看出,引起长江口及邻近海域春、秋季无脊椎动物群落结构时空变化的主要环境要素为表层磷酸盐、底层溶解氧、底层硅酸盐、底层硝酸盐。
图4为长江口及邻近海域无脊椎动物与环境因子的CCA排序结果。可以看出,春、秋季站位区分明显(见图4a)。春季组的站位多分布CCA排序图的左侧。其中3、4、8、13、14、42和43站在底层硝酸盐分布较高的区域,这些站点位于调查海域的北部,其代表种为脊腹褐虾(见图4b),占该站组总丰度的85.3%;20、26、27、33和34站在底层溶解氧分布较低的区域,位于调查海域的南部,其代表种为葛氏长臂虾,占该站组总丰度的68.1%。秋季组站位均分布在CCA排序图的右侧。其中,2、3、4、6、7、8和14站与表层磷酸盐和底层硅酸盐均有较大的正相关性,分布在调查海域的北部,其代表种为三疣梭子蟹,占该站组总丰度的67.1%;19、20、27、33和34站与底层溶解氧有很大的负相关性,分布在调查海域的南部,其代表种为鹰爪虾和日本枪乌贼,分别占该站组总丰度的41.5%和38.8%。可以看出,在调查海域南部,春季组和秋季组站点均有较低的底层溶解氧浓度,这对无脊椎动物的分布有强烈影响,以至于在该海域其他环境因子均成为非限制性因子;在调查海域北部,春季组站点受底层硝酸盐浓度影响,秋季组站点受表层磷酸盐和底层硅酸盐浓度的影响较大。
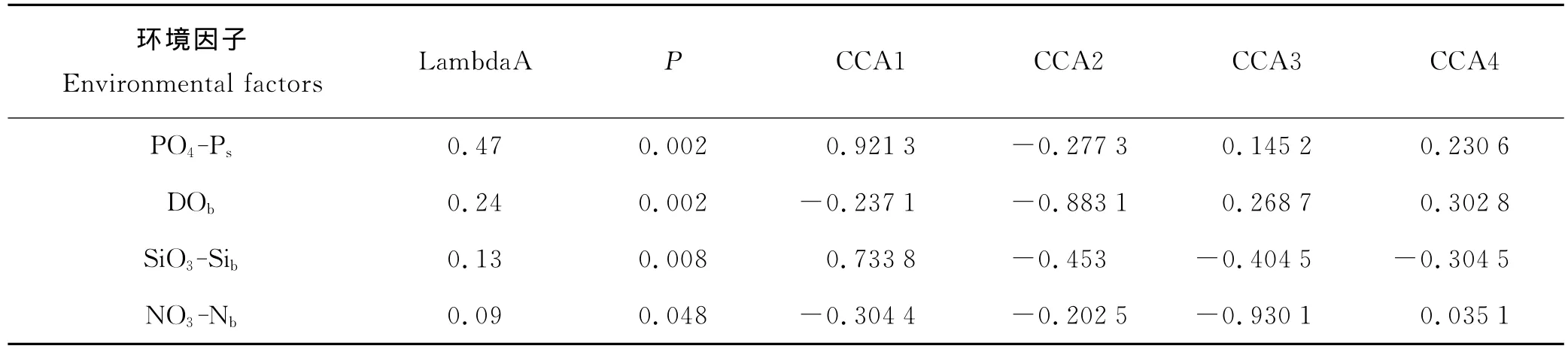
表4 环境因子的条件效应及其在CCA轴上的负载值Table 4 Conditional effects and CCA loadings of environmental factors

图4 长江口及邻近海域春、秋季无脊椎动物群落的CCA排序Fig.4 CCA ordination of invertebrate community in the Yangtze River Estuary and its adjacent waters during spring and autumn
除了不同季节不同海区的代表种受环境因子影响外,其它无脊椎动物的分布受环境因子限制(见图4b)。如春季组的典型种细点圆趾蟹和双喙耳乌贼均与底层硝酸盐有很大的正相关性,分布在排序图的第3象限。秋季组的典型种口虾蛄和红线黎明蟹均与表层磷酸盐和底层硅酸盐有很大的正相关性,分布在排序图的第4象限。其它如双斑蟳和中华管鞭虾等均与底层溶解氧有一定的负相关性,分布在排序图的第1、2象限。
3 讨论
3.1 无脊椎动物种类组成和资源量
长江口及邻近海域环境复杂,径流充沛,受苏北沿岸流、台湾暖流、长江径流以及黄海冷水团的影响,饵料充足,是多种鱼类和无脊椎动物的产卵场和索饵场。1980年代,长江口海区春、秋季共捕获无脊椎动物26种[21]。本次调查共捕获无脊椎动物25种,仅比1980年代少1种。
1980 年代,长江口春季无脊椎动物资源量贡献最大的种类为细点圆趾蟹和三疣梭子蟹[32],2012年春季虾类资源对无脊椎动物资源贡献最大,细点圆趾蟹和三疣梭子蟹占总资源量量的比例较1980年代均有所下降。2012年秋季无脊椎动物资源量最大的种类为三疣梭子蟹,这与1980年代秋季的调查结果一致[32]。可以看出,与1980年代相比,2012年长江口春季无脊椎动物资源占优势的种类发生演替,三疣梭子蟹在长江口秋季无脊椎动物资源中占据重要地位。
1986 年春季长江口无脊椎动物资源丰度为52.30 kN/km2,生物量仅为1 498.06kg/km2。本研究中,2012年春季长江口无脊椎动物丰度和生物量分别为58.56kN/km2和152.14kg/km2。可以看出,与1980年代相比,2012年春季长江口无脊椎动物资源丰度变化不大,但生物量仅为1980年代的10%。秋季,2012年长江口无脊椎动物丰度和生物量分别为1985年秋季(分别为30.37kN/km2和1 332.05kg/km2)15.7%和8.6%。可以看出,2012年秋季长江口无脊椎动物资源量严重萎缩。
根据相建海等[32]对长江口无脊椎动物生态类型的划分,细点圆趾蟹属于外侧高盐海水类型,是与三疣梭子蟹混栖的暖水性蟹种,每年5~6月为繁殖盛期。细点圆趾蟹是作为1980年长江口无脊椎动物优势度最高种类,春季生物量高达873.56kg/km2,2012年以后细点圆趾蟹种群在长江口水域分布迅速减少。三疣梭子蟹是长江口海区的常年定居种,属低盐海水类型[32],2012年春、秋季均被捕获。在本次调查中,三疣梭子蟹丰度的季节差异不显著,而生物量秋季显著高于春季,说明秋季三疣梭子蟹平均个体较大。由于本调查的站点主要位于122°30′E与123°30′E之间,底层盐度在32左右,因此捕获的主要种类为外侧高盐海水类型的种类,包括细点圆趾蟹、脊腹褐虾和鹰爪虾等,以及对盐度变化有较强适应能力的低盐海水类型的种类,包括三疣梭子蟹和葛氏长臂虾等。
3.2 无脊椎动物群落结构
长江口及邻近海域无脊椎动物群落结构(本研究所得数据采用渔业资源拖网方式获得,故其群落结构与定量采泥所得数据会有较大差异)存在显著的季节演替现象,无脊椎动物群落在时间上的异质性表现为群落典型种的差异性。春季组的典型种主要以葛氏长臂虾、三疣梭子蟹、细点圆趾蟹、鹰爪虾和脊腹褐虾为主,秋季组的典型种主要以三疣梭子蟹、口虾蛄和日本枪乌贼为主。绝大多数的组内典型种同时是组间分歧种,像三疣梭子蟹、葛氏长臂虾和脊腹褐虾等,这些种类同时又是不同季节群落资源量占优势的种类。
长江口无脊椎动物季节演替剧烈,演替过程中物种组成发生了较大变化,然而多样性的季节变异并不显著,总丰度和生物量的季节差异亦不显著。造成这种现象的主要原因是春季和秋季优势种类组成差异较大(春季占优势的种类为脊腹褐虾、细点圆趾蟹,秋季为三疣梭子蟹,表2),而其它常见类群的物种数目和资源量并没有较大差异。
3.3 与环境因子的关系
本研究结果显示,营养盐和溶解氧是长江口无脊椎动物群落结构季节变异重要环境驱动因素。受长江径流、苏北沿岸流等的影响,长江口及邻近海域磷酸盐、硅酸盐和硝酸盐等营养盐输入丰富。硝酸盐和磷酸盐对群落的影响反映出海域不同氮、磷浓度对群落的影响。生长速率假说(Growth Rate Hypothesis)指出环境中氮、磷的不同浓度变化会影响生物体的生长速率,从而影响种群的分布特征[33-36]。Hessen等多样性发现不同浓度的氮、磷会影响萼花臂尾轮虫(Brachionuscalyciflorus)体内 RNA 的反应[37]。Boersma等提出高磷的无脊椎动物捕食者可能受到食草的浮游动物体内磷消耗的影响[38]。研究证明,一种乌贼(Sepiaofficinalis)的幼体和一种枪乌贼(Loligoopalescens)的幼体的生长率与磷需求有关[39]。这些都说明了水体和食物中营养盐的状态对于浮游动物和大型无脊椎动物幼体有重要影响,而对无脊椎动物成体有多大影响的报道并不多见。吴强等[23]研究长江口无脊椎动物群落时发现无脊椎动物的密度与有机磷有极显著的相关性。本研究发现,影响长江口无脊椎动物群落季节演替的主要环境因素包括表层磷酸盐,底层硅酸盐和底层硝酸盐。但具体的影响机理尚不清楚,一方面可能是由于水体中营养盐状态影响浮游植物体内氮、磷含量及比例,进而通过食物链的上行效应对无脊椎动物产生影响,另一方面可能是水体中的营养盐状态对无脊椎动物成体产生直接影响,进而而促进了群落之间的季节演替。
在过去50年的研究中,东海溶解氧的最低浓度在不断下降[42]。国内的学者很早就发现长江口海域存在季节性的低氧区[43-44]。在靠近本研究调查海域南部的123°59′E,30°51′N的海域在1999年8月溶解氧浓度为1mg/L,在2006年夏季甚至下降至0.94mg/L[45-46]。许多鱼类在在溶解氧到达2mg/L之前会逃走或死亡[47]。但也有例外,如在东海近岸海域,六丝钝尾鰕虎鱼(Amblychaeturichthyshexanema)在低氧条件下反而成为群落优势种[42];在纳米比亚近海,双须多棘鰕虎鱼(Sufflogobiusbibarbatus)在低氧条件下依然正常生活[48]。本研究发现,位于调查海域南部的站点(包括春季站点和秋季站点)与底层溶解氧均有一定的负相关性,这可能是由于南部站点的低氧环境导致捕食者减少,有竞争关系的鱼类种类减少以及有机质饵料增加所导致。日本枪乌贼、双斑蟳、鹰爪虾、中华管鞭虾等与底层溶解氧也有一定的负相关性,说明这些种类较其他无脊椎动物种类耐受相对的低氧环境。
[1]罗秉征,沈焕庭.三峡工程与河口生态环境[M].北京:科学出版社,1994.
[2]沈焕庭,朱建荣,吴华林.长江河口陆海相互作用界面[M].北京:海洋出版社,2009.
[3]李建生,李圣法,任一平,等.长江口渔场渔业生物群落结构的季节变化[J].中国水产科学,2004,11(5):432-439.
[4]俞存根,宋海棠,姚光展.东海蟹类的区系特征和经济蟹类资源分布[J].浙江海洋学院学报:自然科学版,2003,22(2):108-113.
[5]俞存根,宋海棠,姚光展.东海大陆架海域蟹类资源量的评估[J].水产学报,2004,28(1):41-46.
[6]宋海棠.东海虾类的生态群落与区系特征[J].海洋科学集刊,2002,44:124-133.
[7]叶孙忠,张壮丽,洪明进,等.东海南部海域虾类种类组成及数量分布特点[J].海洋渔业,2009,31(3):231-236.
[8]阙江龙,康 伟,徐兆礼,等.苏北浅滩中部海域春秋季口足目和十足目虾类分布特征[J].海洋渔业,2012,34(3):301-307.
[9]李圣法,严利平,李惠玉,等.东海区头足类群聚空间分布特征的初步研究[J].中国水产科学,2007,13(6):936-944.
[10]覃涛,俞存根,陈全震,等.舟山渔场及邻近海域头足类(Cephalopod)种类组成和数量分布[J].海洋与湖沼,2011,42(1):124-130.
[11]徐开达,朱文斌,李鹏飞,等.东海北部浅海渔场头足类的数量分布[J].浙江海洋学院学报:自然科学版,2008,27(1):27-31.
[12]俞存根,虞聪达,宁 平,等.浙江南部外海头足类种类组成和数量分布[J].海洋渔业,2009,31(1):27-33.
[13]邓景耀,朱金声,程济生,等.渤海主要无脊椎动物及其渔业生物学[J].海洋水产研究,1988,9:91-120.
[14]吴耀泉.莱州湾主要无脊椎动物资源及其群聚多样性特征[J].海洋与湖沼,1995,26(6):606-609.
[15]程济生.黄海无脊椎动物资源结构及多样性[J].中国水产科学,2005,12(1):68-75.
[16]吴强,王俊,金显仕,等.中国北部海域主要无脊椎动物群落结构及多样性[J].中国水产科学,2011,18(5):1152-1160.
[17]陈晓娟,薛莹,徐兵锋,等.胶州湾中部海域秋,冬季大型无脊椎动物群落结构及多样性研究[J].中国海洋大学学报:自然科学版,2010,40(3):78-84.
[18]俞存根,宋海棠,姚光展.东海蟹类群落结构特征的研究[J].海洋与湖沼,2005,36(3):213-220.
[19]郑献之,俞存根,陈小庆,等.舟山渔场及邻近海域蟹类种类组成和时空分布[J].海洋与湖沼,2012,43(1):147-153.
[20]叶孙忠.闽南、台湾浅滩渔场蟹类种类组成及分布特征[J].海洋渔业,2004,26(4):249-254.
[21]刘瑞玉,相建海,吴耀泉,等.三峡工程对长江口区无脊椎动物资源影响的预测[J].海洋科学集刊,1992,33:249-264.
[22]吴强,李显森,王俊,等.长江口及邻近海域无脊椎动物群落结构及其生物多样性研究[J].水生态学杂志,2009,2(2):73-79.
[23]吴强,王俊,袁伟,等.长江口及邻近海域大型无脊椎动物数量分布及其与环境因子的关系[J].渔业科学进展,2011,32(5):10-16.
[24]杨纪明,杨伟祥,郭如新,等.1983年夏季渤海上层鱼类生物量的估计[J].海洋科学,1986,1:13.
[25]Margalef R.Information theory in ecology[J].General Systematics,1958,3:36-71.
[26]Pielou E C.Ecological Diversity[M].New York:Wiley,1975.
[27]Shannon C E,Weaver W.The Mathematical Theory of Communication[M].Illinois:Urbana University of Illinois Press,1948:125.
[28]Almeida C,Coelho R,Silva M,et al.Use of different intertidal habitats by faunal communities in a temperate coastal lagoon[J].Estuarine Coastal and Shelf Science,2008,80(3):357-364.
[29]Clarke K R.Non-parametric multivariate analyses of changes in community structure[J].Australian Journal of Ecology,1993,18(1):117-143.
[30]张金屯.数量生态学[M]北京:科学出版社,2004.
[31]Clarke K R,Warwick R M.Change in marine communities:An approach to statistical analysis and interpretation [M]:Plymouth:Natural Environment Research Council,1994:144.
[32]相建海,吴耀泉,张宝琳.无脊椎动物:三峡工程与河口生态环境 [M].北京:科学出版社,1994.
[33]Elser J,O'brien W,Dobberfuhl D,et al.The evolution of ecosystem processes:growth rate and elemental stoichiometry of a key herbivore in temperate and arctic habitats[J].Journal of Evolutionary Biology,2000,13(5):845-853.
[34]Elser J,Sterner R,Gorokhova E,et al.Biological stoichiometry from genes to ecosystems[J].Ecology Letters,2000,3(6):540-550.
[35]Elser J,Acharya K,Kyle M,et al.Growth rate-stoichiometry couplings in diverse biota[J].Ecology Letters,2003,6(10):936-943.
[36]苏强.生长速率假说及其在浮游动物营养动力学中的研究进展[J].地球科学进展,2012,27(11):1204-1210.
[37]Hessen D,Jensen T,Kyle M,et al.RNA responses to N-and P-limitation;reciprocal regulation of stoichiometry and growth rate in Brachionus[J].Functional Ecology,2007,21(5):956-962.
[38]Boersma M,Aberle N,Hantzsche F M,et al.Nutritional limitation travels up the food chain[J].International Review of Hydrobiology,2008,93(4-5):479-488.
[39]Gillooly J F,Allen A P,Brown J H,et al.The metabolic basis of whole-organism RNA and phosphorus content[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(33):11923-11927.
[40]Diaz R J.Overview of hypoxia around the world[J].Journal of Environmental Quality,2001,30(2):275-281.
[41]Grall J,Chauvaud L.Marine eutrophication and benthos:the need for new approaches and concepts[J].Global Change Biology,2002,8(9):813-830.
[42]Chang N N,Shiao J C,Gong G C.Diversity of demersal fish in the East China Sea:Implication of eutrophication and fishery[J].Continental Shelf Research,2012,47:42-54.
[43]Limeburner R,Beardsley R C,Zhao J.Water masses and circulation in the East China Sea[C].Proceedings of International Symposium on Sedimentation on the Continental Shelf,with Special Reference to the East China Sea.Beijing:China Ocean Press,1983:285-294.
[44]顾宏堪.黄海溶解氧垂直分布的最大值[J].海洋学报1980,2:007.
[45]Li D,Zhang J,Huang D,et al.Oxygen depletion off the Changjiang(Yangtze River)estuary[J].Science in China Series D:Earth Sciences,2002,45(12):1137-1146.
[46]Shan X J,Jin X S,Yuan W.Fish assemblage structure in the hypoxic zone in the Changjiang(Yangtze River)estuary and its adjacent waters[J].Chinese Journal of Oceanology and Limnology,2010,28:459-469.
[47]Vaquer-Sunyer R,Duarte C M.Thresholds of hypoxia for marine biodiversity[J].Proceedings of the National Academy of Sciences,2008,105(40):15452-15457.
[48]Utne-Palm A C,Salvanes A G,Currie B,et al.Trophic structure and community stability in an overfished ecosystem[J].Science,2010,329(5989):333-336.

