青岛近海多棘海盘车繁殖生物学的初步研究*
张秀梅,李淑芸,刘 佳,吴桑桑,李文涛
(中国海洋大学水产学院,山东 青岛 266003)
多棘海盘车(Asteriasamurensis)俗称海星,隶属于棘皮动物门(Echinodermata)、海星纲(Asteroidea)、钳棘目(Forcipulatida)、海盘车科(Asteriidae)、海盘车属(Asterias),广泛分布于北太平洋和澳大利亚沿海,为我国黄渤海习见种[1]。其喜食贝类,是底栖生物群落中重要的捕食者,大量聚集时对扇贝、魁蚶、牡蛎、鲍鱼等贝类养殖和底播增殖造成严重危害[2-5]。国内外对海盘车属生物种类繁殖方面的研究主要集中在受精作用的顶体反应[6]及激活机制[7-8]、环境因素对受精、胚胎发育的影响[9-10]以及配子的超微结构[11]等方面,对多棘海盘车性腺发育、繁殖规律的研究仅见于日本、俄罗斯、澳大利亚等少数报道[3,12-14],且研究结果不尽一致。俄罗斯彼得大帝湾的多棘海盘车一年繁殖2次,日本沿海和澳大利亚近海的种类一年繁殖1次,而我国沿海多棘海盘车的周年内繁殖规律还未见报道。本实验对逐月采集的多棘海盘车样本,采用常规生物学测定、解剖观察、组织学切片等方法,研究不同发育时期的性腺结构变化及配子发育特征,研究结果将丰富海星繁殖生物学基础资料,为贝类底播增养殖和人工鱼礁区敌害生物防除提供基础数据。
1 材料与方法
1.1 实验样本及环境数据收集
实验所用的多棘海盘车样本为2011年6月~2012年5月在青岛浮山湾(36°01′N~36°04′N,120°22′E~120°68′E)沿岸海域潜水随机采捕。浮山湾位于胶州湾东侧,东临燕儿岛,西至太平角,湾口向南为黄海。每月取样1次,每次取30~60只,繁殖期10~15d取样1次,每次取样10~30只,共取样525只。各月海水表层水温数据来源于青岛市海洋与渔业局海洋水文预报(http://ocean.qingdao.gov.cn),日照长度数据来源于日出日落时刻查询网站(青岛地区)观测数据(http://sunrise.supfree.net)。
1.2 实验方法
1.2.1 形态学测定 样本运回实验室后放至水族箱内,待腕完全伸展后进行实验。多棘海盘车结构示意图见图1。用游标卡尺和电子天平分别测定辐径、间辐径、体高(精确到0.01mm)、体重(精确到0.01g)等生物学指标。用解剖剪沿多棘海盘车腹面步带区剪开,并稍稍用力将两侧掰开,露出性腺和消化腺,测量性腺和消化腺长度,用镊子小心取出二者后,分别测定其净重量,并记录性腺的颜色变化及发育状况。
1.2.2 组织切片及显微观察 解剖后取出性腺,Bouin氏液固定。常规石蜡切片后,Nikon Eclipse LV100POL显微镜下观察并拍照。各月分别取雌性、雄性个体各10~15只进行组织学切片,繁殖期内每个样本随机选取30个视野进行拍照,借助测微尺和Image J软件统计每个视野中所有包含细胞核的卵母细胞最大直径。
1.3 数据处理和统计分析
多棘海盘车性腺分期方法主要参照Vevers[16]和Byrne[3]的分期方法。结合性成熟系数法与组织学方法将性腺发育分为6期。其中卵巢(Ovary)的发育分期主要根据卵巢组织学切片上面积比例超过50%或比例相对高的卵母细胞的时相来确定。精巢(Testis)分期主要依据生殖上皮中的生精细胞的组织学特点、内腔中精细胞的数量、血细胞层的发展程度等特点。
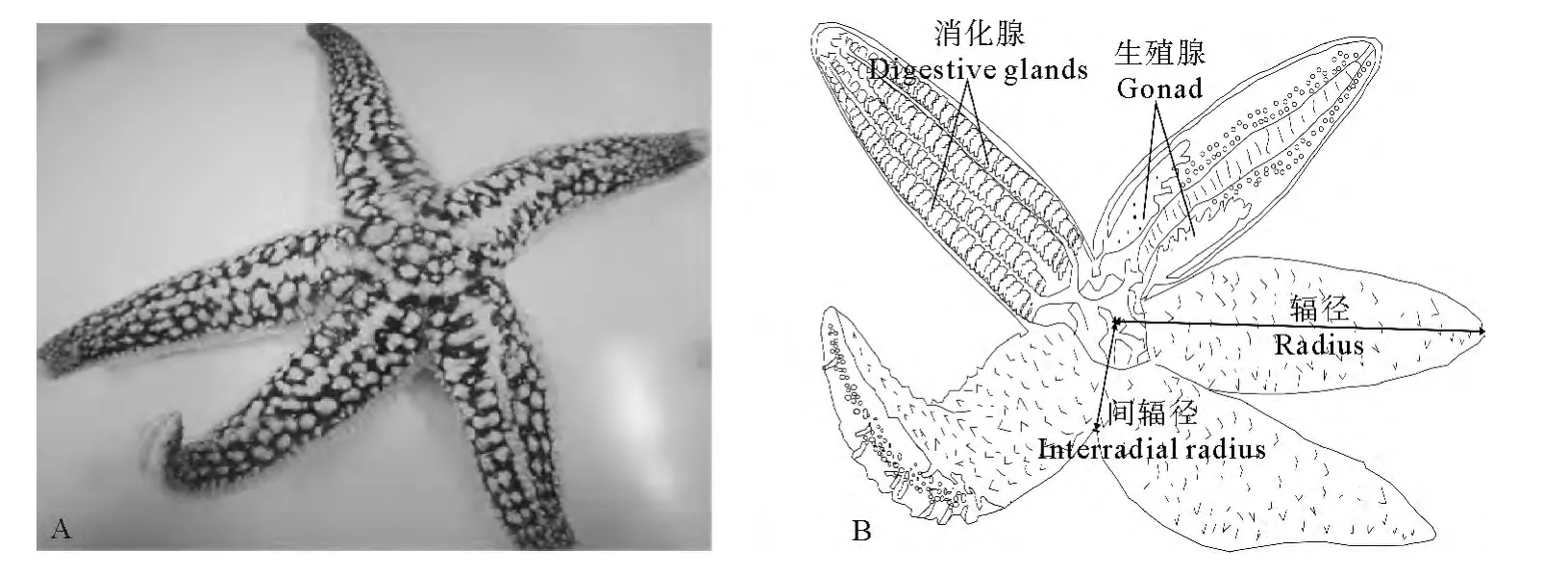
图1 多棘海盘车结构示意图Fig.1 Structure diagram of Asterias amurensis
性成熟系数和消化腺指数计算方法:
性成熟系数(GI)=性腺重量/体重×1000‰;
消化腺指数(PI)=消化腺重量/体重×100%。
所有数据均以平均值±标准误(Mean±SE)表示,利用SPSS17.0统计软件对各月的GI和PI进行单因素方差(one-way ANOVA)统计分析,并对不同月份间的数据进行Duncan多重比较,以P<0.05作为差异显著标准。
2 结果
2.1 卵巢
2.1.1 解剖学特征 多棘海盘车的卵巢包括5对,每腕1对。分枝成葡萄丛状,分别位于间步带区腕的基部两侧。无交配器官,也无其他附属腺体。腕中每个卵巢各有生殖管并以小孔开口于反口面的两腕之间。生殖腺与围血系统的生殖围血窦、反口面环血窦以及反口面神经系统紧密结合在一起。卵巢的体积随季节变化很大,在非生殖季节一般细小,分枝少,且精、卵巢外观相同,不易分辨雌雄。而在生殖季节,卵巢为橙红色,呈葡萄状,膨大、充满体腔,并一直深达腕末端,轻轻挤压卵巢会有淡黄色浆体渗出。
2.1.2 卵巢发育分期及对应的形态特征 多棘海盘车的卵巢结构是海盘车科的典型结构,由内、外2层囊状结构与生殖腔相分离。双层囊结构在产卵后以及卵黄发生前期的个体中比较明显,此时,卵巢壁较厚且呈收缩状态。参照 Vevers[16]和 Byrne[3]的分期方法,根据多棘海盘车卵巢的外观特征、组织学结构特点和性成熟系数等将卵巢发育的周年变化分为6期。除成熟期可以通过外观橙红色及解剖后有浅黄色浆体渗出可以区分雌雄外,其他期的卵巢都需要组织学方法确定雌雄及发育程度。
组织学结构的主要分期特征是卵母细胞的数量、大小、位置和着色情况,核径、核仁数目,卵巢壁的宽度,液泡、卵黄粒、滤泡膜等形态特征,血细胞层的发育程度,吞噬细胞、细胞碎片的存在情况等。卵黄发生前卵母细胞嗜碱性较强,卵黄沉积后卵母细胞逐渐变成嗜伊红性。各期的主要特征如下:
Ⅰ期:卵巢尚未发育。
卵巢透明且小,长度一般小于0.5cm,宽度小于0.15cm。紧贴于间步带区腕基部两侧。
组织学切片显示卵巢中偶见无卵黄的初级卵母细胞(见图2a)。卵母细胞胞质嗜碱性较强,核大染色较深,核质较少。此期一生只经历1次,在幼体多棘海盘车性腺发生时形成。
Ⅱ期:卵巢开始发育或产卵后重新发育。
该时期卵巢不透明,长度一般为0.5~1.5cm,宽度为0.15~0.40cm。
组织学切片显示卵巢外壁较厚,双层结构明显。卵巢内腔可能充满无定形组织,也可能包含嗜伊红细胞碎片和吞噬细胞。一些早期和中期的具有卵黄的卵母细胞可能会出现,整个卵母细胞的外周有一薄层滤泡质。生殖上皮出现褶皱,增加表面积以供大量卵子发生。初级卵母细胞一般不规则排列于卵巢内生殖上皮附近,分布较散。形态不规则,有三角形、梨形、圆形或椭圆形等(见图2b)。卵径约为5.80~13.89μm,平均为(9.56±0.86)μm(见表1)。细胞质颗粒均匀分布,被染成深紫色而显示强嗜碱性。细胞核位于细胞中央,呈圆形或椭圆形。此期卵巢成熟系数为0.31‰~14.94‰,平均为(2.91±0.57)‰。2~8月采集的多棘海盘车卵巢多处于这个时期。
Ⅲ期:卵巢正在成熟。
卵巢逐渐发育,末端逐渐膨大并出现分枝,长度一般为1.5~2.5cm,宽度为0.40~0.60cm。
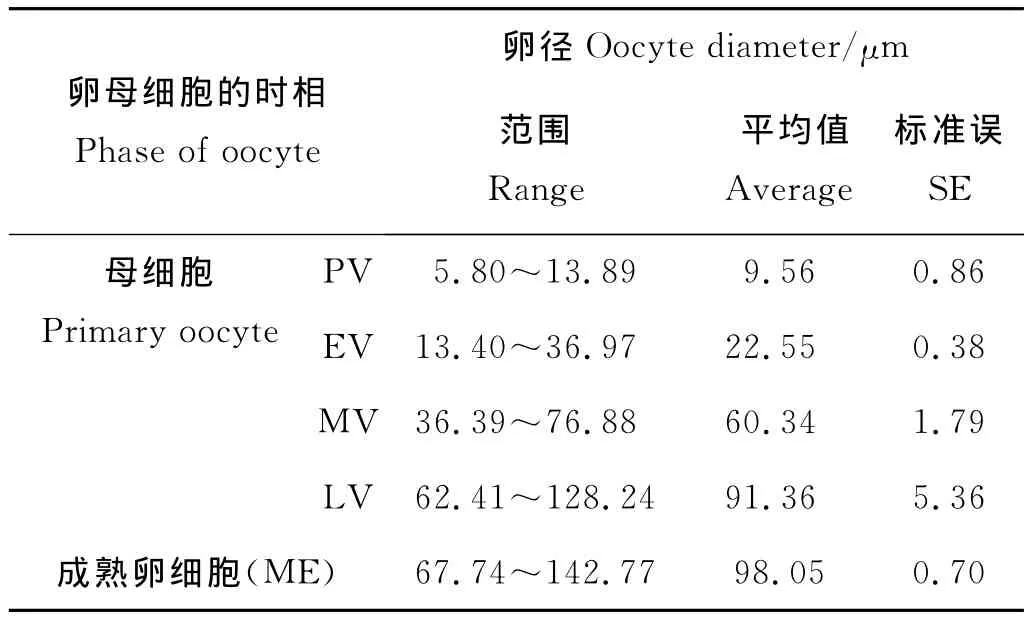
表1 不同时相卵母细胞的直径Table 1 Oocyte diameter at different phases in Asterias amurensis ovaries
组织学切片显示卵母细胞数目明显增多(见图2c),生发层内出现不同时期的卵母细胞(见图2e)。此时卵黄开始形成和积累。生殖上皮轮廓迂回,血细胞层充满了褶皱的中心,形成血窦,呈明显的嗜伊红性。卵黄形成早期,卵母细胞形状不规则,呈梨形或椭圆形,由卵柄与血细胞层紧密连接,卵径约13.40~36.97μm,平均为(22.55±0.38)μm(见表1)。卵母细胞基部附于滤泡壁膜上,另一侧则明显突入滤泡腔。卵母细胞细胞膜清晰,核大,近球形(见图2d)。卵黄形成中期卵径约36.39~76.88μm,平均为(60.34±1.79)μm(见表1)。卵黄形成后期,卵母细胞因卵黄大量积累体积变得很大,形成成熟的卵细胞,卵径约为62.41~128.24μm,平均卵径为(91.36±5.36)μm(见表1)。卵母细胞大多呈圆球形,外周滤泡膜明显,但形态不一,核大、核内染色质少。卵母细胞在滤泡内成熟时,与卵柄脱离,逐渐向卵巢中央移动。随着成熟的卵母细胞数目增多,卵巢壁逐渐变薄,血细胞层也逐渐变得不明显(见图2e)。该期卵巢成熟系数为2.01‰~128.44‰,平均为(65.03±8.21)‰,8~10月采集的多棘海盘车卵巢多处于这个时期。
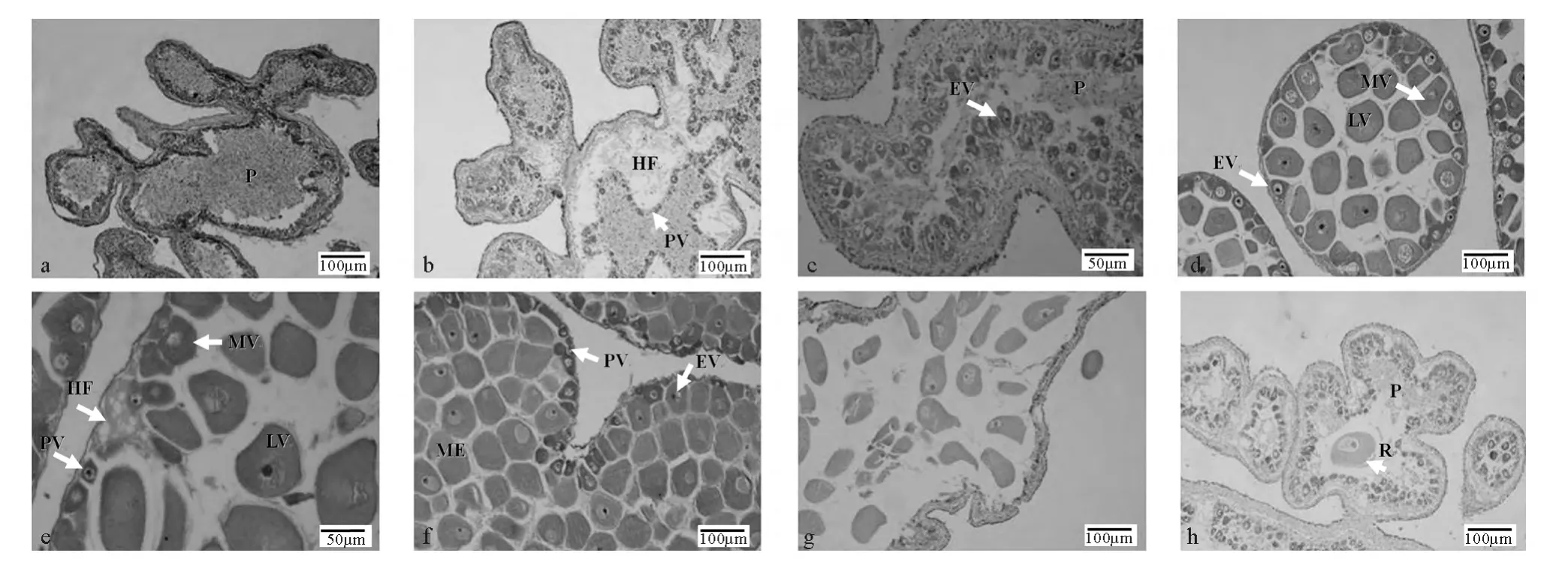
图2 多棘海盘车不同发育时期卵巢的组织学结构Fig.2 Histological structure of ovaries in Asterias amurensis at different stages
Ⅳ期:性腺完全成熟,即将产卵。
卵巢已经很发达,呈橙红色,膨大饱满且分枝较多,有的伸长至腕末端。长度一般长于2.5cm,宽度宽于0.60cm。
切片显示此期卵巢主要特点是卵巢中积聚大量成熟的卵细胞,呈椭圆形或圆球形,卵径为67.74~142.77μm,平均卵径为(98.05±0.70)μm(见表1)。核大、核径约为7.31~10.64μm,平均为(8.65±0.25)μm(见表1)。卵母细胞已从滤泡膜中脱出,成游离状态。生殖上皮周围的初级卵母细胞继续发育,卵巢壁薄且光滑(见图2f)。此期卵巢成熟系数97.17‰~257.07‰,平均(182.80±19.94)‰,10~11月上旬采集的多棘海盘车卵巢多处于这个时期。
Ⅴ期:已部分产卵的卵巢。
卵巢部分开始萎缩,颜色开始变暗,长度一般为1.0~4.0cm,宽度为0.20~0.50cm。
组织切片显示卵巢壁薄。由于成熟卵细胞的排放,剩余的成熟卵母细胞松散地排列于内腔,留有很多空间(见图2g)。在一些雌性个体产卵前期和中期,具卵黄的卵母细胞在生殖上皮继续发育,生成的卵母细胞进入内腔代替已经排出的卵细胞。内腔出现一些残余的卵母细胞碎片和吞噬细胞。此期卵巢成熟系数为6.21‰~285.54‰,平均为(67.04±23.38)‰,11月下旬~12月上旬采集的多棘海盘车卵巢多处于这个时期。
Ⅵ期:产卵后的卵巢。
排完卵的卵巢萎缩、呈棕黄色,体积显著缩小,只占体腔一小部分。长度一般为1.0~2.5cm,宽度为0.15~0.30cm。
组织切片显示卵巢壁增厚,双层囊状结构明显,血细胞层开始扩展并逐渐增厚。内腔含有少量未排出的卵细胞。这些残余的卵细胞中卵黄被消化吸收,逐渐开始衰退。内腔中出现大量的吞噬细胞和细胞残骸(见图2h)。此期卵巢成熟系数0.90‰~15.97‰,平均为(5.21±0.75)‰,12月中旬~1月采集的多棘海盘车卵巢多处于这个时期。
2.2 精巢
2.2.1 解剖学特征 多棘海盘车精巢的形态结构及组成与卵巢类似,无明显区别,非生殖季节精巢细小,分枝少,很难依据颜色与形态辨别出雌雄。成熟精巢呈淡黄或乳白色,因充满精液而膨大,轻轻挤压会有乳白色浆体渗出。
2.2.2 精巢发育分期及对应的形态特征 多棘海盘车精巢中生殖细胞的存在状态也可以分为6个时相。根据精巢的外观特征、组织学结构特点和成熟系数等将精巢发育的周年变化分为6期。除成熟期可以通过外观的淡黄或乳白色及解剖后有乳白色浆体渗出可以区分雌雄外,其他期的精巢都需要组织学方法来确定雌雄及精巢发育程度。组织学结构的主要依据是生殖上皮中生精细胞的组织学特点、内腔中精细胞的数量、血细胞层的发展程度,随着精巢的发育,嗜碱性逐渐增强。与卵巢一样,精巢同样具有海盘车科性腺典型的双层囊状结构。精巢各期的主要特征如下:
Ⅰ期:精巢尚未发育。
精巢呈透明锥状,长度一般小于0.5cm,宽度小于0.15cm。
组织学切片显示精巢中有许多精原细胞,胞质嗜碱性较强,核大染色深。Ⅰ期精巢在幼体性腺发生时形成,一生只经历1次(见图3a)。
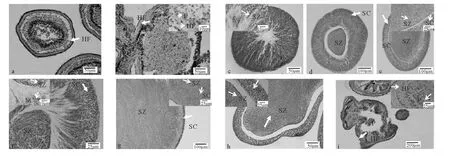
图3 多棘海盘车不同发育时期精巢的组织学结构Fig.3 Histological structure of testes in Asterias amurensis at different stages
Ⅱ期:精巢开始发育或排精后重新发育。
精巢半透明,长度一般为0.5~1.5cm,宽度为0.15~0.35cm。包括初次进入生殖周期的精巢以及繁殖后重新发育的精巢。
组织学切片显示精巢壁增厚,位于生殖上皮的精母细胞嗜碱性强,呈纵队状排列。生殖上皮开始出现较多褶皱,表面积增加以供大量的精子发生。褶皱的中心形成血液窦,血细胞层向外扩展,呈显著的嗜伊红性(见图3b)。内腔中可能存在残存的精子。此期精巢成熟系数在0.21‰~22.69‰之间,平均为(3.01±0.89)‰,2~8月期间的多棘海盘车精巢多处于这个时期。
Ⅲ期:精巢正在成熟。
此期精巢逐渐发育,分枝增多。长度一般1.5~2.5cm,宽度0.30~0.50cm。
组织学切片显示精子发生剧烈,纵队状的精原细胞发育经初级精母细胞、次级精母细胞后形成精子。初级精母细胞呈圆形,直径小于精原细胞,细胞核染色深(见图3f)。成熟的精子细胞呈圆形,无明显的细胞质,只含有嗜碱性强的细胞核,成熟后向内腔扩展延伸(见图3d)。生殖上皮褶皱逐渐减少,血细胞层逐渐变得不明显(见图3c)。
Ⅳ期:精巢接近成熟。
此期精巢成熟系数为2.21‰~132.11‰,平均为(51.90±9.28)‰,8~10月采集的多棘海盘车精巢多处于这个时期。
Ⅳ期:精巢完全成熟,即将排精。
精巢饱满,呈淡黄色或乳白色,轻轻挤压表面会有少量乳白色浆液渗出,这是精巢成熟的标志。长度一般长于2.50cm,宽度宽于0.50cm。
组织学切片显示精巢壁薄且光滑,内腔中充满精子,精子大量聚集成涡流状(见图3e)。生殖上皮纵列的精原细胞继续发育,因此尽管繁殖早期可能释放了一部分精子,但精巢仍保留着成熟的外形,且精原细胞层逐渐变薄(见图3g)。此期精巢成熟系数为117.12‰~375.74‰,平均为(189.33±26.86)‰,10~11月采集的多棘海盘车精巢多处于这个时期。
Ⅴ期:部分排精的精巢。
精巢部分开始萎缩,排精后的精巢呈棕黄色,长度一般为1.0~4.0cm,宽度为0.20~0.45cm。
组织切片显示内腔中精子排列稀疏,生殖上皮精原细胞与中央精子团之间会出现间隙(见图3h)。繁殖后期,生殖上皮的精原细胞减少,此期精巢成熟系数19.82‰~290.00‰,平均为(136.00±22.71)‰,11月~12月中旬采集的多棘海盘车精巢多处于这个时期。
Ⅵ期:排精后的精巢。
排精后的精巢萎缩、呈棕黄色,体积缩小,只占体腔一小部分。长度一般为1.0~2.5cm,宽度为0.15~0.30cm。
组织切片显示精巢壁增厚,双层囊状结构明显,血细胞层开始扩展并逐渐增厚。内腔存在少量未排出的精子,出现吞噬细胞(见图3i)。生殖上皮仅有少量精原细胞存在。此期精巢成熟系数1.35‰~32.19‰,平均为(6.03±1.21)‰,12月下旬至次年1月采集的多棘海盘车精巢多处于这个时期。
2.3 性腺发育的月变化
卵巢在2~5月多处于Ⅵ期产卵后的阶段,卵巢中残留的卵母细胞和空滤泡逐渐退化并被消化吸收。6~7月多处于Ⅱ期,8~9月起卵巢开始进入生长发育阶段,Ⅲ期个体逐渐增多,卵巢迅速由Ⅲ期进入成熟Ⅳ期。10~11月出现发育成熟并开始排卵的Ⅴ期个体,12月部分排卵的Ⅴ期个体数达到最大,随着繁殖的进行,产卵后Ⅵ期个体增多,次年2月份达到最大。说明多棘海盘车雌性繁殖高峰期主要集中在10月至次年1月(见图4A)。
精巢在8月开始生长发育,9月Ⅲ期个体数增多,并迅速由Ⅲ期进入成熟Ⅳ期。10月即出现部分排精个体,11月部分排精的Ⅴ期个体数达到最大,随着繁殖的进行,排完精的Ⅵ期个体从12月开始出现,并一直持续至次年2月。说明多棘海盘车雄性繁殖高峰期主要集中在10~12月(见图4B)。
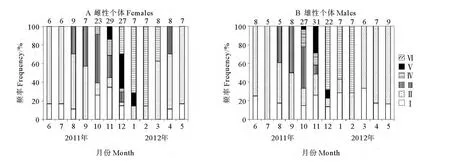
图4 雌性个体卵巢和雄性个体精巢发育的月变化Fig.4 Monthly variation of gonadal development in Asterias amurensis based on the relative frequencies of ovary and testis phrases
2.4 性成熟系数和消化腺指数的周年变化
多棘海盘车雌性在8~9月开始生长发育,10月卵巢迅速生长,成熟系数迅速增加,达到最大(=69.87,SE=14.13;n=23),11月略有下降(=68.28,SE=16.07;n=29)。成熟系数在12月至次年1月急剧下降,2月之后保持较平稳的状态。精巢的成熟系数变化情况与卵巢类似,在10月达到最大(=74.44,SE=12.53;n=27),11月略有下降(=73.27,SE=18.19;n=31),12月至次年1月急剧下降,2月之后大多进入恢复状态,成熟系数略有增加。
雌性和雄性个体消化腺指数有比较明显的周期性特征(见图5)。消化腺指数在周年内呈现双峰变化,7月达到一个峰值,随着性腺开始发育而逐渐减小,雌性个体在10月达到最低(=11.31,SE=0.69;n=23)(见图5),雄性个体在11月达到最低(=9.73,SE=0.60;n=31)(见图5)。性成熟个体繁殖过后,消化腺指数开始逐渐增大。
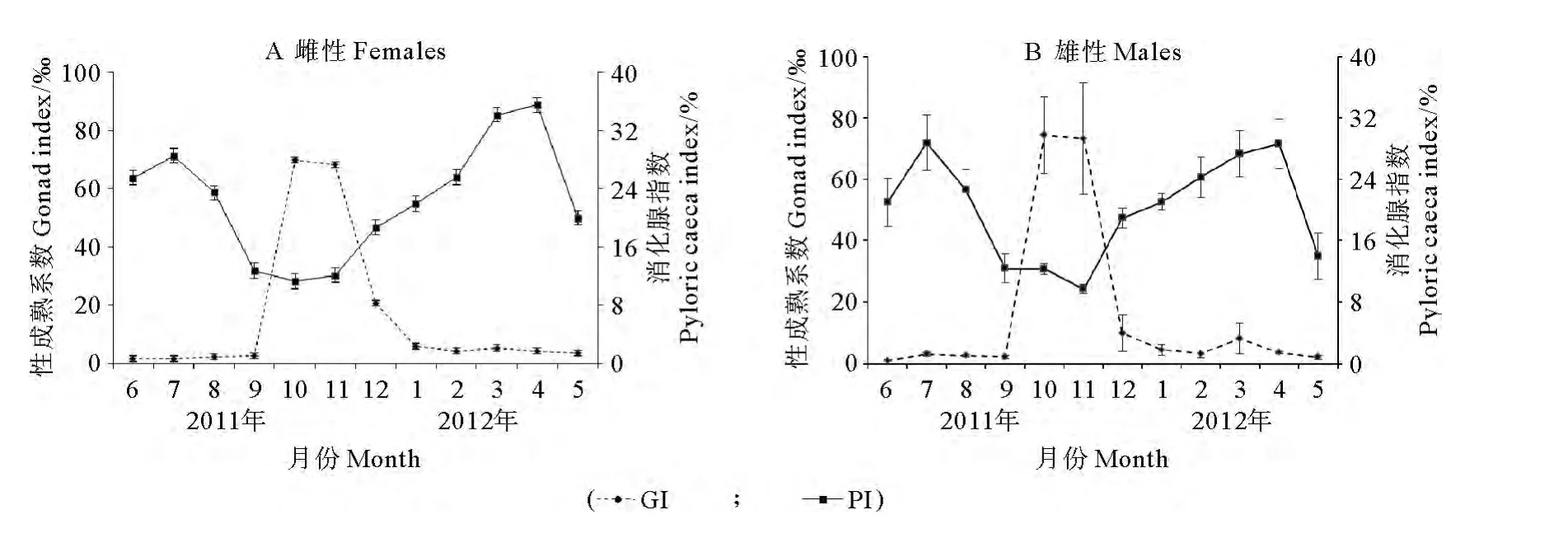
图5 多棘海盘车雌性个体和雄性个体性成熟系数和消化腺指数的月变化Fig.5 Variation of gonad(GI)and pyloric caecal index(PI)between females and males of Asterias amurensis at different months
2.5 性别比例
统计2010年6月~2012年5月可明显辨别雌雄的样本共281个,其中雌性144只,雄性137只(见表2),整体雌雄比约为1.05∶1。χ2检验结果显示与雌雄比1∶1之间无显著差异。
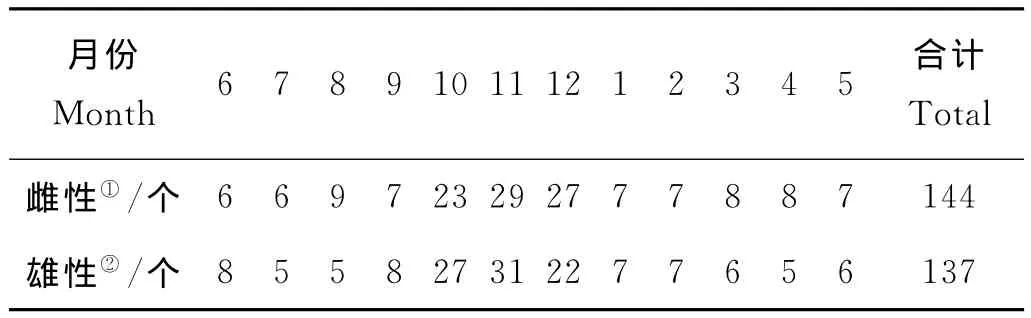
表2 各月雌雄个体数Table 2 Numbers of females and males in different months
3 讨论
3.1 性腺发育分期
多棘海盘车的性腺结构是海盘车科种类的典型结构[17]。繁殖后生殖上皮轮廓曲折,血细胞层在配子形成前以及配子形成过程中循环存在。当配子发育时,血细胞层逐渐变薄,配子排放之后血细胞层增厚,这种特征也是海盘车属种类的典型特征[18-20]。
多棘海盘车性腺发育目前有多种分期方法,Byrne根据卵母细胞细胞核直径大小、卵母细胞内容物的沉积变化和形态特征等将性腺发育分为恢复期、生长期、成熟期、部分产卵期和产卵后期5期[3],Vevers将海星卵巢发育分为休止期、未成熟期、生长期、完全成熟期、排放后期和恢复期6期[16],Kim将多棘海盘车的性腺周年发育共分为7期[13]。Giese和Pearse,Byrne认为性成熟系数法与组织学方法结合起来确定生物繁殖规律有较高的准确性[21]。本文依据性成熟系数及性腺组织学结构特点,主要参照 Vevers[16]和 Byrne[3]的分期方法,将多棘海盘车的性腺发育共分为6期。其中卵巢组织学特征主要根据卵巢组织学切片上面积比例超过50%或比例相对较高的卵母细胞的时相确定,具体通过卵母细胞的卵径、核径、核仁数目等参数指标以及液泡、卵黄粒、滤泡膜等形态特征来确定卵母细胞的形态发育特征。精巢分期的组织学结构主要依据生殖上皮中的生精细胞的组织学特点、内腔中精细胞的数量、血细胞层的发展程度等特点来确定。
3.2 繁殖规律
多棘海盘车为雌雄异体,雌雄个体大小、外观无明显差异,性比接近1∶1,这与棘皮动物门其他雌雄异体的动物一致[22]。Fuji采集了不同海区的虾夷马粪海胆(Strongylocentrotusintermedius)样本,并统计雌雄比例,得出性比约为1∶1[23]。Kim对日本陆奥湾[13]的多棘海盘车样本进行统计,均得出性比为1∶1的结论。本研究中青岛浮山湾多棘海盘车整体雌雄比约为1.05∶1,推测是由于采集数量不足所致,可以认为雌雄性别比例接近1∶1。
不同种类的卵巢内卵子发育状况差异反映出不同的产卵规律,因此形成了不同的产卵类型。产卵类型决定着资源补充的性质,因此与种群数量波动形式有密切关系[24]。以往对海星的研究发现海星卵巢主要是分批产卵型。Byrne研究发现八腕海星(Patiriellacalcar)和小面包海星(P.exigua)2种海星卵径分布频率为双峰型,即分2批进行产卵[21]。Marion等研究发现皇家海星(Astropectenarticulatus)雌性个体产卵时间持续较长,卵巢可以长时间处于发育的状态[25]。Carvalho和Ventura通过对巴西东南部海域海燕(Asterinastellifer)2个群体的繁殖研究发现,不同群体的海燕繁殖规律类似,产卵期较长而且不同步[26]。本研究的组织学观察发现,在繁殖期间随着排卵的进行,多棘海盘车卵巢壁附近仍然持续产生初级卵母细胞,随着成熟卵细胞的排出,初级卵母细胞继续发育成成熟的卵细胞并排出。因此多棘海盘车雌性个体并不是一次性将卵排出,属于多次产卵型。
3.3 繁殖期与环境因素的关系
通常海星的配子形成过程有明显的季节性[27]。季节性变化的环境因素,如海水温度、日照长度及食物的供应情况等,可以影响海星的有性生殖过程[28]。其中水温和食物供应是影响海星繁殖发育最主要的2个因素[29]。
本研究结合性成熟系数法与组织学方法发现多棘海盘车有明显的繁殖周期。一般来说,北半球海盘车科的种类在秋季和冬季配子开始快速发育,春天进行繁殖[30]。日本沿海多棘海盘车(35°N~41°N)在冬季1月份性腺发育最好,冬末或早春(2~5月)当温度为5~12 ℃时开始产卵[13-14]。澳大利亚德文特河河口(42°S)的多棘海盘车性腺发育规律与日本沿海的种类相类似,卵巢在秋、冬季开始发育,春季(7~10月)当底层水温达到10~13℃开始产卵[3]。Novikova研究发现俄罗斯彼得大帝湾的多棘海盘车一年繁殖2次,分别在夏季和秋季(6、9月),表层水温为17和23℃时产卵[12](见表3)。本调查结果发现,青岛滨海水温在8月份达到最高(http://ocean.qingdao.gov.cn),并开始逐月下降,而多棘海盘车在8~9月份性腺开始快速发育。本研究海域多棘海盘车繁殖期集中在10月至次年1月,11~12月为繁殖盛期,此时水温平均为9.6~16.2℃。Pearse和Eernisse研究发现赭石海星(Pisasterochraceus)在4月份温度最高时开始发育,在7月温度较低时开始繁殖,因此,可以认为水温是影响海星配子发育的重要因素之一[31]。

表3 北半球和南半球多棘海盘车繁殖季节的比较Table 3 Comparison of spawning season between northern and southern populations of Asterias amurensis
Pearse和Eernisse研究认为光照周期及强度刺激赭石海星的性腺生长,短日照刺激性腺生长,而长日照可以使得性腺生长受到抑制[30]。这种繁殖受光照影响的模式在其他海星的研究中也有报道,主要包括Sclerasteriasmollis[32],Coscinasteriastenuispina[33]。 本 实验中日照长度自6月开始逐渐缩短,在12月达到最低(http://sunrise.supfree.net),此时多棘海盘车处于繁殖期。Eckelbarger认为光照主要影响卵子中卵黄的发育速度,由多棘海盘车繁殖周期较短的特点可以认为其卵黄形成速度较快,繁殖率高[34]。日照长度和周期也影响海水中浮游植物的生长,秋季和初冬季节浮游植物生长旺盛可为海星浮游幼虫的生长提供食物来源[35]。Pearse和Walker认为在许多海星的繁殖活动中,海水温度和日照长度及周期对海星配子发育起到复杂的协同作用[30]。
3.4 GI与PI关系
多棘海盘车在8~9月开始发育,GI在9月份急剧上升,繁殖季节由于部分配子的释放,GI会同步下降,10月份GI达到最大,11月份略有下降,分析原因可能是由于多棘海盘车繁殖早期伴随着部分配子的释放,性腺继续发育,新形成的配子代替释放的配子,较高的GI意味着配子补充较多、环境营养条件较好[3]。随着配子的大量释放,GI急剧下降。在1~2月性腺处于排放后的恢复期,GI较平稳,直到下一次生殖开始。
海星的储能器官是消化腺[22,36]。充足的食物供应使海星消化腺重量增加,为性腺发育储备能量[27]。由于海星的繁殖期较短,因此需要花费长时间来储备能量以备繁殖时的高能量消耗[37-38]。在整个生殖循环中,PI和 GI之间的负相关关系比较常见[21,28,32,39]。本试验中多棘海盘车PI在7月达到最大,随着8月性腺开始发育PI逐渐降低,而10~11月时开始逐渐升高,说明在性腺发育期间消化腺为性腺发育提供了能量,在繁殖结束后开始储备能量以备下一次生殖周期利用。
综上所述,青岛浮山湾地区与日本、澳大利亚沿海的多棘海盘车有类似的繁殖规律,雌雄异体,性比1∶1,均在水温开始下降的秋、冬季节开始繁殖,冬末或早春开始幼体发育。海水温度及日照长短会影响性腺发育。在不同的发育时期,性腺含有不同时相的卵母细胞、精母细胞。整体来看,性腺生长期间,消化腺为其提供能量,性成熟系数和消化腺指数在一周年内呈负相关关系。
[1]杨德渐,孙世春.海洋无脊椎动物学[M].青岛:青岛海洋大学出版社,1999:486-496.
[2]O'Hara T.Northern Pacific seastar[J].Vic Nat,1995,112:261.
[3]Byrne M,Morrice M G,Wolf B.Introduction of the northern Pacific asteroidAsteriasamurensisto Tasmania:reproduction and current distribution[J].Mar Bio,1997,127(4):673-685.
[4]Minchin D.Decapod predation and the sowing of the scallop,Pectenmaximus(Linnaeus,1758)[C].//Shumway S E,Sandifer P A.An International Compendium of Scallop Biology and Culture.Baton Rouge:World Aquaculture Society,1991.
[5]Spencer B E.Predators and methods of control in molluscan shelfish cultivation in North European waters[J].EAS Special Publication,1992,16:309-338.
[6]Nakachi M,Moriyama H,Hoshi M,et al.Acrosome reaction is subfamily specific in sea star fertilization[J].Dev Biol,2006,298(2):597-604.
[7]Matsumoto M,Solzin J,Helbig A,et al.A sperm-activating peptide controls a cGMP-signaling pathway in starfish sperm[J].Dev Biol,2003,260(2):314-324.
[8]Nishigaki T,Chiba K,Hoshi M.A 130-kDa membrane protein of sperm flagella is the receptor for asterosaps,sperm-activating peptides of starfishAsteriasamurensis[J].Dev Biol,2000,219(1):154-162.
[9]Lee C H,Ryu T K,Choi J W.Effects of water temperature on embryonic development in the northern Pacific asteroid,Asterias amurensis,from the southern coast of Korea[J].Invertebr Reprod Dev,2004,45(2):109-116.
[10]Lee C H,Ryu T K,Chang M,et al.Effect of silver,cadmium,chromium,copper,and zinc on the fertilization of the Northern Pacific asteroid,Asteriasamurensis[J].B Environ Contam Tox,2004,73(4):613-619.
[11]Lamash N E.Identification and isolation of GTP-binding regulatory protein from starfish(Asteriasamurensis)oocyte plasma membranes[J].Biol Bull,2001,28(1):107-109.
[12]Novikova G P.Reproductive cycles of sea starsAsteriasamurensisandPatiriapectiniferain Peter the Great Bay,sea of Japan[J].Biol Morya Kiev,1979,6:33-40.
[13]Kim Y S.Histological observations of the annual change in the gonad of the starfish,AsteriasamurensisLüken[J].Bull Fac Fish Hokkaido Univ,1968,19(2):97-108.
[14]Hatanaka M,Kosaka M.Biological studies on the population of the starfish,Asteriasamurensis,in Sendai Bay[J].Tohoku J Agric Res,1959,9(3):159-178.
[15]胡泗才,王立屏.动物生物学[M].北京:化学工业出版社,2010:96.
[16]Vevers H G.The biology ofAsteriasRubensL.:growth and reproduction[J].J Mar Biol Assoc UK,1949,28(1):165-187.
[17]Walker C W.Nutrition of gametes[C].//Jangoux M.Echinoderm nutrition.Rotterdam:Balkema,1982.
[18]Schoenmakers H J N,Colenbrander P H J M,Peute J,et al.A-natomy of the ovaries of the starfishAsteriasrubens(Echinodermata)[J].Cell Tissue Res,1981,217(3):577-597.
[19]Kasyanov V L.Reproductive strategies of sea stars from the Sea of Japan[C].Rotterdam:Balkema,1988.
[20]Beijnink F B,Walker C W,Voogt P A.An ultrastructural study of relationships between the ovarian haemal system,follicle cells,and primary oocytes in the sea star,Asteriasrubens[J].Cell Tissue Res,l984,238(2):339-347.
[21]Byrne M.Reproduction of sympatric population ofPatiriellagunii,P.calcarandP.exiguain New South Wales,asterinid seastars with direct development[J].Mar Biol,1992,114:297-316.
[22]Lawrence J M.A functional biology of echinoderms[M].London:Croom Helm,1987:17-96.
[23]Fuji A.Studies on the biology of the sea urchin:II.Size at first maturity and sexuality of two sea urchins,StrongylocentrotusnudusandS.intermedius[J].Bull Fac Fish Hokkaido Univ,1960,11(2):43-48.
[24]陈大刚.渔业资源生物学[M].北京:中国农业出版社,1997:72.
[25]Marion K R,Watts S A,McClintock J B,et al.Seasonal gonad maturation inAstropectenarticulatusfrom the Northern Gulf of Mexico[C].// Mooi R.Echinoderms.Rotterdam:Balkema,1998.
[26]Carvalho A L P S,Ventura C R R.The reproductive cycle ofAsterinastellifera(Mbius)(Echinodermata:Asteroidea)in the Cabo Frio region,southeastern Brazil[J].Mar Biol,2002,141:947-954.
[27]Chia F S,Walker C W.Echinodermata:Asteroidea[J].Reproduction of marine invertebrates,1991,6:301-353.
[28]Lawrence J M.Level,content and caloric equivalents of the lipid,carbohydrate and protein in the body components ofLuidiaclathrata(echinodermata:asteroidean:platyasterida)in Tampa bay[J].J Exp Mar Biol Ecol,1973,11(3):263-274.
[29]Lawrence J M,Ellwood A.Simultaneous allocation of resources to arm regeneration and to somatic and gonadal production inLuidiaclathrata(Say) Echinodermata: Asteroidea)[C].//Yanagisawa T.Biology of Echinodermata.Rotterdam:Balkema,1991.
[30]Pearse J S,Walker C W.Photoperiodic regulation of gametogenesis in a North Atlantic sea star,Asteriasvulgaris[J].Int J Invertebr Reprod Dev,1986,9(1):71-77.
[31]Pearse J S,Eernisse D J.Photoperiodic regulation of gametogenesis and gonadal growth in the sea starPisasterochraceus[J].Mar Biol,1982,67(2):121-125.
[32]Barker M,Xu R A.Population differences in gonad and pyloric caeca cycles of the New Zealand seastarSclerasteriasmollis(E-chinodermata:Asteroidea)[J].Mar Biol,1991,108(1):97-103.
[33]Alves S L S,Pereira A D,Ventura C R R.Sexual and asexual reproduction ofCoscinasteriastenuispina(Echinodermata:Aster-oidea)from Rio de Janeiro,Brazil[J].Mar Biol,2002,140(2):95-101.
[34]Eckelbarger K J.Ultrastructural features of gonads and gametes in deep-sea invertebrates[C].//Young C M,Eckelbarger K J.Reproduction,larval biology,and recruitment of the deep-sea benthos.New York:Col Univ Pre,1994.
[35]Catalina T,Ward P,Rubilar T,et al.Reproductive biology ofCosmasteriaslurida(Echinodermata:Asteroidea)an anthropogenically influenced substratum from Golfo Nuevo,Northern Patagonia(Argentina)[J].Mar Biol,2007,151(1):205-217.
[36]Jangoux M,van Impe E.The annual pyloric cycle ofAsteriasrubensL.(Echinodermata:Asteroidea)[J].J Exp Mar Biol Eco,1977,30(2):165-184.
[37]Ferguson J C.Fatty acid and carbohydrate storage in the annual reproductive cycle ofEchinaster[J].Comp Biochem Phys,1975,52(4):585-590.
[38]Crump R G.Annual reproductive cycles in three geographically separated populations ofPatiriellaregularis(Verrill),a common New Zeland asteroid[J].J Exp Mar Biol Ecol,1971,7(4):137-162.
[39]Rubilar T,Ward P C T,Vivar D M E.Sexual and asexual reproduction ofAllostichastercapensis(Echinodermata:Asteroidea)in Golfo Nuevo[J].Mar Biol,2005,146(6):1083-1090.

