仿刺参养殖区泥样中灿烂弧菌拮抗菌的快速筛选及其保护作用*
陈四清,李 杰,韩 茵,唐 磊,白海盟,刘长琳,邹安革,祁自忠
(1.中国水产科学研究院黄海水产研究所,山东 青岛 266071;2.中国海洋大学海洋生命学院,山东 青岛 266003;3.山东安源水产股份有限公司,山东 烟台 265600)
仿刺参(Apostichopusjaponicus)养殖以其单种类产值最高和每年20%的增长速度,成为我国水产养殖业的重要支柱之一。2011年度山东省仿刺参的养殖面积达5.3万hm2,年产量7.1万t(超过全国总产量一半),年产值达160亿元[1]。然而,近年来随着刺参养殖规模的不断扩大,各种病害接踵而至,严重制约了该产业的健康、可持续发展[2]。
仿刺参保苗期和养成期发生的“腐皮综合征”波及面广、传染性强、死亡率极高,给仿刺参养殖造成了惨重的经济损失[4]。其症状主要表现为厌食、摇头、肿嘴、排脏、身体萎缩、口部溃烂乃至体表大面积溃疡;每年的1~4月养殖水体温度较低时(<8℃)是发病高峰期,这种病在育苗场多发生在2、3月,池塘养殖则多发生在3、4月,其高感染率通常引起成参50%的死亡率和稚参的全部死亡,属于急性死亡[3]。而灿烂弧菌(Vibriosplendidus)是引起养殖刺参“腐皮综合征”的主要病原菌之一,其致病力强,既能引起仿刺参表皮溃疡,也能诱发幼参烂胃病[5-6]。灿烂弧菌也是海水鱼类的重要致病菌之一,可引发大菱鲆(Scophthalmus maximus)、牙鲆(Paralichthysolivaceus)、大西洋鲑(Salmosalar)、鳟鱼(Squaliobarbusourriculus)、鲈鱼(Lateolabraxjaponicus)等患多种疾病。病鱼明显特征为尾部有出血点,皮肤腐烂,严重的形成溃疡;背鳍、胸鳍、尾鳍的鳍条基部充血;肝脏肿大、糜烂;肾脏糜烂等症状[7]。
为了控制仿刺参病害的发生,许多养殖户选择大量使用抗生素,而长期使用抗生素会导致药物的残留、养殖环境恶化、病原耐药性增强等负面影响。而且,由于仿刺参病害病因的复杂性,病原的多样性、区域性和不确定性,给养殖生产中的防治增加了难度,且易造成生产中药物的滥用[8]。近些年来,抗生素已经陆续被许多国家明令禁止作为饲料添加剂来使用,并严禁直接向养殖水域中泼洒抗生素[6]。人们开始努力寻求抗生素的有效替代方法,如水产疫苗的开发、免疫增强剂的研究和水产益生菌的应用。在此过程中,益生菌以其能够抑制病原微生物,调节养殖动物肠道微生态平衡,增强养殖动物免疫力,促进生长、无污染和毒副作用等优良的功效而逐渐被人们所重视,并在水产养殖业中得到越来越多的关注。芽孢杆菌(Bacillustoyoi)是第一类应用于水产养殖中的益生菌,有效地降低由于爱德华氏菌侵染引起的日本鳗鲡(Anguillajaponica)鳗苗的死亡[9]。此后益生菌在水产养殖中的应用得到了迅速发展。如今国内外成功研制并常用的有益菌种包括光合细菌、硝化细菌、芽孢杆菌、酵母菌和乳酸菌等[10]。而目前我国水产养殖中允许使用的芽孢杆菌菌种有枯草芽孢杆菌(B.subtilis)、地衣芽孢杆菌(B.licheniformis)、巨大芽孢杆菌(B.megeterium)、短小芽孢杆菌(B.pumilus)等[11]。
在本研究中,采用不同的培养基和泥样加热的方法对青岛市红岛仿刺参养殖区泥样中的可培养细菌进行分离纯化及16SrRNA基因序列分析。在通过菌种的安全性、抑菌活性和毒性测试后,用于仿刺参幼参的灿烂弧菌拮抗实验,并筛选出对灿烂弧菌有显著拮抗作用的潜在有益菌,在仿刺参养殖中将有良好的应用前景。
1 材料与方法
1.1 实验仿刺参幼参来源与驯化
实验用健康幼参购自山东蓬莱,平均体长为(4.00±0.78)cm,平均体质量(0.95±0.07)g。将实验用健康幼参在水温18~20℃的条件下驯化3d后开始试验,驯化期间不投喂任何饲料。
1.2 泥样中可培养细菌分离纯化及16SrRNA基因序列分析
2012年2 月,从红岛仿刺参养殖区无菌采集表层5cm的底泥,用10倍体积的无菌海水对底泥进行稀释混匀后置于50mL离心管中,设置2组平行。一管直接静置15min取上清,另一管置于80℃水浴20min,再静置15min后取上清。分别将2管上清液配制成0、10-1、10-2、10-34个不同的稀释浓度,每个浓度设置3个平行组;并各取100μL涂布于2216E及TCBS琼脂平板;于28℃恒温培养箱中倒置培养。
根据菌落形态(菌落的大小、颜色、透明度、边缘是否规则、湿润或干燥、菌落突起、凹陷或平坦等)特征挑取不同菌落,分别在2216E及TCBS琼脂平板上进一步划线纯化,纯化后的菌株保存至-80℃的超低温冰箱。
采用酚-氯仿法[12]提取纯化的菌株基因组DNA,1%琼脂糖凝胶电泳检测(电泳条件为100V,30min)。再用细菌16SrDNA通用引物B8F-B1510(由上海博尚生物技术有限公司合成)扩增16SrRNA基因序列,上游引物 B8F序列为:5’-AGAGTTTGATCCTGGCTCAG-3’,下游引物 B1510序列为:5’-GGTTACCTTGTTACGACTT-3’。PCR产物于1%琼脂糖凝胶进行电泳检测,并在253nm波长下观察。用DNA胶回收试剂盒(购自北京博迈德生物科技有限公司)纯化PCR产物,将PCR产物送至北京六合华大基因科技股份有限公司进行测序,测序结果通过NCBI的BLAST检索系统(http://www.ncbi.nlm.nih.gov/Blast/)进行同源序列比对。
1.3 泥样中灿烂弧菌LJ08的人工感染实验
将分离鉴定的灿烂弧菌LJ08接种于2216E平板培养基上,28℃恒温培养24h后,用无菌生理盐水将细菌从平板上洗下,制成1010CFU/mL的菌悬液。人工感染试验于预先消毒的盛有1.5L砂滤海水的玻璃烧杯中进行。挑选32头个体大小相当的健康幼参,每8头一组,分别设实验组和空白对照组,每组2个平行。实验组的感染浓度为107CFU/mL,空白对照组不加菌。整个试验期间不投喂任何饲料,水温保持在18~20℃,充气培养。及时清理排出的内脏,每隔3d,彻底换水1次,补加菌悬液1次,保持107CFU/mL的感染浓度,连续3周,观察发病、排脏和死亡情况。
1.4 海泥可培养细菌的安全性、抑菌活性和毒性的检测
挑选17株分离纯化的可培养细菌分别接种至绵羊血琼脂平板[13](购自青岛奕维生物科技有限公司)上;置于28℃恒温培养18~24h后观察菌落形态及溶血情况。以大肠杆菌JM109(Escherichiacoli)为阴性对照。
选择无溶血性的可培养细菌分别与前期分离获得的灿烂弧菌LJ08在2216E平板上进行牛津杯法抑菌实验,28℃恒温培养24h后,观察抑菌情况。
选择对灿烂弧菌LJ08有明显抑菌作用的细菌分别接种于2216E平板培养基上,28℃恒温培养24h后,用无菌生理盐水将细菌从平板上洗下,制成1010CFU/mL的菌悬液。毒性试验于预先消毒的盛有1.5L砂滤海水的玻璃烧杯中进行。挑选个体大小相当的健康幼参用于试验,每6头1组,每株菌为1组设3个平行。以107CFU/mL的浸泡浓度,对仿刺参进行毒性试验。整个试验期间不投喂任何饲料,水温保持在18~20℃,充气培养。每隔3d,彻底换水1次,补加菌悬液1次,保持107CFU/mL的浸泡浓度,连续2周,观察仿刺参排脏情况。
1.5 潜在有益菌对灿烂弧菌的拮抗实验
海泥中3株可培养细菌通过菌种的安全性、毒性和抑菌效果测试后用于仿刺参幼参的灿烂弧菌拮抗实验。分别将这3株细菌和泥样中分离获得的灿烂弧菌LJ08接种于2216E平板培养基上,28℃恒温培养24h后,用无菌生理盐水将细菌从平板上洗下,制成1010CFU/mL的菌悬液。
挑选个体大小相当的健康幼参养殖于预先消毒的盛有2L砂滤海水的玻璃烧杯中,每12头1组。其中空白对照组未做任何处理,阳性对照组仅添加浓度为1010CFU/mL的灿烂弧菌菌悬液2mL。设计3组拮抗组,每组分别添加浓度为1010CFU/mL的一株海泥可培养细菌和灿烂弧菌菌悬液各2mL。每组设3个平行。整个试验期间不投喂任何饲料,水温保持在18~20℃,充气培养。每隔3d,彻底换水1次,补加菌悬液1次,保持原有的浸泡浓度。连续观察2周,统计幼参排脏率,并计算保护率(%)={(阳性对照组平均排脏率-试验组平均排脏率)/阳性对照组平均排脏率}×100%。在拮抗实验的第12d,取1mL各实验组换水前的幼参养殖海水进行系列稀释,定量涂布TCBS琼脂平板检测实验水体中灿烂弧菌数量的变化。采用SPSS 17.0统计软件Duncan法对实验数据进行方差分析。
1.6 潜在有益菌LJ06的主要生理、生化特征鉴定
采用海洋细菌2216E培养基培养菌株LJ06。菌株的形态、主要生理和生化反应指标参照Xu[24]的方法进行。
2 结果与分析
2.1 泥样中可培养细菌分离纯化及16SrRNA基因序列分析
从红岛仿刺参养殖区表层5cm的新鲜海泥中共分离获得27株可培养细菌(见表1)。其中通过2216E培养基从未经加热处理的上清液中共分离获得14株(LJ01-LJ09,LJ23,LJ25,LJ26,LJ31,LJ35)。除 了LJ04、LJ23、LJ25和LJ26属于厚壁菌门(Firmicutes),其余10株分布在变形菌门(Proteobacteria),其中包括灿烂弧菌LJ08。通过TCBS培养基从未经加热处理的上清液中共分离获得3株,均属于变形菌门,分别为LJ43(灿烂弧菌),LJ-8(食环芳烃弧菌),LJ42(科尔韦尔氏希瓦氏菌)。通过2216E培养基从80℃加热处理后的上清液中分离获得10株可培养细菌(LJ10,LJ12,LJ27,LJ29,LJ30,LJ32-34,LJ39,LJ40),均分布在厚壁菌门;通过TCBS培养基从80℃加热处理后的上清液中未分离获得菌株。
在未经加热处理的海泥上清液中,变形菌门的细菌占总菌数的71.4%,均属于γ-变形菌纲;而厚壁菌门占28.6%。加热处理后,从海泥上清液中分离获得的10株可培养细菌,7株属芽孢杆菌属(Bacillus),只有LJ40属类芽孢杆菌属和LJ29、LJ30属动性球菌属。
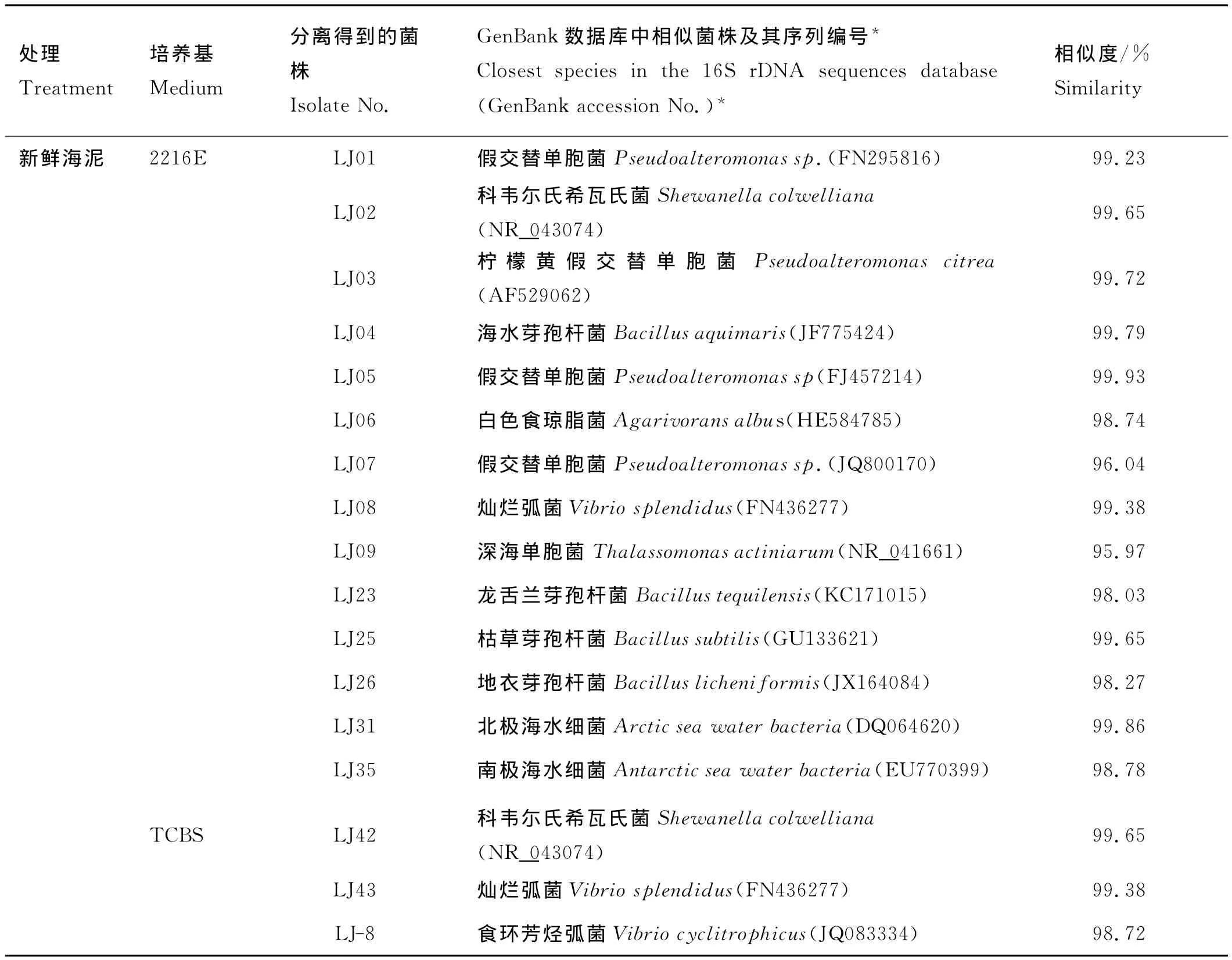
表1 红岛仿刺参养殖区泥样中可培养细菌的分离及16SrRNA基因序列分析Table 1 Identification of the culturable predominant bacteria isolated from sea cucmber area in Hongdao by 16SrRNA gene sequencing
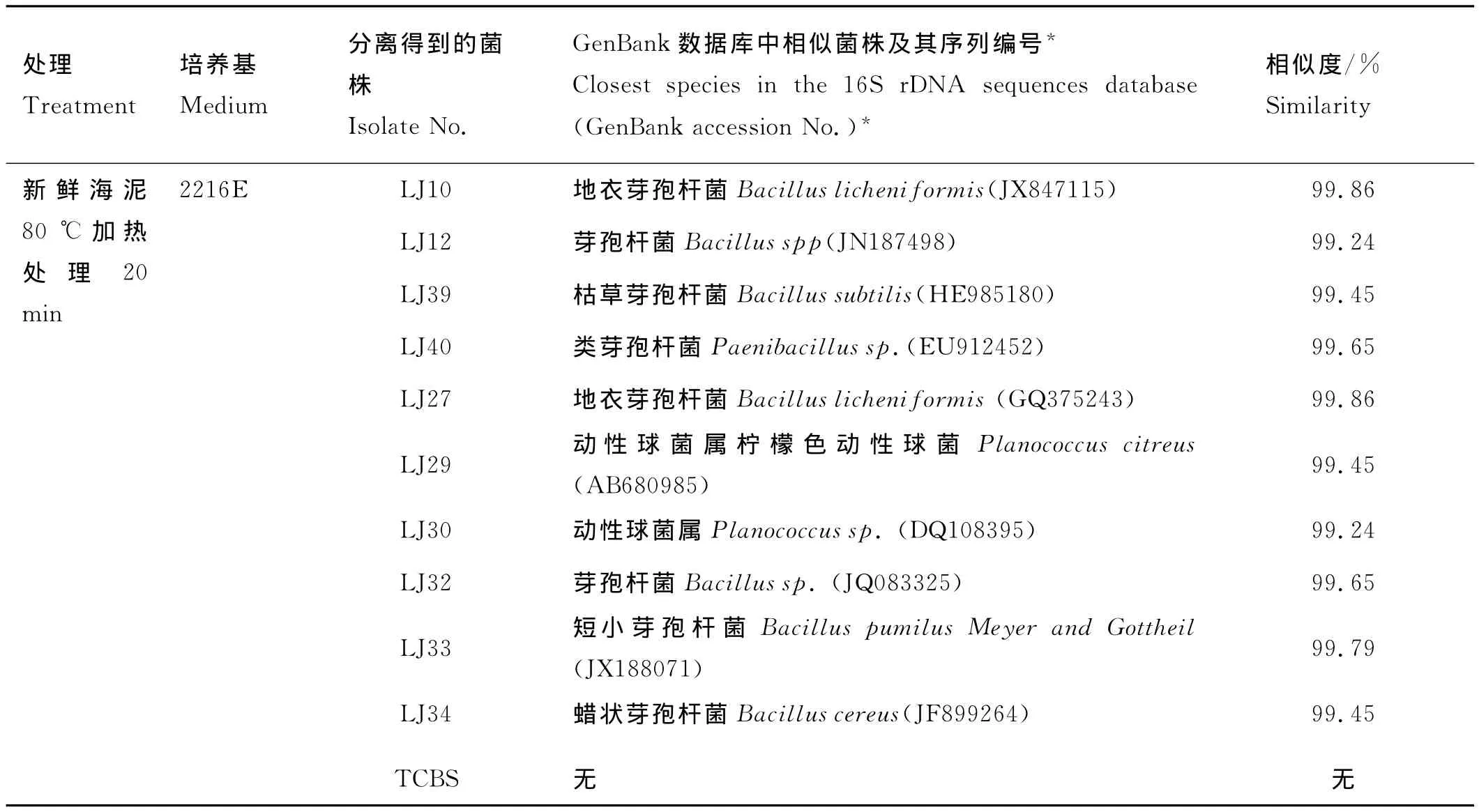
续表1
2.2 泥样中灿烂弧菌LJ08的人工感染实验
浸泡感染实验第2天,仿刺参开始排脏,同时陆续出现发病症状,主要表现为身体萎缩、体表溃烂、口围肿胀并出现溃烂白斑、管足松弛失去附着力而脱落至杯底,最后死亡。连续3周浸泡感染实验,实验组的排脏率达(56.25±6.12)%,死亡率为(43.75±6.33)%,对照组无一例死亡。无菌取人工感染后发病的仿刺参病灶组织涂布于TCBS平板,均可分离到大量菌落形态高度一致的细菌,其菌落形态、大小均与LJ08菌株相同。16SrDNA测序分析与LJ08菌株一致。
2.3 海泥可培养细菌的安全性、抑菌活性和毒性的检测
通过加热处理的方法从仿刺参养殖区海泥中分离到的多为芽孢杆菌。挑选17株分离纯化的可培养细菌经绵羊血琼脂平板溶血性的检测,发现LJ25、LJ30、LJ33和LJ34具有明显的β型溶血性,除LJ30其余3株均属于芽孢杆菌属(见表2)。
选择9株无溶血性的可培养细菌(LJ04、LJ06、LJ09、LJ23、LJ26、LJ29、LJ31、LJ35和LJ40)以及不能在绵羊血琼脂平板生长的LJ01、LJ03、LJ05和LJ32,分别与前期分离获得的灿烂弧菌LJ08采用牛津杯法进行抑菌实验,共筛选出3株对灿烂弧菌有抑菌圈的细菌,分别为LJ03,LJ04和LJ06,其中LJ06最为明显(见图1)。
选择LJ03,LJ04和LJ06,分别以107CFU/mL的浸泡浓度,对仿刺参幼参进行毒性试验。经2周的连续观察,3株细菌对幼参均无刺激排脏的作用,且实验期间无幼参死亡,说明这3株海泥可培养细菌对仿刺参是安全的,可以作为潜在的有益菌。
2.4 潜在益生菌对灿烂弧菌的拮抗实验
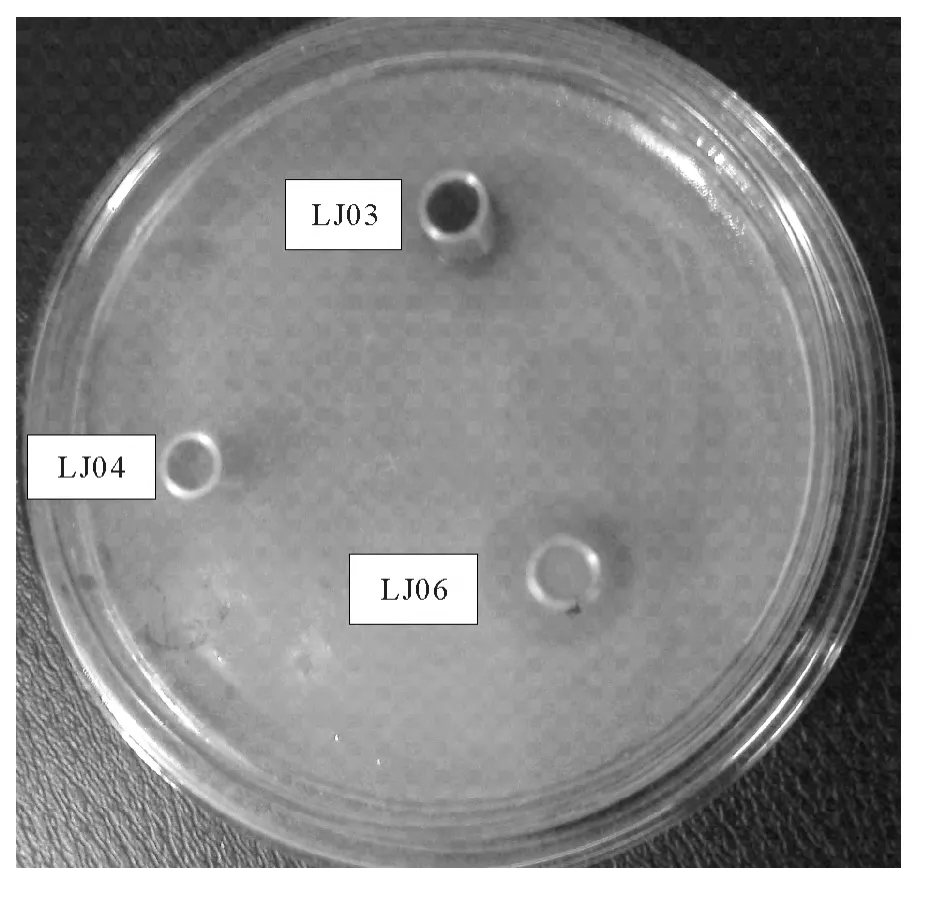
图1 3株海泥可培养细菌(LJ03,LJ04和LJ06)体外拮抗灿烂弧菌LJ08(牛津杯法)Fig.1 In vitro activity of three bacterial isolates(LJ03,LJ04and LJ06)against Vibrio splendidus LJ08with Oxford cup assay
在先前的毒性实验中,发现仿刺参幼参排脏现象往往先于死亡,而且比较容易观察,因此选择排脏率作为潜在有益菌拮抗灿烂弧菌的指标。选择LJ03,LJ04和LJ06这3株细菌进行仿刺参幼参灿烂弧菌的拮抗实验。其中阳性对照组和添加LJ04拮抗组在实验的第一天就发生排脏现象,LJ03拮抗组和空白对照组的幼参分别是在第二天和第三天出现排脏,而LJ06拮抗组仅在第九天出现排脏。实验3d后各实验组排脏现象趋于稳定,直至第九天再次出现持续排脏现象。LJ06拮抗组3个平行仅在第九天出现1例的排脏。在实验的第十二天,添加LJ04、LJ03和LJ06拮抗组实验水体 中的灿 烂弧菌数 量分别为 (1.12±0.20)×106CFU/mL、(7.31±1.10)×105CFU/mL和(1.74±0.40)×105CFU/mL,而阳性对照组灿烂弧菌数量为(2.31±0.70)×107CFU/mL,LJ04、LJ03和LJ06拮抗组与阳性对照组差异显著(P<0.05),进一步说明了3株海泥可培养细菌对灿烂弧菌均有不同程度的抑菌作用,与牛津杯抑菌试验结果一致。经过2周的人工拮抗实验,空白对照组的累计排脏率为(5.00±1.00)%;仅添加灿烂弧菌的阳性对照组累计排脏率为(52.78±4.81)%;而添加LJ04、LJ03和LJ06拮抗组的累计排脏率分 别 为 (38.89±4.82)%、(36.11±4.81)% 和(2.78±4.81)%,且LJ06拮抗组的累计排脏率低于空白对照组(见图2)。统计分析显示:LJ03和LJ06拮抗组和阳性对照组差异显著(P<0.05),说明LJ03和LJ06具有很好的保护仿刺参幼参的作用。去除空白对照组的累计排脏率,计算获得的LJ03和LJ06对仿刺参幼参的排脏保护率分别为34.9%和104.7%。但是,LJ04拮抗组和阳性对照组的排脏率没有显著差异(P>0.05),说明LJ04在活体的实验中其拮抗作用不显著。
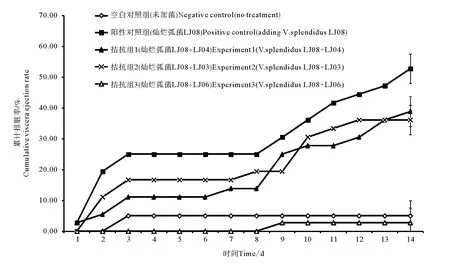
图2 仿刺参养殖区海泥中潜在有益菌对灿烂弧菌LJ08的拮抗实验Fig.2 In vivo inhibitory effects of potential probiotics isolated from sea cucmber area against Vibrio splendidus LJ08
2.5 潜在益生菌LJ06的形态和主要生理生化特征
菌株LJ06能在2216E琼脂平板上生长,形成规则的圆形白色菌落,表面光滑湿润,边缘整齐,培养24h菌落直径约为1.0mm,单菌落培养24h后产生明显的透明圈,培养4d后会出现明显的平板液化现象。该菌株革兰氏染色呈阴性,氧化酶反应呈阳性,能够利用硝酸盐,产生吲哚。菌株LJ06能够降解琼脂、淀粉和藻酸盐,不能降解酪蛋白。
3 讨论
从红岛仿刺参养殖区的泥样中通过2216E培养基分离获得可培养细菌多分布在γ-变形菌纲(占总菌数的71.4%),包括假交替单胞菌(LJ01,LJ05,LJ03和LJ07)、灿烂弧菌LJ08、科尔韦尔氏希瓦氏菌LJ02等。另外厚壁菌门占28.6%,均属于芽孢杆菌属。通过TCBS培养基分离到灿烂弧菌LJ43(与LJ08相似性100%)、科尔韦尔氏希瓦氏菌LJ42(与LJ02相似性100%)和LJ-8(与食环芳烃弧菌V.cyclitrophicus相似度为98.72%)。高菲等[18]利用不依赖于细菌培养的PCR变性梯度凝胶技术(PCR-DGGE)研究了仿刺参前肠、中肠和后肠内含物的细菌群落组成,发现大多数细菌的16SrDNA序列与目前未培养的、海洋沉积物环境中获得的细菌克隆序列相似,表明仿刺参消化道的细菌群落种类结构受栖息地环境影响较大。张文姬等[16]采用培养基平板分离结合16SrDNA序列测定分析了大连地区仿刺参肠道细菌可培养细菌的多样性,也发现其肠道可培养细菌包括假单胞菌属,弧菌属,芽孢杆菌属,希瓦氏菌属等10个菌属。本研究从仿刺参养殖区海泥中分离获得的可培养细菌的分布与以上的研究结果相似。
李彬等[17]从仿刺参的附着基和肠道中均分离获得灿烂弧菌,而且是冬春两季的优势细菌,推测是造成冬、春两季刺参发病的诱因之一。本研究从仿刺参养殖区海泥可培养细菌中也发现了灿烂弧菌LJ08,通过长度为1 441bp序列的比对,与灿烂弧菌Vibriosplendidus(FN436277)具有最大的同源性(99.38%)。在微生物的分类鉴定中,如果16SrDNA序列同源性>99%,可认为属于同一种;如果16SrDNA序列同源性<98%,则认为是不同种,如果16SrDNA序列同源性<95%,可以认为属于不同属[14]。LJ08可以在TCBS培养基上生长,初步鉴定为灿烂弧菌V.splendidus。在仿刺参人工浸泡感染试验中,107CFU/mL的LJ08可引起幼参身体萎缩、体表溃烂、口围肿胀等病症,并导致(56.25±6.12)%的排脏率和(43.75±6.33)%的死亡率,证实灿烂弧菌LJ08是引起仿刺参腐皮综合病的主要致病菌之一。由于仿刺参不断吞食周围环境中的泥土和动植物碎屑,其消化道的细菌群落种类结构很大程度上受栖息地环境的影响[18]。灿烂弧菌是海水中的正常菌群,其致病性取决于宿主的生理状态和养殖环境的理化条件。
芽孢杆菌是最早,也是应用在水产最为广泛的益生菌。然而,已有报道一些芽孢杆菌可以产生溶血毒素(Hemolytic Enterotoxin HBL),如苏云金芽孢杆菌(B.thuringiensis)、蕈状芽孢杆菌(B.mycoides)等,为了保证食品微生物的安全性有必要进行溶血性检测[14]。在溶血性检测中发现LJ25(与枯草芽孢杆菌(Bacillussubtilis)GU133621相似度99.65%)、LJ33(与短小芽孢杆菌(Bacilluspumilus)JX188071相似度99.79%)和LJ34(与蜡状芽孢杆菌(Bacilluscereus)JF899264相似度99.45%)都具有β溶血活性,尤其LJ34具有较强的溶血活性。骆文艺等[19]报道了一株能引起仿刺参“腐皮综合征”的蜡状芽孢杆菌。已有报道蜡样芽孢杆菌中的部分菌株可引起的食物中毒事件[20]。因此,在筛选芽孢杆菌作为益生菌之前,非常必要对其溶血活性进行检测。
本研究通过对海泥中可培养细菌的安全性、抑菌活性和毒性的检测,筛选出3株对灿烂弧菌有明显抑菌作用的细菌,分别为LJ03,LJ04和LJ06。在仿刺参幼参灿烂弧菌的拮抗实验中,添加LJ04、LJ03和LJ06拮抗组实验水体中的灿烂弧菌数量明显减少(P<0.05),并且LJ03和LJ06显示出良好的保护仿刺参幼参的作用(P<0.05),其中LJ06对仿刺参幼参排脏保护率达104.7%。LJ06的16SrDNA通过长度为1 436bp序列的比对,与白色噬琼胶菌Agarivoransalbus HE584785具有98.74%的同源性,2216E培养基上能够降解琼脂,属于噬琼胶菌属(Agarivorans)。杜宗军等[21]报道在青岛近海琼胶降解细菌筛选和多样性分析中,分离获得了白色噬琼胶菌QM38,能够降解琼胶和产生白色色素。孙奕等[22]发现仿刺参在饥饿情况下琼脂降解能力提高,肠道内具有降解琼胶活性的细菌可达肠道细菌总数的27%。马悦欣等[23]也从仿刺参的消化道内分离获得一株能降解琼胶的细菌。推测降解琼胶的细菌应为仿刺参肠道正常菌群的组成之一,水产动物正常肠道菌群通常被认为是其消化系统的有利补充。有关LJ06拮抗灿烂弧菌的机理目前在进一步深入研究中。LJ06作为拮抗灿烂弧菌的新型益生菌,在仿刺参养殖中有着良好的应用前景。
[1]李剑桥.海参成为山东省第一大海水养殖产业 [J].水产养殖,2012,5:53-54.
[2]张春云,王印庚,荣小军,等.国内外海参自然资源、养殖状况及存在问题 [J].海洋水产研究,2004,25(3):89-97.
[3]Deng H,He C,Zhou Z,et al.Isolation and pathogenicity of pathogens from skin ulceration disease and viscera ejection syndrome of the sea cucumberApostichopusjaponicas[J].Aquaculture,2009,287(1):18-27.
[4]谢建军,王印庚,张正,等.养殖刺参腐皮综合征两种致病菌Dot-ELISA快速检测 [J].海洋科学,2007,31(8):59-64.
[5]沈名灿,朱耀武,史文辉,等.益生菌在养殖业中的应用研究进展[J].湖南农业科学,2011(1):137-139.
[6]王印庚,方波,张春云,等.养殖刺参保苗期重大疾病“腐皮综合征”病原及其感染源分析 [J].中国水产科学,2006,13(4):610-616.
[7]王亮.灿烂弧菌的鉴定及溶血素检测 [D].济南:山东农业大学,2011.
[8]张春云,张国福,徐仲,等.海参疾病学研究进展[J].水产科学,2011,30(10):644-648.
[9]Kozasa M.Toyocerin(Bacillustoyoi)as growth promotor for animal feeding[J].Microbiol Aliment Nutr,1986,4:121-135.
[10]周结珊,付锦峰,李海云,等.益生菌在水产养殖中的应用 [J].饲料研究,2012,12:4-7.
[11]丁丽,周维仁,章世元,等.益生菌在水产上的应用及其对鱼类肠道菌群的影响 [J].饲料工业,2009,30(20):27-30.
[12]李永霞.海底沉积物微生物燃料电池模型的建立及一株海洋细菌新种的分类鉴定 [D].青岛:中国海洋大学,2011.
[13]PrüβB M,Dietrich R,Nibler B,et al.The Hemolytic Enterotoxin HBL Is Broadly Distributed among Species of theBacillus cereusGroup[J].Appl Environ Microbiol,1999,65(12):5436-5442.
[14]Fry N K,Warwick S,Saunders N A,et al.The use of 16Sribosomal RNA analyses to investigate the phylogeny of the familyLegionellaceae[J].J Gen Microbiol,1991,137:1215-1222.
[15]Budarina Z I,Sinev M A,Mayorov S G,et al.Hemolysin II is more characteristic ofBacillusthuringiensisthanBacilluscereus[J].Arch Microbiol,1994,161:252-257.
[16]张文姬,侯红漫,张公亮,等.仿刺参肠道可培养微生物多样性研究 [J].食品工业科技,2011(9):149-151,155.
[17]李彬,荣小军,廖梅杰,等.刺参肠道与养殖池塘环境中异养细菌和弧菌数量周年变化 [J].海洋科学,2012,36(4):64-67.
[18]高菲,孙慧玲,许强,等.刺参消化道内含物细菌群落组成的PCR-DGGE分析 [J].中国水产科学,2010(4):671-680.
[19]骆艺文,郝志凯,王印庚,等.一株引起刺参腐皮综合征的蜡样芽孢杆菌 [J].水产科技情报,2009,36(2):60-63.
[20]夏克林.蜡样芽孢杆菌肠毒素的研究动态 [J].微生物学通报,1989(1):35-36.
[21]杜宗军,赵苑,李美菊,等.青岛近海琼胶降解细菌的筛选和多样性分析 [J].中国海洋大学学报:自然科学版,2007,37(2):277-282.
[22]孙奕,陈騳.仿刺参体内外微生物组成及其生理特性的研究 [J].海洋与湖沼,1989,20(4):300-307.
[23]马悦欣,安军,刘双连,等.仿刺参消化道内产琼胶酶菌株的选育及培养条件优化 [J].大连水产学院学报,2007,22(2):86-91.
[24]Xu Huaishu,Yang Xuesong,Li Yun.Diagnosis and Control of Bacterial Diseases in Penaeid Shrimp Hatcheries (in Chinese)[M].Beijing:China Ocean Press,1999:166-190.

