蜂胶对乳鼠心肌细胞氧化损伤的保护作用
崔凤娟,曾 瑾,王海珍,张根葆,王海华
(皖南医学院 1.生理学教研室;2.蛇毒蛇伤研究所,安徽 芜湖 241002)
蜂胶(propolis)是蜜蜂从胶原植物幼芽、树皮上采集的树脂类物质,混以蜜蜂上颚腺、蜡腺分泌物。近年来,研究发现蜂胶主要有广谱抗菌、抗炎症、抗肿瘤等作用,对心血管系统疾病、糖尿病亦有治疗作用[1]。体内外实验均表明,蜂胶具有显著的抗氧化活性,能清除自由基,提升抗氧化酶活性,抑制脂质过氧化[2-3]。但是,蜂胶对 H2O2所致的乳鼠心肌细胞损伤的相关作用,尚未见报道。本文拟以H2O2复制乳鼠心肌细胞损伤模型[4],用不同剂量蜂胶孵育,探讨蜂胶对心肌细胞氧化损伤的作用及可能机制,为蜂胶在临床应用提供实验依据。
1 材料与方法
1.1 实验动物 出生2~3 d的SD乳鼠,雌雄不拘,动物合格证号:SCXK(苏)2009-0001。
1.2 主要试剂与药品 蜂胶(购自中国药品生物制品检定所),用二甲基亚砜(DMSO)配制成105mg/L 的母液,用时稀释,DMSO 终浓度≤0.1%[5];DMEM高糖培养基(购自Hyclone公司);胎牛血清(购自杭州四季青公司);胰蛋白酶(购自碧云天生物技术研究所);Ⅱ型胶原酶、5-溴脱氧尿嘧啶(5-Brdu)及甲基四唑蓝(MTT)(购自美国Sigma公司);H2O2系国产分析纯;超氧化物歧化酶(SOD)、丙二醛(MDA)及乳酸脱氢酶(LDH)测定试剂盒(购自南京建成生物工程研究所);α-横纹肌肌动蛋白单克隆抗体(α-sarcomeri cactin,α-SA)及链霉素亲和素-生物素-过氧化物酶复合物(Strep-tAvidin-iotin peroxydase Complex,SABC)免疫组化试剂盒(购自武汉博士德生物工程有限公司),实验中所用其他试剂均为进口或国产分析纯。
1.3 主要实验仪器 倒置荧光显微镜(日本Olympus)、YJ-1450 SA型超净工作台(苏州市净化设备厂)、Model-680型酶标仪(美国 BIO-RAD)、UV-3200PCS紫外可见分光光度计(上海美谱达仪器有限公司)、恒温二氧化碳培养箱(Thermo)、90-1型恒温磁力搅拌器(上海沪西分析仪器厂)等。
1.4 方法
1.4.1 原代心肌细胞培养 取2~3 d的SD乳鼠,无菌操作开胸剪去心脏,用0.125%胰蛋白酶和0.08%胶原酶Ⅱ的混合酶分次消化法分离细胞,1 000 r/min离心 8 min沉淀细胞,5-Brdu(0.1 mmol/L)及差速贴壁法纯化心肌细胞。将细胞密度调整至3 ×105个/ml,每孔 100 μl加入 96 孔板,直至细胞长成致密单层后用于实验[6]。实验前将原含血清培养液换为无血清培养液。
1.4.2 心肌细胞的形态学观察 刚分离的心肌细胞呈圆形,培养2~4 h细胞开始贴壁生长,变为梭形,逐渐展开,伸出伪足,变为三角形、星形、多边形等;培养24 h后细胞基本全部贴壁,多呈现梭形(见图1A);培养48h后细胞呈梭形并伸出伪足互相交织,逐渐形成细胞簇(见图1B);培养72 h后细胞伸出的伪足相互接触交织成网,细胞簇呈放射状排列的同心圆状,搏动呈同步性,收缩有力,形成功能性合胞体(见图1C)。

图1 原代心肌细胞培养(×200)Fig 1 Primarily cultured cardiomyocytes(×200)
1.4.3 心肌细胞免疫组化鉴定 无菌条件下取出原代培养第3 d的细胞爬片,4%多聚甲醛固定30 min,PBS清洗3次,用横纹肌肌动蛋白(α-actin)单克隆抗体作为一抗,SP法 DAB显色免疫细胞化学染色,取磷酸盐缓冲液(PBS)作为一抗的阴性对照。由于α-SA仅在心脏中的心肌细胞呈阳性表达,位于胞浆为棕黄色,而在非心肌细胞中表达阴性,故可将其作为心肌细胞纯度鉴定的指标(见图2A、B)。

图2 心肌细胞鉴定×200Fig 2 Myocardial cell identifications×200
1.5 实验分组
1.5.1 H2O2对乳鼠心肌细胞的氧化损伤 选择生长良好、搏动规律的心肌细胞,随机分为6组:正常对照组,不加H2O2处理;H2O2损伤组,加入不同浓度的 H2O2(50、100、200、400、800 μmol/L 后再孵育4 h。然后测定细胞存活率、培养液LDH活性及MDA含量,并观察细胞形态学变化。
1.5.2 蜂胶预处理对H2O2引起的氧化损伤 将心肌细胞随机分为6组:正常对照组,不加蜂胶及H2O2;DMSO溶剂对照组,加入含DMSO(<0.1%)的培养基培养;模型组,H2O2(400 μmol/L)孵育4 h;蜂胶组,加入不同剂量蜂胶(50、100、200 mg/L)预先孵育心肌细胞12 h,然后加入H2O2(400 μmol/L)继续孵育4 h。每个浓度设6个复孔,实验重复3次。
1.6 检测指标
1.6.1 心肌细胞存活率 采用甲基四唑蓝(MTT)比色实验,它是一种检测细胞存活和生长的方法。将相应处理后的心肌细胞接种于96孔培养板内,每组设6个复孔,每孔加入 MTT(5 mg/ml)20 μl,继续37℃孵育4 h,小心吸出培养上清,再向每孔加入DMSO 150 μl溶解结晶,微型振荡器上振荡约10 min,用酶标仪测定波长490 nm处的OD值。取每组的OD均值。按公式计算心肌细胞存活率:

1.6.2 心肌细胞形态学变化 接种于24孔培养板中的各组心肌细胞经过相应处理后,于倒置显微镜下观察心肌细胞的形态学改变并拍摄照片。
1.6.3 LDH、SOD、MDA的检测 取细胞培养上清50 μl,LDH测定采用比色法,SOD测定采用黄嘌呤氧化酶法,MDA测定采用硫代巴比妥酸比色法,具体操作按照试剂盒说明书进行。
1.7 统计学分析 采用SPSS 18.0软件进行统计学处理与数据分析,实验数据以s表示,多组之间采用单因素方差分析(F检验)进行比较,多组间两两均数比较采用SNK法(q检验)。P<0.05为差异具有统计学意义,P<0.01为差异具有显著性统计学意义。
2 结果
2.1 乳鼠心肌细胞的形态学变化 对照组心肌细胞伸出伪足相互接触交织成网,逐渐形成细胞簇,呈放射状排列的同心圆状,搏动呈同步性,收缩明显有力;H2O2损伤组心肌细胞部分皱缩,细胞核暗淡,伪足消失,搏动减慢,心肌细胞胞体变小,细胞间桥结构减少,胞间隙明显增加。加入不同浓度的蜂胶组细胞的形态和搏动状态均比模型组有明显的好转,心肌细胞的伪足回缩减轻,细胞间连接增多,搏动节奏有所恢复(见图3)。

图3 蜂胶作用于H2O2损伤的乳鼠心肌细胞形态学变化(×200)Fig 3 Morphological changes of myocardial cells of neonatal rats propolis effects on H2O2damage(×200)
2.2 H2O2诱导心肌细胞氧化损伤 不同浓度H2O2作用于培养的心肌细胞,可见心肌细胞随着H2O2浓度的增加存活率显著降低(P<0.01);培养液中LDH活性明显升高,MDA含量也显著地增加,SOD活性显著降低(P<0.01),且呈现H2O2浓度依赖性(见图4,表1)。
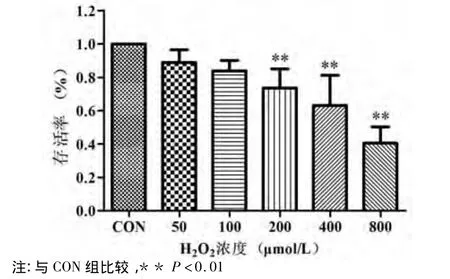
图4 不同浓度H2O2对乳鼠心肌细胞存活率的影响(±s,n=6)Fig 4 Damage effects of different concentrations of H2O2on the rat myocardial cells(±s,n=6)
表1 H2O2对心肌细胞氧化损伤的影响(±s,n=6)Tab 1 Effect of H2O2on oxidative damage to myocardial cells(±s,n=6)

表1 H2O2对心肌细胞氧化损伤的影响(±s,n=6)Tab 1 Effect of H2O2on oxidative damage to myocardial cells(±s,n=6)
注:与对照组比较,aP <0.05,bP <0.01
组别 剂量(μmol/L)LDH(U/L)SOD(U/L)MDA(nmol/L)- 180.13 ±141.55 13.30 ±2.6 11.75 ±0.40 H2O2 组 50 296.86 ±183.27a11.18 ±1.5b12.50 ±0.59b 100 404.04 ±175.33b 9.71 ±1.2b13.18 ±0.51b 200 517.96 ±176.52b 8.10 ±1.04b14.01 ±0.87b 400 651.52 ±185.62b 6.56 ±1.26b14.78 ± 1.05b 800 907.97 ±143.68b 2.63 ±0.72b15.76 ±1.02b F 值 43.32 111.55 65.07 P值对照组0.00 0.00 0.00
2.3 蜂胶对H2O2诱导乳鼠心肌细胞氧化损伤的作用 心肌细胞经过不同浓度的蜂胶(50、100、200 mg/L)预先孵育 12 h,再加入 H2O2(400 μmol/L)孵育4 h,与H2O2模型组比较,蜂胶(100、200 mg/L)可使心肌细胞存活率明显增加(P<0.05,P<0.01),可明显降低培养液中LDH活性及MDA含量(P <0.01,P <0.05),SOD 活性增加(P <0.01)。见图5,表2。
3 讨论
氧化应激损伤在心肌缺血、心肌再灌注损伤及心力衰竭等病变中都起着重要的作用[7]。心肌细胞缺氧时,ATP生成减少,分解增多,导致 ADP、AMP增加,后者降解为次黄嘌呤,而次黄嘌呤正是产生氧自由基(oxygen derived free radical,ODFR)的底物[8]。在氧供不足时,黄嘌呤脱氢酶可在钙依赖蛋白酶的作用下迅速转化为黄嘌呤氧化酶,为氧自由基的产生做好准备。氧自由基具有强烈引发脂质过氧化作用,可引发链式脂质过氧化反应,它们几乎可以同任何细胞成份发生反应,从而达到损伤细胞的目的[9]。正常情况下有少量ODFR生成并无大碍,细胞内存在SOD,过氧化氢酶(catalase,CAT)以及谷胱甘肽过氧化物酶(glutathione peroxidase,GSHps),这些酶能及时将体内过剩的ODFR还原成水而被清除,但是当ODFR的产生量超过了其清除能力时就会引发自由基损伤。

图5 不同剂量蜂胶对H2O2损伤心肌细胞存活率的影响(±s,n=6)Fig 5 Different dosage of propolis on the viability of myocardial cells after H2O2induced injury(±s,n=6)
表2 蜂胶对H2O2诱导心肌细胞氧化损伤的影响(±s,n=6)Tab 2 Protective effects of propolis on the myocardial cells induced by H2O2(±s,n=6)
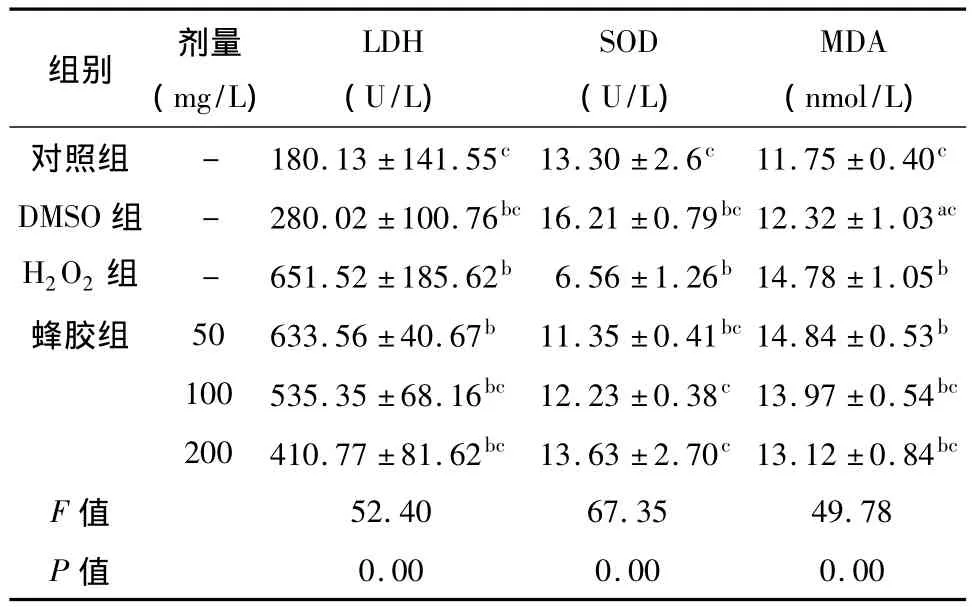
表2 蜂胶对H2O2诱导心肌细胞氧化损伤的影响(±s,n=6)Tab 2 Protective effects of propolis on the myocardial cells induced by H2O2(±s,n=6)
注:与对照组比较,aP <0.05,bP <0.01;与 H2O2组比较,cP <0.01
剂量LDHSODMDA组别 (mg/L)(U/L)(U/L)(nmol/L)对照组 - 180.13 ±141.55c13.30 ±2.6c 11.75 ±0.40c DMSO 组 - 280.02 ±100.76bc16.21 ±0.79bc12.32 ±1.03ac 0.00 0.00 0.00 H2O2组 - 651.52 ±185.62b 6.56 ±1.26b14.78 ±1.05b蜂胶组 50 633.56 ±40.67b 11.35 ±0.41bc14.84 ±0.53b 100 535.35 ±68.16bc 12.23 ±0.38c13.97 ±0.54bc 200 410.77 ±81.62bc 13.63 ±2.70c13.12 ±0.84bc F 值 52.40 67.35 49.78 P值
本实验采用外源性给予H2O2诱导乳鼠心肌细胞的氧化应激性损伤。H2O2是一种活性氧,其氧化能力很强。外源性H2O2作用于心肌细胞后产生大量氧自由基,后者介导的脂质过氧化反应是导致心肌细胞(尤其生物膜)损伤的重要原因。LDH是胞内酶,少量漏出即提示细胞膜通透性增高,漏出量的多少可反映细胞膜的受损程度;SOD是一种存在于细胞液中的抗氧化酶,可清除超氧阴离子,保护细胞免受超氧阴离子损伤,其值高低间接反映了机体清除氧自由基的能力;MDA是氧自由基攻击生物膜不饱和脂肪酸的终产物,其数值的高低可间接反映细胞受自由基损伤程度[10]。实验结果显示,H2O2能使培养液中LDH、MDA明显升高,SOD活性显著降低,同时心肌细胞形态损伤明显,细胞伪足回缩,体积变小,自律搏动减弱;且心肌细胞存活率明显降低,证实H2O2的心脏毒性作用与脂质过氧化损伤有关。
蜂胶具有广泛的药理活性,对心肌损害、缺血再灌注损伤等有保护作用[11-12],可能与其较强的抗氧化作用有关[13]。本实验结果显示3种剂量蜂胶预处理,均能减轻H2O2诱导的LDH释放量增加和MDA含量增加;呈剂量依赖性防止H2O2诱导的SOD活性降低,细胞存活率升高,细胞形态学指标亦有显著改善。可见蜂胶能有效地减轻H2O2对心肌细胞的损伤作用,维持机体内抗氧化酶(SOD)的活性,降低脂质过氧化产物的生成,从而减轻脂质过氧化对心肌的损伤,直接抑制活性氧的形成或直接清除已形成的活性氧,进而起到天然抗氧化剂的作用,至于其确切机制有待进一步探讨。
[1]王亚群,任永新.蜂胶的化学成分及其保健作用[J].食品与药品,2006,8(12):75 -76.
[2]KHALIL M L.Biological activity of bee propolis in health and disease[J].Asian Pac J Cancer Prev,2006,7(1):22 -31.
[3]BANSKOTA AH,TEZUKA Y,KADOTA S.Recent progress in pharmacological research of propolis[J].Phytother Res,2001,15(7):561-571.
[4]曹纯章,卜丽莎,高申,等.过氧化氢对培养心肌细胞损伤作用的研究[J].生物化学与生物物理进展,2000,27(6):628-632.
[5]汪茗,章尧,谢向荣,等.JNK信号通路对蜂胶抑制白血病K562细胞增殖的调控作用[J].医学分子生物学杂志,2012,9(1):27-30.
[6]郭舜,张树江,段蕊,等.新生SD大鼠心肌细胞原代培养方法改进[J].中药药理与临床,2012,28(6):139 -141.
[7]赵洪涛.氧化应激对心肌细胞的影响[J].心血管病学进展,2004,25(1):70 -73.
[8]FERRARI R,AGNOLETTI L,COMINI L,et al.Oxidative stress during myocardial ischaemia and heart failure[J].Eur Heart,1998,19(Suppl B):B2 - B11.
[9]边云飞.氧化应激与心血管疾病[M].北京:军事医学科学出版社,2011,96 -99.
[10]王秋林,王浩毅,王树人.氧化应激状态的评价[J].中国病理生理杂志,2005,21(10):2069 -2074.
[11]黄晖,刘世清,邓明,等.蜂胶对阿霉素致心肌损伤小鼠的影响[J].中国医药,2011,6(3):264 -265.
[12]孙岩,吕若谷,阙肖东,等.蜂胶总黄酮对犬冠脉结扎性心肌缺血生化指标的影响[J].吉林医学,2011,32(28):5861 -5862.
[13]OZER MK,PARLAKPINAR H,ACET A.Reduction of ischemiareperfusion induced myocardial infarct size in rats by caffeic acid phenethyl ester(CAPE)[J].Clinical biochemistry,2004,37(8):702-705.

