纤维素酶解滁菊提取多糖工艺及滁菊多糖抗氧化性研究
熊 磊,年四辉,朱 玉
(皖南医学院 1.生化教研室;2药学院;3.公共卫生学院,安徽 芜湖 241002)
滁菊是菊科植物菊(Dendranthema morifolium)的干燥头状花序,分布在安徽省滁州地区,为我国四大药菊之首,药用、茶用价值较大,是我国传统的保健食品。滁菊中除含有挥发油[1]、黄酮类[2]等药效成分外,尚含有多糖、胆碱、氨基酸等多种成分[3]。现代药理研究表明,多糖除具有增强机体免疫、抗肿瘤作用外[4],尚具有抗氧化作用[5]。滁菊常采用乙醇提取黄酮类成分,而提取后的药渣作为废物丢弃,易造成资源浪费,环境污染。为综合利用滁菊药用资源,本课题拟对滁菊多糖的提取作进一步的研究。
菊花多糖提取传统工艺一般采用水提醇沉法,操作简单易行,但多糖得率较低[6],亦有应用果胶酶提取滁菊多糖的文献报道[7]。纤维素是由D-葡萄糖-1,4糖苷键连接而成,是植物细胞壁主要组成成分,纤维素酶能特异性降解纤维素,从而破坏植物细胞壁而促进药效成分溶出[8],因此纤维素酶法近年逐渐应用于中药有效成分提取研究中。本研究以纤维素酶法从滁菊药渣中提取滁菊多糖,并进一步研究滁菊多糖抗氧化性,以期为滁菊药用资源的综合利用开发提供理论基础和实验依据。
1 材料与设备
滁菊取自安徽菊泰滁菊草本科技有限公司;纤维素酶(Yakult Honsha Co.,Ltd.,35 000 U/g);葡萄糖、浓硫酸、苯酚、无水乙醇、氯仿、正丁醇、丙酮、石油醚、抗坏血酸、DPPH(1,1-二苯基-2-三硝基苯肼)等以上试剂均为分析纯;UV-9100型紫外可见分光光度计;PHS-25型数显pH计购自上海精密科学仪器有限公司;R-200型旋转蒸发仪;DZKW-D恒温水浴锅等。
2 方法
2.1 滁菊药渣干品的制备、纤维素酶和乙酸-乙酸钠缓冲溶液的配制 滁菊洗净烘干后经80%乙醇浸提两次,每次各2 h,将滁菊药渣挥干乙醇,用粉粹机粉碎后备用。将纤维素酶配制成700 U/ml酶制剂,4℃保存,用前摇匀。配制pH范围在4~6的乙酸-乙酸钠缓冲溶液备用,称取无水乙酸钠,加冰乙酸,加水稀释,并用酸度计调节pH值。
2.2 酶法提取滁菊多糖工艺流程 称取滁菊药渣粗粉2.0 g,添加缓冲溶液50 ml和纤维素酶液;恒温水浴控制酶解时间;加入250 ml蒸馏水于100℃水浴浸提2.5 h;抽滤,将提取液浓缩至20 ml;加入Sevag试剂(氯仿∶正丁醇=5∶1)10 ml脱蛋白,重复操作;加入95%乙醇醇沉24 h;沉淀分别用乙醇、丙酮、石油醚洗涤2~3次;真空干燥得滁菊多糖粗品。
2.3 纤维素酶酶解条件 保持其他因素条件不变,以酶解 pH值 4.5、酶解温度 55℃、酶解时间100 min和酶用量20 U/g为基础条件,分别考察纤维素酶的酶解pH值、酶解温度、酶解时间和酶用量4个单因素对滁菊多糖得率的影响,选用L9(34)正交表进行正交试验,正交因素水平见表1。

表1 纤维素酶解正交因素水平Tab 1 Factors affecting the celluslase degradation by orthogonal test
2.4 滁菊多糖得率的计算 精密称取葡萄糖对照品100 mg,制备成0.1 mg/ml的对照品溶液,分别稀释成 10.0,20.0,40.0,60.0,80.0,100.0,120.0,140.0 μg/ml的8 个浓度对照品溶液,按苯酚-硫酸法[7]在490 nm波长处测吸光度(A)值,制成标准曲线,得到线性回归方程:
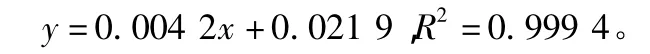
将滁菊多糖粗品溶解,按苯酚-硫酸法,依据已制定的葡萄糖标准曲线换算出滁菊多糖含量,按下列公式计算滁菊多糖得率:

2.5 滁菊多糖的抗氧化性(清除DPPH自由基和超氧阴离子自由基)滁菊多糖配制 1.0、0.8、0.6、0.4、0.2 mg/ml 5 个浓度和抗坏血酸溶液 0.2 mg/ml备用,分别取上述溶液2 ml与0.2 mmol/L的DPPH溶液2 ml混匀,放置30 min,测定吸光度(Ai)(波长517 nm)。上述溶液各2 ml分别与2 ml无水乙醇混合,测定同波长处的吸光度(Aj)。以DPPH溶液与无水乙醇反应作为对照,测定吸光度(A0)。DPPH自由基清除率计算公式为:

取0.05 mol/L 的 Tris-HCl缓冲溶液(pH 8.2)4.5 ml,25℃水浴中预热20 min后,分别取上述备用溶液各1 ml和0.4 ml 25 mmol/L邻苯三酚溶液混匀,25℃水浴中反应5 min,加入8 mmol/L的HCl溶液1 ml终止反应,在325 nm处测定吸光值(Ai)。对照组以蒸馏水代替多糖溶液,在同波长处测定吸光值(A0)超氧阴离子自由基清除率计算公式为:
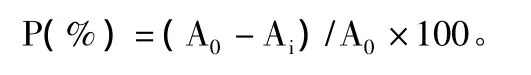
3 结果与分析
3.1 单因素实验结果 随着溶液pH值增大,滁菊多糖得率先升高后降低,在pH为5.0达到最大值。过高或过低的pH值会影响酶蛋白构象,影响酶的活力,pH值还会影响底物分子解离,影响反应速度。因此最佳酶解pH为5.0(图1)。随着酶解温度的升高,滁菊多糖得率出现先升高后降低的趋势,当温度升高时,纤维素酶活性增加,反应速度增大,但超过最适温度后,温度升高酶蛋白开始变性,酶的活性受到破坏,从而影响多糖得率。因此温度升高可以增加纤维素酶的活性,但温度过高会导致酶失活,图2看出,酶解温度55℃,滁菊多糖得率最大(图2)。酶解时间对滁菊多糖得率提高有影响,反应时间延长,酶解程度越高,从而促进多糖的溶出,但随时间增长,酶解作用趋于饱和,多糖得率增幅明显减缓,最佳酶解时间为120 min(图3)。随着酶用量增加,滁菊多糖得率出现先升高后保持不变的趋势,因此酶用量会直接影响多糖得率。随着酶用量的增加,细胞壁中的纤维素水解速度提高,致使多糖更快地溶出;达到最大值后,随酶用量的增加,底物被酶分子饱和,纤维素被水解的速度趋于稳定,多糖得率也趋于稳定。因此最佳酶用量定为25 U/g(图4)。
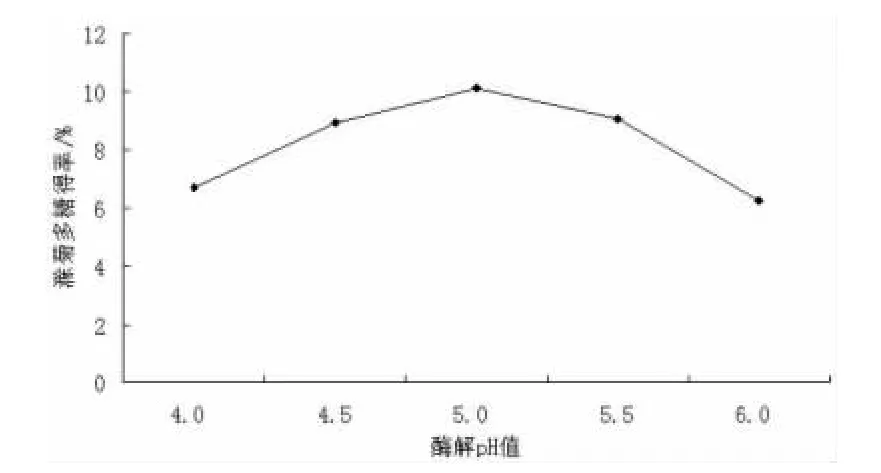
图1 酶解pH对滁菊多糖得率的影响Fig 1 pH value on the recovery rate of polysaccharide
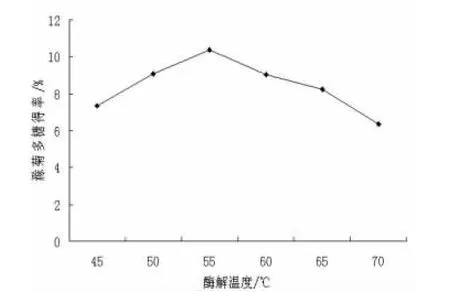
图2 酶解温度对滁菊多糖得率的影响Fig 2 Temperature at enzymolysis on the recovery rate of polysaccharide

图3 酶解时间对滁菊多糖得率的影响Fig 3 The extraction time on the recovery rate of polysaccharide
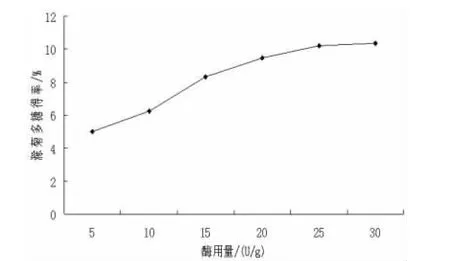
图4 酶用量对滁菊多糖得率的影响Fig 4 Enzyme dosage on the recovery rate of polysaccharide
3.2 正交实验结果分析 根据极差分析结果,由表2得到4个因素对滁菊多糖得率影响的主次顺序依次是B>A>D>C。对4个因素进行方差分析,发现因素C引起的变异最小。表3方差分析结果表明,因素B的P值<0.05,即酶解温度对实验结果影响差异有统计学意义。因此,较好的工艺组合为A3B3C1D1。所以最佳酶提取条件为:酶解pH 5.5、温度60℃、酶用量20 U/g、酶解时间100 min。

表2 纤维素酶解正交试验结果Tab 2 Orthogonal test results in cellulase degradation
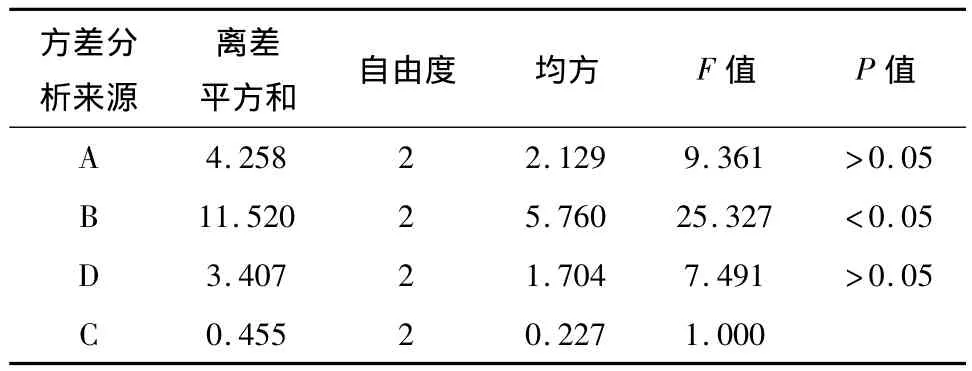
表3 纤维素酶解方差分析Tab 3 Variance analysis for cellulase degradation
3.3 验证性实验 称取滁菊药渣粗粉2.0 g 3份,按2.3方法在酶解 pH 5.5、温度 60℃、酶用量20 U/g、酶解时间100 min的条件下提取滁菊多糖,按2.4公式计算出滁菊多糖平均得率为13.89%,多糖得率高于正交试验组;另称取滁菊药渣粗粉2.0 g 3份,不经酶解直接提取,滁菊多糖平均得率为5.32%。因此,经过纤维素酶解处理,可以显著提高多糖得率。
3.4 滁菊多糖对DPPH自由基和超氧阴离子自由基的清除作用 表4可以看出,滁菊多糖浓度范围在0.2~1.0 mg/ml对 DPPH自由基的清除率在47.25% ~89.92%,随着浓度增加,清除率迅速增大。滁菊多糖在高浓度下(1.0 mg/ml)清除率已经超过0.2 mg/ml的抗坏血酸溶液,具有较好的抗氧化作用。同浓度的滁菊多糖对DPPH自由基清除率比对超氧阴离子自由基更高。
滁菊多糖浓度范围在0.2~1.0 mg/ml对超氧阴离子的清除率为 8.66% ~48.26%,浓度为1.0 mg/ml的滁菊多糖清除率超过 0.2 mg/ml的抗坏血酸。表明滁菊多糖对超氧阴离子自由基具有一定的清除作用,说明滁菊多糖在高浓度下抗氧化活性较好。
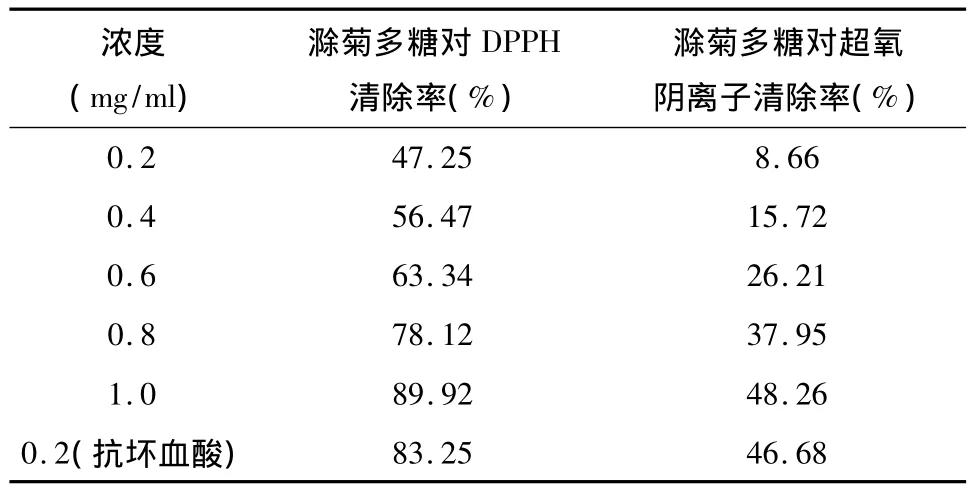
表4 滁菊多糖对DPPH自由基和超氧阴离子自由基清除率Tab 4 Scavenging rates of DMP on DPPH free radical and superoxide anion free radical
4 讨论
本研究中通过纤维素酶解滁菊药渣得到的多糖得率低于刘汉珍等[7]通过果胶酶酶解滁菊得到的多糖得率。果胶是一种酸性多糖,果胶的存在不同程度影响或阻碍中性多糖的释放[9]。果胶酶通过促进中性多糖溶出,提高了多糖得率,但同时由于增大了中性多糖在粗多糖中的比例,改变了原有粗多糖的组成。而纤维素酶是通过降解细胞壁纤维素从而促进多糖成分的溶出[10],显著高于热水浸提法。纤维素酶破坏植物细胞壁,使细胞内容物更易溶出,同时也会促进纤维多糖溶出,增大了多糖得率,此法温和高效,保证药效成分的稳定。比较两者提取工艺:果胶酶法提取的最佳条件(也是酶处理的最佳条件)为酶解温度50℃、酶解时间1.5 h、酶用量52.96 U/g;本文纤维素酶法提取最佳条件为酶解pH 5.5、温度 60 ℃、酶用量 20 U/g、酶解时间100 min,虽然酶解温度略高,但酶用量和酶解时间均小于果胶酶,较为经济。酶法提取工艺应用越来越广泛,本文仅讨论单一酶法提取,本研究将进一步探讨复合酶法[11]提取,以期获得更好的提取工艺,提高提取效率。
滁菊多糖抗氧化试验表明,从药渣中提取的滁菊多糖具有较好的抗氧化性。其中,对DPPH自由基的清除效果较好,具有较强的还原力,且随着浓度的增大还原力逐渐增强。与清除超氧阴离子自由基相比,同浓度的滁菊多糖对DPPH自由基清除率更高。清除作用机理可能由于多糖分子容易捕获并结合自由基,自由基浓度下降,因此显现出较强的清除能力,随着浓度升高,清除能力逐渐饱和。而滁菊多糖清除超氧阴离子自由基可能是由于多糖分子的半缩醛羟基与超氧阴离子自由基发生氧化还原作用[12],而前者是具有还原性的。滁菊多糖的抗氧化性可能是其具有诸多功能的作用机理之一,但目前对于抗氧化性能的研究还停留在初步阶段,有待进一步深入研究。滁菊作为中国传统的茶饮品和中药材,具有广阔的应用前景和工业价值,本研究将对滁菊多糖的结构和组成作进一步分析,为滁菊合理化生产和滁菊多糖作为天然抗氧化剂进行开发提供理论参考。
[1]王亚君,郭巧生,杨秀伟,等.安徽产菊花挥发性化学成分的表征分析[J].中国中药杂志,2008,33(19):2207 -2211.
[2]王松,鲍方印,郑玉华.滁菊中黄酮类化合物提取条件的优化[J].食品科学,2010,31(12):80 -82.
[3]张启勇.滁菊中水溶性总黄酮的稳定性分析[J].滁州学院学报,2009,11(6):111 -112.
[4]江华.黄精多糖的抗肿瘤活性研究[J].南京中医药大学学报,2010,26(6):479 -480.
[5]马宁,杨培君,李会宁,等.石参多糖的体外抗氧化活性研究[J].食品工业科技,2011,32(11):148 -155.
[6]马力,陈文,张嵩安,等.醇析水提法提取菊花中菊花多糖[J].医药导报,2007,26(5):467 -468.
[7]刘汉珍,宋飞,俞浩,等.酶法提取滁菊多糖的工艺优化[J].中药材,2010,33(10):1632 -1636.
[8]刘丽敏,年四辉,吴海振.纤维素酶法提取断血流皂苷的工艺研究[J].中成药,2011,33(1):165 -167.
[9]范会平,李瑜,艾志录,等.超声辅助果胶酶法提取大枣中性多糖研究[J].江苏农业科学,2010(5):384- 386.
[10]李晋,徐怀德,李钰金,等.洋葱多糖纤维素酶法提取及其抗氧化性研究[J].西北植物学报,2010,30(11):2345 -2350.
[11]吴佳慧,王林,高菲,等.香菇多糖的酶法提取[J].食品与发酵工业,2011,37(11):201 -205.
[12]李燕凌,张志旭,胡令.茯苓多糖抗氧化性研究[J].天然产物研究与开发,2012(24):1126-1128.

