X52钢在普光气田服役条件下的CO2腐蚀行为
王晓博,俞宏英,关 望,孙冬柏
(1北京科技大学 腐蚀与防护中心,北京100083;2北京科技大学 国家材料服役安全科学中心,北京100083)
随着中国经济发展对能源需求的不断增加,油气管线建设得到蓬勃发展。但随着时间的延长,管线钢的CO2腐蚀问题不可避免地暴露出来[1-5]。作为中国已发现的5个储量在2000亿立方米以上气田之一的普光气田,其CO2含量的变化范围为7.89%~10.53%,平均含量为8.64%[6],CO2腐蚀问题很突出[7,8]。CO2的腐蚀可能使油气井的寿命下降到18个月,甚至6个月[9]。因此研究管线钢在CO2环境下的腐蚀速率、腐蚀特征、腐蚀形态以及可能存在的失效形式是非常必要的[10]。本工作以普光气田常用管线钢X52在其特定服役条件下的温度和CO2浓度为依据,通过高温高压实验模拟普光气田的实际使用环境,研究X52钢在CO2水溶液中的腐蚀速率和腐蚀形态,为普光气田的选材及决策提供科学依据。
1 实验
X52钢的化学成分如表1所示。根据HG/T3523—2008标准,本实验中腐蚀挂片尺寸为50mm×25mm×2mm。实验前先将挂片试样用40,600,800,1200#砂纸逐级打磨,再放入丙酮中除油,并用脱脂棉擦拭试样表面,去离子水冲洗,冷风吹干后,将试样用滤纸包好并放入干燥器中恒重24h后称重待用。实验在3L哈氏合金高压釜内进行。实验条件:CO2浓度分别为4,6,8g/L,在每个浓度梯度下分别选取25,60,90,120,140℃五个温度点,实验周期为96h。实验前先向高压釜内通入高纯氮气3h除氧,再升温并通入CO2直到达到所需的参数。

表1 X52钢的化学成分(质量分数/%)Table1 Chemical composition of X52steel(mass fraction/%)
用LEO 1450型扫描电子显微镜观察腐蚀产物膜形貌;用能谱分析仪分析腐蚀产物膜中元素含量;用DMAX-RB 12kW型X射线衍射仪分析腐蚀产物膜结构;用电子分析天平称重,计算试样腐蚀速率;用Nano Indenter II纳米力学探针测试产物膜的弹性模量和硬度。所用酸洗液成分:500mL盐酸+500mL去离子水+3.5g六次甲基四铵。
为了固定CO2在水中的溶解度,采用增加CO2分压的方法,在不同温度下依据CO2溶解度数据,控制CO2分压,以保证各个实验点在水中的CO2溶解度相同。
为了得到准确的腐蚀失重数据,实验采用分段采集试样质量法,即样品每酸洗30s后称重一次,并以此绘制质量-时间曲线,以得到关于酸洗时间的最佳值。图1为温度90℃、CO2浓度4g·L-1时质量随酸洗时间的变化曲线图。可知,在该实验条件下,样品在酸洗进行到600s时质量已不发生明显变化,因此此后的失重则可认为是由酸洗液对基体造成的质量损失,故不计算在腐蚀失重当中。
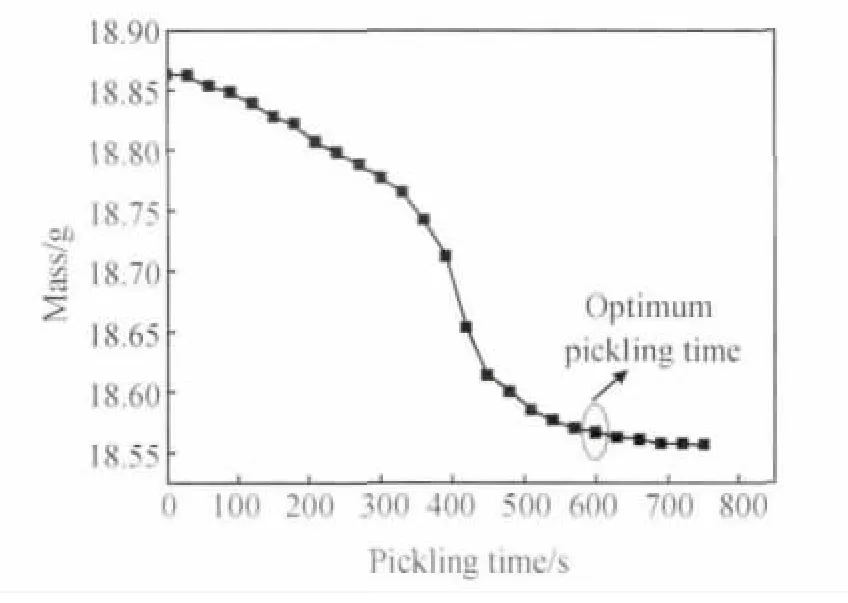
图1 质量随酸洗时间的变化曲线Fig.1 Variation of mass with the change of pickling time
2 结果及分析
X52钢在不同实验条件下的最佳酸洗时间如表2所示。可知,在同一浓度下,随着温度的升高,酸洗时间呈现出增大的趋势,因为随着温度的升高,腐蚀产物膜的致密性及与基体的结合力越来越好,使清除腐蚀产物膜越来越困难;在同一温度下,随着浓度的提高,酸洗时间总体上在6g/L时出现极大值,这可能是由于CO2浓度对腐蚀产物膜性能影响较大,且存在一个最适宜浓度的缘故。

表2 不同温度、不同CO2浓度下腐蚀试样的最佳酸洗时间(s)Table2 The optimum pickling time of samples at different temperatures in different CO2concentrations(s)
根据得到的失重数据,依据公式(1)计算腐蚀速率(表3)。
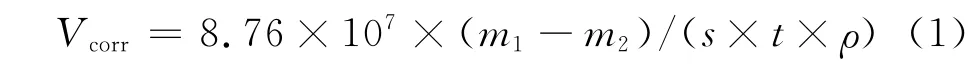
式中:Vcorr为腐蚀速率,mm/a;m1,m2分别为腐蚀前后挂片的质量,g;s为挂片的面积,cm2;ρ为X52钢的密度(7.86kg/m3);t为腐蚀时间,h。
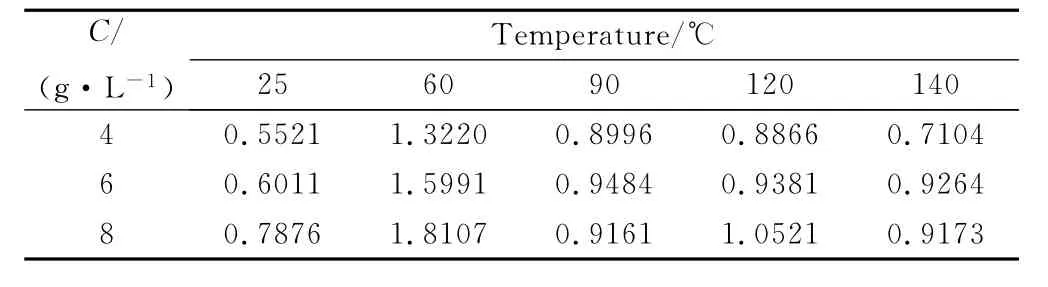
表3 X52钢在不同温度、不同CO2浓度下的腐蚀速率(mm/a)Table3 The corrosion rate of X52steel at different temperatures in different CO2concentrations(mm/a)
根据NACE RP-0775—91中关于腐蚀程度的规定,本实验中X52钢在CO2水溶液中的腐蚀均属极严重腐蚀。最大腐蚀速率为1.8107mm·a-1(60℃时)。
2.1 温度对腐蚀速率的影响
图2为不同CO2浓度下X52钢的腐蚀速率随温度的变化曲线图。可知,当T<60℃时,腐蚀速率均随温度的升高而增加;在60℃附近出现极大值;当T>60℃时,腐蚀速率反而随着温度的升高而减小;当温度为120℃时,腐蚀速率又出现一极大值;但当温度超过90℃时,腐蚀速率总体上变化比较平缓。

图2 不同CO2浓度下X52钢的腐蚀速率随温度的变化曲线Fig.2 Variation of the corrosion rate of X52steel with the change of temperatures in different CO2concentrations
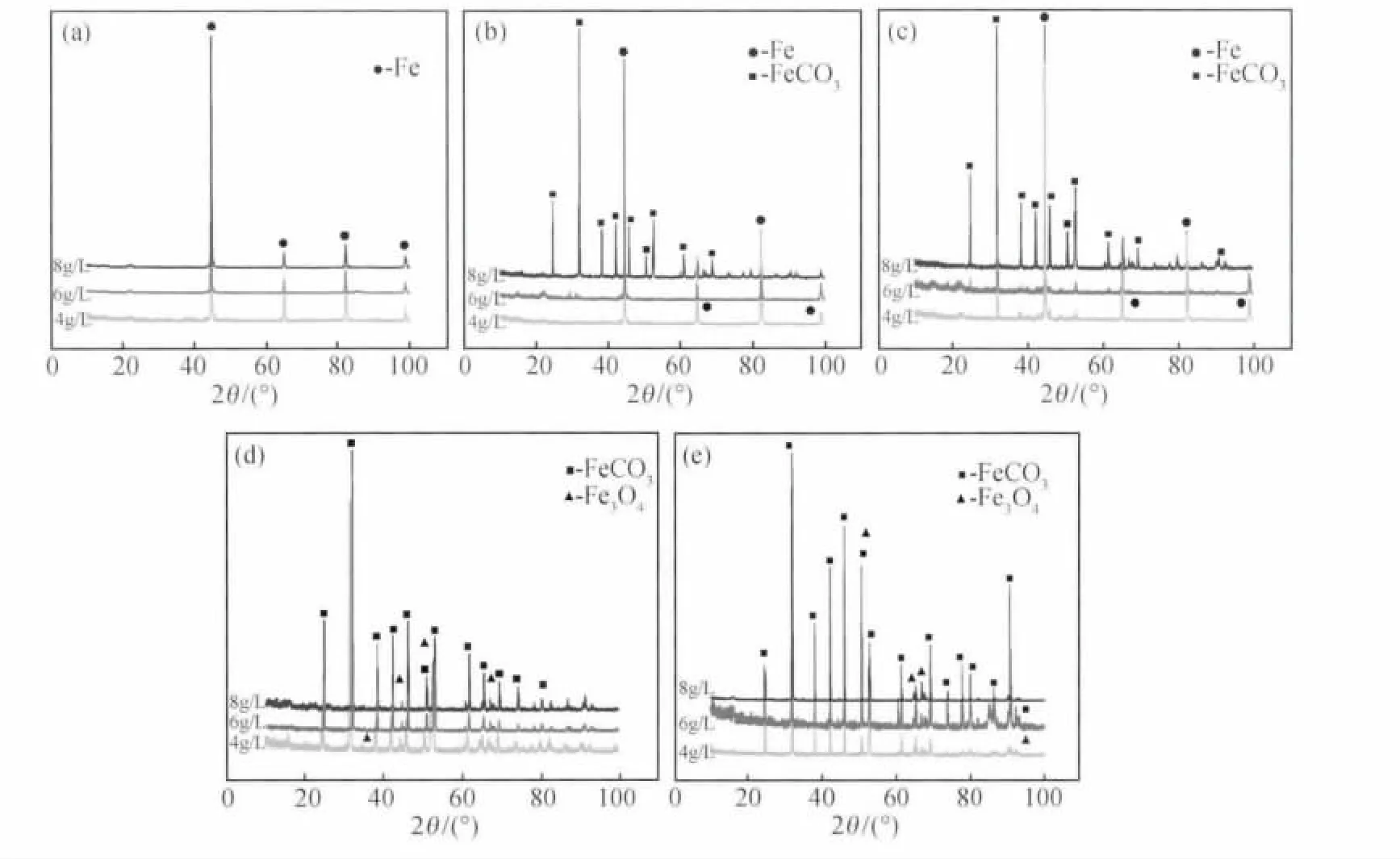
图3 不同温度、不同浓度下腐蚀产物的XRD图(a)25℃;(b)60℃;(c)90℃;(d)120℃;(e)140℃Fig.3 XRD patterns of corrosion scale on surfaces at different temperatures in different CO2concentrations(a)25℃;(b)60℃;(c)90℃;(d)120℃;(e)140℃
图3,4分别为X52钢在不同温度、不同CO2浓度下的腐蚀产物XRD分析图和表面腐蚀产物膜形貌。由图3(a)可知,在25℃下,试样经腐蚀后表面成分主要为Fe,结合图4(a),(a1),(a11)可知,此时试样表面只产生了少量的腐蚀产物,这是因为此时形成的腐蚀产物膜溶解度很大,故而试样表面大部分地区仍为裸露的基体;随着温度的继续升高,一方面,既增加了反应速率,也增加了溶液的对流和扩散,减小了电解液的电阻,从而增加了阳极过程和阴极过程[11],因此随着温度的升高,Fe2+的生成速率加快,从而使腐蚀速率有增大的趋势;另一方面,由于试样表面形成的Fe2+来不及扩散而易在其附近形成过饱和层,且FeCO3的溶解度具有负的温度系数[12]——当温度超过60℃时,FeCO3的溶解度随着温度的升高而减小,这也使试样表面附近的FeCO3呈现出过饱和状态,二者的共同作用导致FeCO3在试样表面的沉积速率加快,反而抑制了腐蚀过程的进行。两种机制彼此竞争,因此导致了腐蚀速率随温度升高的非线性变化,在本实验条件下表现为腐蚀速率在60℃出现极大值;温度为90℃时,FeCO3的溶解度越来越小,成膜速率越来越快,虽然此时腐蚀产物晶粒尺寸较大且存在较多缺陷(图4(c),(c1),(c11)),但这层FeCO3膜仍具有一定的保护性[13],从而使腐蚀速率降低;温度为120℃时,XRD分析结果主要为FeCO3和Fe3O4,说明在较高温度下,发生了3Fe+4H2O=Fe3O4+4H2反应,从而使腐蚀速率在120℃时又出现极值;当温度升高到140℃时,试样表面全部被FeCO3和Fe3O4所覆盖,此时生成的产物膜更加致密(图4(e),(e1),(e11)),且附着力更强,从而对基体的保护效果更加明显,而且,由于FeCO3膜的不均匀生长、脱落、溶解和新的产物膜的生长之间形成了一种动态平衡,故而使腐蚀速率趋于稳定。
2.2 CO2分压对腐蚀速率的影响
根据Duan等[14]的CO2溶解度计算模型及其相应的计算软件计算出不同浓度下对应的CO2分压,如表4所示。

图4 X52钢在不同温度、不同CO2浓度下表面腐蚀产物膜的形貌(a)25℃;(b)60℃;(c)90℃;(d)120℃;(e)140℃Fig.4 Morphologies of corrosion scale on surface of X52steel at different temperatures in different CO2concentrations(a)25℃;(b)60℃;(c)90℃;(d)120℃;(e)140℃
结合表3和图2可知,在同一温度下,随着CO2分压的增加,腐蚀速率总体上呈现出增加的趋势。这是因为当CO2分压增加后,一方面,CO2的溶解度增大,从而使溶液酸性增强,这就加大了氢去极化作用,故而随着CO2分压的增加腐蚀速率加大;另一方面,随着腐蚀速率的增大,金属表面附近越容易形成Fe2+过饱和溶液层,从而促进FeCO3等保护性腐蚀产物膜的形成,抑制腐蚀;实际的腐蚀状况是这二者协调作用的结果。
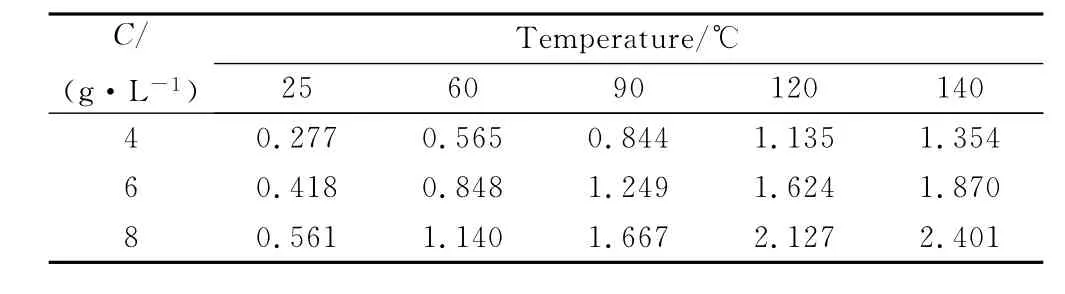
表4 不同温度和浓度下CO2在水中的分压(MPa)Table4 Calculated partial pressure of CO2in water at different temperatures in different CO2concentrations(MPa)

图5 6g/L CO2浓度下不同温度时的腐蚀产物膜截面SEM照片(a)25℃;(b)60℃;(c)90℃;(d)140℃Fig.5 Images of the corrosion scales cross-section formed in the 6g/L CO2concentration at different temperatures(a)25℃;(b)60℃;(c)90℃;(d)140℃
图5为6g/L CO2不同温度时的腐蚀产物膜截面SEM形貌图。通过观察可以发现:25℃时试样表面只形成一层厚度约为1μm的产物膜,且可以明显看到该产物膜与基体分离,这是因为此时形成的FeCO3溶解度大的缘故;60℃时腐蚀产物膜平均膜厚大约为25μm;90℃时产物膜厚度大约为20μm且膜厚比较均匀;140℃时腐蚀产物膜厚度大约为15μm,最大蚀坑深度达到30μm。可知,随着温度的升高腐蚀产物膜厚度先增大后减小,因为随温度的升高,FeCO3的溶解度越来越小,致使产物膜越来越厚,但由于H2CO3是弱酸,腐蚀液中含有大量未电离的H2CO3分子,从而在腐蚀液与产物膜交界处发生反应:

由于Fe(HCO3)2在腐蚀液中的溶解度要比FeCO3的溶解度大,所以该溶解反应致使腐蚀产物层厚度减小,但这种溶解反应只是对产物膜外层的疏松膜溶解效果明显,并不能破坏膜的保护效果,从而最终使膜厚趋于稳定。
表5为图5中A,B区域的EDS分析结果。可见,腐蚀坑区域Mn和O含量偏大,因此认为该区域存在Mn,O元素的偏析,从而造成组织不均匀。由于钢中微观区域这种成分的差异,使偏析处基体表面的产物膜完整性较差,在此首先诱发局部腐蚀。
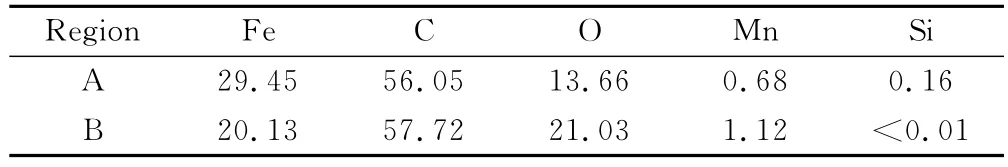
表5 腐蚀产物EDS分析结果(质量分数/%)Table5 EDS analysis result of corrosion scale(mass fraction/%)
2.3 腐蚀产物膜的力学性能
图6为6g/L CO2浓度时不同温度下形成的产物膜载荷-位移曲线(a)、弹性模量(b)和硬度(c)。可见,腐蚀产物膜的硬度和弹性模量随着温度的升高而增大。Ramachandran等[15]计算表明,FeCO3腐蚀产物膜的弹性模量随膜中孔隙率的增加而降低,单晶FeCO3的弹性模量为185GPa,当孔隙率为50%时,弹性模量降低到约80GPa。结合本实验结果可知:腐蚀产物膜随着温度的升高其孔隙率越来越小,膜层变得越来越致密。此外,由于产物膜弹性模量与基体弹性模量的差异,致使在产物膜的生长过程中,由于内应力的作用,产物膜与基体界面处由于变形不协调而产生各种缺陷,导致界面处结合力较差,从而对基体的保护作用变弱。X52钢的弹性模量约为220GPa,当温度为60℃时,产物膜与基体的弹性模量差异最大,从而产物膜对基体的保护效果也最差,这也解释了60℃出现腐蚀极大值的原因。

图6 6g/LCO2浓度下不同温度时腐蚀产物膜的载荷-位移曲线(a)、弹性模量(b)和硬度(c)Fig.6 Load-displacement curves(a),elastic modulus(b)and hardness(c)of corrosion scale in the 6g/LCO2concentration at different temperatures
图7(a)是腐蚀速率与腐蚀产物膜硬度的关系曲线。通过对实验数据的拟合,得到腐蚀产物膜硬度与腐蚀速率呈指数衰减规律:

式中:x为产物膜硬度,GPa。X52钢腐蚀速率随着硬度的减小而增大,当产物膜硬度降低到1GPa以下时,腐蚀速率迅速增大。可见,腐蚀产物膜对基体要起到一定的保护作用需要具有一定的临界力学性能。
图7(b)是腐蚀速率与腐蚀产物膜弹性模量的关系曲线。通过对实验数据的拟合,得到腐蚀速率与产物膜弹性模量呈指数衰减规律:

可见,腐蚀速率随产物膜弹性模量的增大而减小,当弹性模量超过150GPa时,腐蚀速率趋于稳定,因为弹性模量越大,产物膜的致密性越好,故而对基体的保护效果越明显。
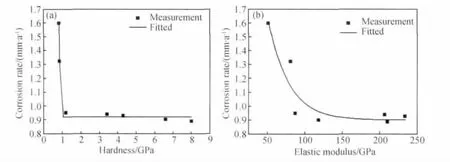
图7 腐蚀产物膜的硬度(a)和弹性模量(b)与腐蚀速率的关系Fig.7 Relation between the hardness(a),the elastic modulus(b)and corrosion rate of corrosion scale
3 结论
(1)X52钢在本实验条件下均属极严重腐蚀,最大腐蚀速率达1.8107mm/a。
(2)CO2腐蚀最敏感温度为60℃。当温度低于60℃时,X52钢腐蚀速率随温度升高而迅速增加;当温度高于60℃时,其腐蚀速率随温度升高而减小。
(3)腐蚀类型以全面的均匀腐蚀为主,并伴有轻微的局部腐蚀,且随温度和CO2分压的升高局部腐蚀敏感性增大。
(4)随着温度的升高,腐蚀产物膜的致密性提高,弹性模量和硬度呈现出增大的趋势。
[1]KERMANI M B,MORSHED A.Carbon dioxide corrosion in oil and gas production a compendium[J].Corrosion,2003,59(8):659-681.
[2]CROLET J L,BONIS M R.How to pressurize autoclaves for corrosion testing under carbon dioxide and hydrogen sulfide pressure[J].Corrosion,2000,56(2):167-182.
[3]SHADLEY JR,SHIRAZIS A,DAYALAN E,et al.Prediction of erosion corrosion penetration rate in a carbon dioxide environment with sand[J].Corrosion,1998,54(12):972-979.
[4]SRDJAN NESIC.Key issues related to modeling of internal corrosion of oil and gas pipelines—a review[J].Corrosion Science,2007,(49):4308-4338.
[5]赵国仙,吕祥鸿,韩勇.某井油管腐蚀原因分析[J].材料工程,2010,(3):51-55.ZHAO Guo-xian,LU Xiang-hong,HAN Yong.Analysis of the reason on tubing corrosion failure[J].Journal of Materials Engineerins,2010,(3):51-55.
[6]李顺林,姚慧智,赵果,等.普光高酸性气田井筒管材及完井方案优选[J].钻井工程,2011,31(9):79-81.LI Shun-lin,YAO Hui-zhi,ZHAO Guo,et al.Optimal selection of downhole tubular goodsand well completion programs for the Puguang sour gas field[J].Natural Gas Industry,2011,31(9):79-81.
[7]龚金海,刘德绪,王晓霖.普光气田集输系统的腐蚀控制技术[J].腐蚀与防护,2012,33(4):317-319.GONG Jin-hai,LIU De-xu,WANG Xiao-lin.Corrosion control technique for high-sulphur gas gathering and transferring system in Puguang gas field[J].Corrosion and Protection,2012,33(4):317-319.
[8]王风平,李晓刚,杜元龙.油气田开发中的CO2腐蚀[J].腐蚀科学与防护技术,2002,14(4):223-226.WANG Feng-ping,LI Xiao-gang,DU Yuan-long.A review on carbon dioxide corrosion of steel in field exploitation[J].Corro-sion Science and Protection Technology,2002,14(4):223-226.
[9]VIDEM K,DUGSTAD A.Effect of flow velocity,pH,Fe2+concentration and steel quality on the CO2corrosion of carbon steels[A].NACE,Corrosion/1990[C].Houston:NACE,1990.
[10]GAO Ke-wei,YU Fang,PANG Xiao-lu,et al.Mechanical properties of CO2corrosion product scales and their relationship to corrosion rates[J].Corrosion Science,2008,50(10):2796-2803.
[11]魏宝明.金属腐蚀理论及应用[M].北京:化学工业出版社,1984.217-218.WEI B M.Metallic Corrosion Theories and Applications[M].Beijing:Chemical Industry Press,1984.217-218.
[12]林冠发,白真权,赵新伟,等.温度对二氧化碳腐蚀产物膜形貌特征的影响[J].石油学报,2004,25(3):101-105.LIN Guan-fa,BAI Zhen-quan,ZHAO Xin-wei,et al.Effect of temperature on scales of carbon dioxide corrosion products[J].Acta Petrolei Sinica,2004,25(3):101-105.
[13]陈长风,赵国仙,路民旭,等.N80钢CO2腐蚀产物膜研究[J].中国腐蚀与防护学报,2002,22(3):143-147.CHEN Chang-feng,ZHAO Guo-xian,LU Min-xu,et al.Study of CO2corrosion scales on N80steel[J].Journal of Chinese Society for Corrosion for Corrosion and Protection,2002,22(3):143-147.
[14]DUAN Zheng-hao,SUN Rui.An improved model calculating CO2solubility in pure water and aqueous NaCl solutions from 273to 533Kand from 0to 2000bar[J].Chemical Geology,2003,193(3-4):257-271.
[15]RAMACHANDRAN S,CAMPBEL L S,WARD M B.The interactions and properties of corrosion inhibitors with byproduct layers[A].Corrosion 2000[C].Houston:NACE,2000.

