MBP促进出血性卒中大鼠康复的作用机制研究
袁 宇,郭 毅,李春晖,史彦芳,胡福广
(1.河北大学附属医院,河北保定071000;2.河北医科大学第二医院,河北石家庄050000)
出血性卒中占全部脑卒中的20%~30%,病死率和致残率高,是危害人类健康的主要疾病之一。在全球,每年有数千万人罹患出血性卒中,其中35%~52%的病例在1个月内死亡,病情加重的主要原因是出血后的继发性脑损害,因此如何阻断继发性脑损害的发生成为人们关注的热点。免疫系统在损害扩散过程中的作用一直存有争议,一方面抗炎性化合物,如甲基泼尼松龙在创伤后早期阶段具有对抗损伤蔓延的作用;另一方面炎性细胞(巨噬细胞)又是损伤神经纤维修复所需要的。此前研究证实,髓鞘碱性蛋白(MBP)免疫治疗对缺血性脑损伤、创伤性脑损伤均有保护作用[1]。本研究应用大鼠出血性卒中模型,通过观察脑组织中胶质纤维酸性蛋白(GFAP)与脑源性神经营养因子(BDNF)的免疫组化表达和脾脏中Foxp3 mRNA的表达,探讨MBP免疫治疗对出血性卒中后中枢神经系统创伤的神经保护作用机制。
1 实验资料
1.1 实验动物和分组 健康成年雌性SD大鼠(动物由河北医科大学实验动物中心提供,自然昼夜节律,自由饮水和标准饲料喂养)60只,体质量(300±20)g。采用随机数字表分为MBP组、卵白蛋白(OVA)组、磷酸盐缓冲盐水(PBS)组各20只。根据干预时间点的不同,每组分为5个亚组,每组4只大鼠。1.2 试剂和仪器 MBP抗原、OVA抗原、不完全弗式佐剂(IFA)购自Sigma公司;逆转录酶(AMV-RT)、核糖核酸酶抑制剂(RNasin)、dNTP、琼脂糖(agarose)及 Taq DNA聚合酶(Taq DNA polymerase)由Promega公司提供。GFAP兔抗大鼠多克隆抗体及BDNF兔抗大鼠多克隆抗体购自武汉博士德生物工程公司。目的基因Foxp3的引物合成序列根据Poussier等[2]的方法设计,Foxp3引物序列:上游引物为5’-TGCATCAGCTCTCCACTGTAGACGCA-3’,下游引物为 5’-CGCTCAGGTACACCCAGGAAAGACAG-3’,大鼠 β-actin引物序列:上游为5’-GCCATGTACGTAGCCATCCA-3’,下游为5’-GAACCGCTCATTGCCGATAG-3’,上海生物工程公司合成。NARISHIGE SR-6N型脑立体定向仪(日本),GeneAmp 9600型PCR仪(美国PE公司)。
1.3 大鼠脑出血模型的制备 按照张祥建等[3]大鼠自体动脉血脑出血造模方法建立模型。
1.4 行为学评分 参照Longa五级评分法进行神经功能缺损评分。0级:无体征,记0分;Ⅰ级:动物不能完全伸直其前肢,计1分;Ⅱ级:动物一侧肢体瘫痪,有追尾现象,计2分;Ⅲ级:动物不能站立、打滚,计3分;Ⅳ级:无自发性活动,有意识障碍,计4分[4]。造模成功12 h后,评分为2分大鼠入组。每天进行行为学评分。
1.5 主动免疫 脑出血模型建立后12 h,分别取IFA乳化的MBP、VOA、PBS于大鼠右下肢皮下注射,用量MBP 300μg/只,VOA 200 μg/只,PBS 200 μg/只。
1.6 标本取材 免疫后1,3,7,14,21 d对各组动物取材。10%水合氯醛按300 mg/kg腹腔注射麻醉。胸腹腔联合切开,摘除脾脏,置冻存管中-80℃液氮保存。断头取脑,石蜡包埋,4μm连续冠状切片,取3张连片,分别做GFAP、BDNF免疫组织化学反应和HE染色。
1.7 RT-PCR法检测Foxp3 mRNA 取脾脏组织100 mg,提取总RNA,-80℃保存备用。检测提取RNA完整性,目的基因PCR扩增,同时扩增鼠β-actin用作内参照,RT-PCR产物半定量分析,计算Foxp3与β-actin的相对密度值,以此代表目的片断相对表达值。
1.8 GFAP、BDNF免疫组化观察 分别按操作说明进行,结果以胞浆清晰、棕色着色颗粒为阳性,细胞无棕色染色颗粒为阴性。采用计算机图像分析系统进行定量分析,测定阳性反应物灰度值和阳性细胞的百分数,标准如下:A为阳性细胞数分级,0~1%=0,>1%~10%=1,>10%~50%=2,>50%~80%=3,>80%~100%=4,B为阳性细胞显色强度分级,0为阴性、1为弱阳性、2为阳性、3为强阳性,免疫组化评分(HIS)=A×B。
2 结 果
2.1 模型建立成功 在注射自体动脉血液后,大鼠迅速出现行为和功能异常,表现为反应迟钝,精神萎靡,饮食下降,皮毛欠光泽,一侧肢体不同程度的瘫痪,追尾现象明显,严重者动物不能站立、打滚,个别动物出现意识障碍,其功能异常程度与病变严重程度一致。脑组织标本可见明显的血肿占位,提示模型建立成功。
2.2 行为学评分 MBP组Longa行为学评分显著低于OVA组和PBS组,见表1。
表1 3组间Longa行为学评分比较(±s,分)
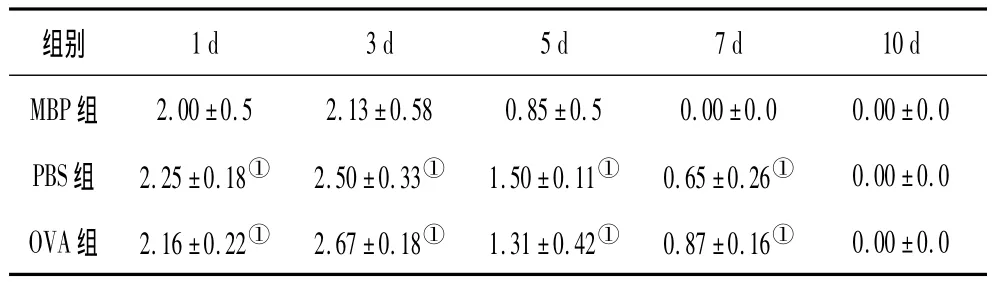
表1 3组间Longa行为学评分比较(±s,分)
注:①与MBP组比较,P<0.05。
OVA组 2.16±0.22① 2.67±0.18① 1.31±0.42① 0.87±0.16①0.00±0.0
2.3 免疫组化
2.3.1 GFAP的免疫组化结果 在光镜下,MBP组和PBS组大鼠在脑出血后,脑组织血肿周围即可见GFAP表达,染色较均匀,结构完整的GFAP阳性星形胶质细胞呈蜘蛛样,胞体肥大,胞浆呈颗粒状、增粗,血肿周边区表达明显,见图1及图2。大鼠脑组织GFAP阳性细胞免疫组化评分看,MBP组明显高于PBS组及OVA组(P均<0.01),PBS组和OVA组比较无显著性差异,见表2。

图1 MBP组脑出血大鼠治疗后GFAP的表达(×400)
2.3.2 BDNF的免疫组化结果 在光镜下,MBP组和PBS组大鼠脑出血后脑组织血肿周围即可见BDNF胞浆棕染的阳性细胞,免疫阳性细胞可见神经元细胞和胶质细胞,见图3及图4。大鼠脑组织BDNF阳性细胞免疫组化评分,MBP组明显高于OVA组及PBS组比较有显著性差异(P均<0.05),PBS组和OVA组比较无显著性差异,见表3。
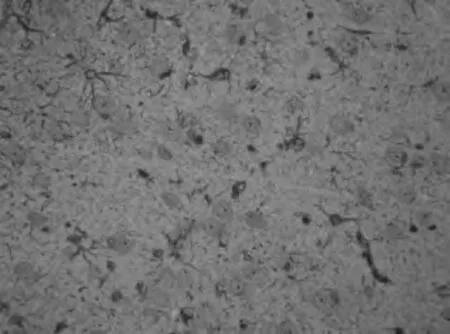
图2 PBS组脑出血大鼠治疗后GFAP的表达(×400)
表2 3组出血周围脑组织中GFAP的表达情况(±s)
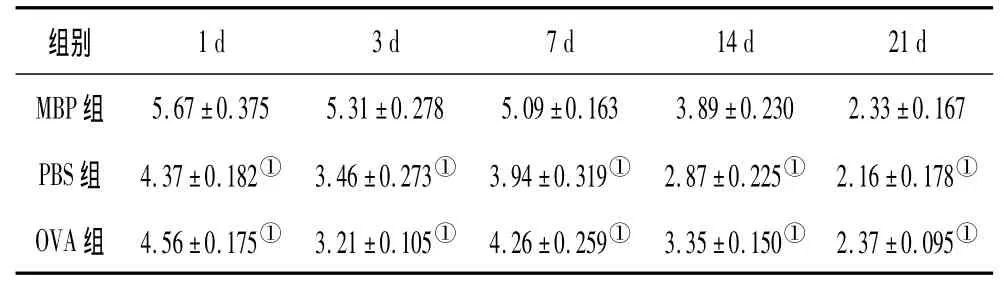
表2 3组出血周围脑组织中GFAP的表达情况(±s)
注:①与MBP组比较,P<0.01。
?
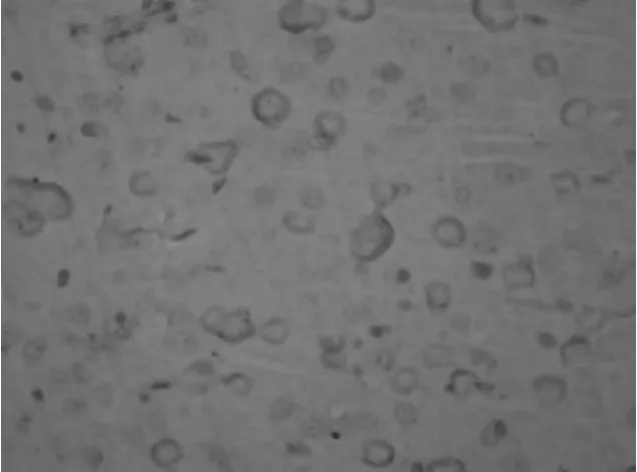
图3 MBP组脑出血大鼠治疗后BDNF的表达(×400)

图4 PBS组大鼠脑出血治疗后BDNF的表达(×400)
表3 3组出血周围脑组织中BDNF的表达情况(±s)
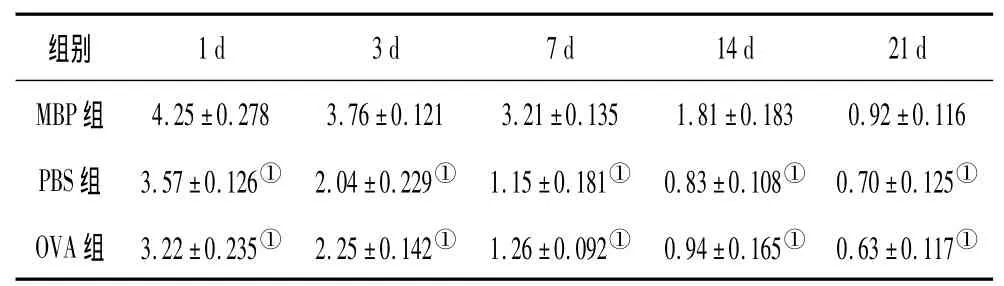
表3 3组出血周围脑组织中BDNF的表达情况(±s)
注:①与MBP组比较,P<0.05。
?
2.4 Foxp3 mRNA的表达 MBP组大鼠脾脏中Foxp3 mRNA的表达在1 d、3 d、7 d、14 d明显低于PBS组和OVA组(P均<0.01),且在7 d时表达最低,在21 d时MBP组与对照组数值较接近,但仍有显著性差异(P<0.05)。PBS组和OVA组比较无显著性差异。见图5、图6及表4。

图5 MBP组大鼠脾脏T细胞Foxp3 mRNA电泳图
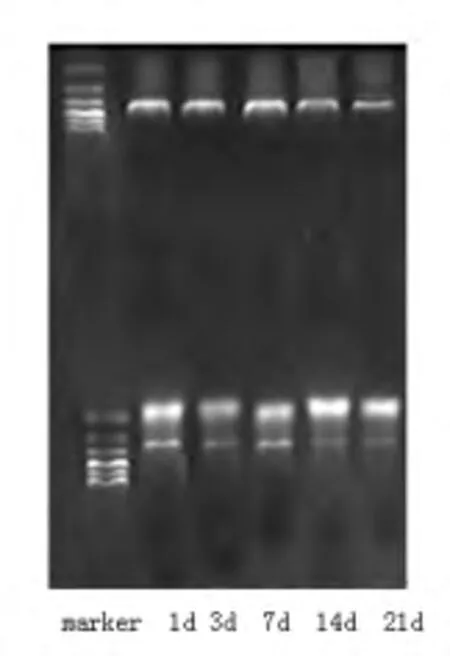
图6 PBS组大鼠脾脏T细胞Foxp3 mRNA电泳图
表4 3组大鼠脾脏中Foxp3 mRNA的表达情况(±s)

表4 3组大鼠脾脏中Foxp3 mRNA的表达情况(±s)
注:①与BMP组比较,P<0.01。
组别1d 3d 7d 14d 21d MBP组 0.454±0.08 0.273±0.05 0.146±0.06 0.462±0.03 0.537±0.06 PBS组 0.736±0.09① 0.674±0.11① 0.619±0.04① 0.586±0.06① 0.651±0.05①OVA组 0.695±0.06① 0.643±0.05① 0.705±0.09① 0.601±0.11① 0.565±0.06①
3 讨 论
脑损伤后积极进行神经保护治疗,对于减轻患者症状、降低病死率与致残率都有着重要意义[5]。对于出血性卒中,中医治疗可以采用辨证论治、通腑泻热、宜通脏腑、通利九窍等治疗[6],西医临床上除运用传统手术、脱水药物及神经营养等药物外,治疗手段较少。本研究试图应用MBP主动免疫实验性脑出血大鼠,以探讨免疫学方法在治疗脑出血中的应用价值。
大鼠在对抗中枢神经系统中有鞘轴突损伤的能力,来源于T细胞介导的保护性自身免疫能力,该能力被有髓特异性T细胞所提呈。当应用MBP去免疫出生动物时,会导致其在成年时不会发生对髓鞘蛋白的保护性免疫反应,致使损伤相比普通动物重。MBP是神经髓鞘的一种特有膜蛋白,在颅内神经系统损伤累及髓鞘时可在脑脊液及血清中检出。Kipnis[7]研究发现,MBP可提高视神经损伤后残余神经元的免疫作用,证实了MBP自身免疫对中枢神经的免疫保护作用,对于MBP反应的T细胞过激转移或用髓磷脂有关抗原主动免疫,通过保护损伤灶外周的神经细胞,可以促进中枢神经损伤的恢复。
在脑组织中的GFAP为神经胶质纤维所特有的一种中间丝蛋白,是星形胶质细胞特异性标记物,GFAP作为一种细胞骨架,具有一定的对抗损伤作用。本研究发现在相应的时间点,MBP组大鼠脑组织中GFAP的表达明显高于OVA组及PBS组。BDNF在成熟的神经系统内,也是神经元执行正常功能和维持活性所必需的,其可通过为损伤神经元提供营养而促进中枢神经损伤后的运动和感觉神经元的恢复。本研究中观察到,3组在脑出血后血肿周围可见零星的BDNF阳性细胞,BDNF阳性细胞的密度和染色深度均较其他侧高,阳性细胞的形态不规则,呈圆形或椭圆形,未见突起,胞浆浅棕色,脑出血后,血肿区内出现呈弱阳性的吞噬细胞,血肿周围细胞免疫反应增强。MBP组在相应时间BDNF的表达高于OVA组及PBS组。结合各组脑出血大鼠行为学的观察对比,表现出了MBP对出血性卒中的脑保护作用。
Foxp3是义头样转录因子家族中的成员,其表达及功能与调节性CD4+CD25+Treg细胞密切相关,在信使RNA及蛋白水平表达Foxp3阳性的CD4+CD25+Treg细胞,其数量的增减与对机体的免疫抑制功能提高和减退呈现相关性[8]。作为一个特异CD4+CD25+Treg细胞表面分子标记物的Foxp3,通过监测其变化就能反映CD4+CD25+Treg抑制功能改变。最近研究表明,去除了天然CD4+CD25+Treg(含总数10%的CD4+),导致动物造成易患器官特殊性免疫疾病的因素[9]。通常自身免疫是被自然存在的调节性CD4+CD25+Treg细胞所抑制的,如果减弱了对有可能的神经元退变起保护作用的自身免疫抑制,那么受损的中枢神经的神经元就会受到保护[10],也就是说,CD4+CD25+Treg的缺失促进中枢神经损伤后神经元的存活。在多发性硬化综合征(MS)和实验性自身免疫性脑脊髓炎(EAE)中,其发病机制都是由于对自身反应性抗原MBP等过激的免疫性损伤造成的,而在中枢神经损伤后,针对MBP适度的免疫反应,其结果就是免疫保护作用,二者具有极相近的免疫反应机制[11]。本实验中MBP组大鼠脾脏的Foxp3 mRNA表达较PBS组及OVA组显著减低,表现出了MBP对CD4+CD25+Treg的抑制作用,从而对神经元的退变起到了保护作用。
本研究显示,MBP组大鼠的行为学评分较PBS组及OVA组低,脑组织内GFAP和BDNF免疫组化表达较PBS组及OVA组显著增强,大鼠脾脏的Foxp3 mRNA表达较PBS组及OVA组显著减低,提示MBP作为自身蛋白在主动免疫大鼠后起到了保护作用。其免疫保护作用机制为通过下调CD4+CD25+Treg细胞对效应细胞的抑制作用,使效应细胞作用上调,最终使星形胶质细胞的活性增强,表达GFAP和BDNF增强,从而促进出血性卒中大鼠的受损脑组织的康复。
[1]Kipnis J,Mizrahi T,Hauben E.Neuroprotective autoimmunity:naturally occurring CD4+CD25+regulatory T cells suppress the ability to withstand injury to the central nervous system[J].Proc Natl Acad Sci USA,2002,99(24):15620-15625
[2]Poussier P,Ning T,Murphy T,etal.Impaired post-thymic development of regulatory CD4+25+T cells contributes to diabetes pathogenesis in BB rats[J].Immunology,2005,174(7):4081-4089
[3]张祥建,刘春燕,祝春华,等.大鼠自体血脑出血动物模型的建立[J]. 脑与神经疾病杂志,2003,11(6):341-344
[4]Longa EZ,Weinstein PR,Carlson S,etal.Reversible middle cerebral artery occlusion without eraniotomy in rats[J].Stroke,1989,20(11):84-91
[5]胡福广,张皓峰,范振增.中枢神经系统损伤与自身免疫神经保护的生理特性[J].脑与神经疾病杂志,2009,17(2):107-110
[6]杨兴勇.出血性脑卒中急性期的中医治疗[J].现代中西医结合杂志,2009,18(15):1773-1774
[7]Kipnis J.Myelin specific Th1 cells are necessary for post-traumatic protective autoimmunity[J].Journal of Neuroimmunology,2002,130(1):78-85
[8]Kawamoto N,Ohnishi H,Kondo N,etal.The role of dendritic cells in the generation of CD4(+)CD25(HI)Foxp3(+)T cells induced by amino acid copolymers[J].Strominger International Immunology,2013,25(1):53-65
[9]Sellebjerg F,Krakauer M,Khademi M,etal.FOXP3,CBLB and ITCH gene expression and cytotoxic T lymphocyte antigen 4 expression on CD4(+)CD25(high)T cells in multiple sclerosis[J].Clinical and Experimental Immunology,2012,170(2):149-155
[10]Göbel K,Bittner N,Melzer N,etal.CD4(+)CD25(+)FoxP3(+)regulatory T cells suppress cytotoxicity of CD8(+)effector T cells:implications for their capacity to limit inflammatory central nervous system damage at the parenchymal level[J].Journal of Neuroinflammation,2012,9(2):41-43
[11]Fissolo N,Costa C,Nurtdinov,etal.Treatment with MOG-DNA vaccines induces CD4+CD25+FoxP3+regulatory T cells and upregulates genes with neuroprotective functions in experimental autoimmune encephalomyelitis[J].Journal of Neuroinflammation,2012,9:139

