星形细胞上调基因-1的研究进展
张 婷,杨 军
(西安交通大学 医学院 第二附属医院 1.科研实验中心; 2.病理科, 陕西 西安 710004)
短篇综述
星形细胞上调基因-1的研究进展
张 婷1,杨 军2*
(西安交通大学 医学院 第二附属医院 1.科研实验中心; 2.病理科, 陕西 西安 710004)
星形细胞上调基因-1(AEG-1)在多种恶性肿瘤中显著高表达,在肿瘤的发生、增殖、血管生成、抗凋亡、侵袭转移及抗药性等多方面发挥重要作用,还参与炎性反应和自然免疫过程。研究表明AEG-1与PI3K/Akt、NF-κB、Wnt/β-catenin等多种信号通路相关,同时参与RNA诱导沉默复合体介导的基因沉默。因此,AEG-1有望成为肿瘤靶向治疗的新靶点。
星形细胞上调基因-1;肿瘤;信号通路;基因沉默;炎性反应
1 AEG-1蛋白结构及亚细胞定位
星形细胞上调基因-1(astrocyte elevated gene-1,AEG-1,又名MTDH)最初在人胚胎初级星形胶质细胞中发现,位于与多种恶性肿瘤发生密切相关的人类8号染色体(8q22)上。其cDNA长3 611 bp,编码582个氨基酸,分子质量为64 ku[1]。蛋白中较多的赖氨酸、丝氨酸和苏氨酸残基可能是潜在的翻译后修饰位点,在其亚细胞定位和活性调节中发挥重要作用。
AEG-1具有一个N端单跨膜结构域(transmembrane domain, TMD)和3个核定位信号(nuclear localization signals, NLS)(图1)。采用不同算法对其在细胞膜上的定位进行分析:PSORTⅡ和Tmpred法推测AEG-1/MTDH为Ⅰb型跨膜蛋白,C末端位于膜内;TMHMM和TopPred2法则推测其为C末端位于膜外的Ⅱ型跨膜蛋白。AEG-1在胞膜、胞质(如内质网、 核周)、 胞核及特定区域核膜、 核仁、 核质中都有见分布[2-3,5-6]。AEG-1 C末端的胞外肺归巢结构域(lung homing domain, LHD)能识别肺血管内皮细胞表面的特定分子,介导4T1小鼠乳房肿瘤细胞的肺转移[1]。AEG-1中68%的赖氨酸集中在NLS及旁侧序列(exNLSs)中(图1)。exNLS-1调节核仁定位;exNLS-3调节胞核定位,且对其核仁定位是必需的;exNLS-2序列内的赖氨酸残基在胞质内被泛素或极少量小泛素相关修饰物单泛素化修饰,推测与蛋白降解无关,可能有助于将AEG-1保留在胞质内[6]。AEG-1的多种亚细胞定位,可能与不同条件下、不同细胞中发挥的作用不同有关。
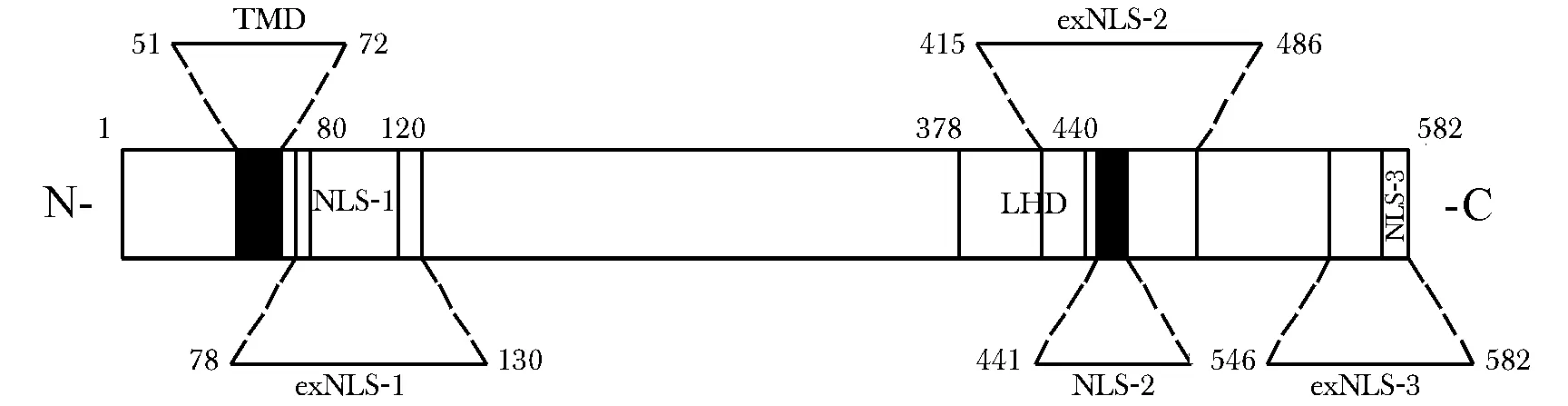
图1 AEG-1蛋白结构域示意图Fig 1 The schematic diagram of AEG-1 protein domains
2 AEG-1可作为恶性肿瘤独立预后因子
研究表明,由于基因组的扩增,或转录、翻译的活化,AEG-1在多种恶性肿瘤(乳腺癌、肝细胞癌、胃癌、结直肠癌、食管鳞状细胞癌、非小细胞肺癌、肾癌、前列腺癌、卵巢癌、子宫内膜癌、宫颈癌、神经母细胞瘤、神经胶质瘤、黑素瘤和头颈癌等[3-4,7-16])中的表达均显著提高。AEG-1的高表达与多种肿瘤的临床发展(包括临床分期、TNM分级、组织分化程度、Ki67表达)显著相关。对109例肝细胞癌组织样本和9例正常肝组织的免疫组化实验表明,正常肝组织中AEG-1无或极少量表达,癌组织中AEG-1的表达与Barcelona临床肝癌分期显著正相关[5]。与高表达AEG-1的肿瘤患者相比,低表达患者的治疗效果和生存时间都显著提高[3-4]。因此,AEG-1有望作为独立的肿瘤预后因子。
3 AEG-1在信号通路网中的作用
异常表达的AEG-1在肿瘤发生、肿瘤细胞存活、增殖、血管生成、抗凋亡、侵袭转移和抗药性等多方面发挥重要作用。AEG-1的复杂作用机制与其在信号通路网中所起的作用有关。研究表明,处于癌基因Ha-Ras下游的AEG-1与PI3K/Akt、NF-κB和Wnt/β-catenin等途径相关[17](图2)。
对AEG-1启动子的研究表明,其-356~-302区存在两个E-box,能与碱性螺旋-环-螺旋(bHLH)蛋白结合。Ha-ras经PI3K/Akt途径使GSK3β磷酸化失活,活化C-MYC(一种bHLH蛋白),后者直接与AEG-1启动子的E-box元件结合,活化AEG-1转录。相反,AEG-1对PI3K-Akt途径也有正反馈作用。反义技术抑制AEG-1在前列腺癌细胞中的表达后,可降低Akt活性、上调下游FOXO3a及P27Kip1分子的表达,诱导前列腺癌细胞凋亡;同时NF-κB和AP-1活性降低,使得细胞的侵袭能力减弱。上调的AEG-1促进食管癌细胞增殖也与Akt/FOXO3a途径相关。
在Hela细胞中,正常表达的AEG-1主要分布在核周和内质网;肿瘤坏死因子-α(tumor necrosis factor,TNF-α)处理后或AEG-1自身异常表达时,胞质内的AEG-1促进NF-κB通路抑制蛋白IκBα降解,使P65从胞质易位入胞核,同时一部分AEG-1也进入细胞核,在核内与P65、CBP形成转录基础复合物,促进NF-κB下游基因(调节肿瘤黏附、侵袭、转移、血管生成等相关分子)的表达。强侵袭转移是恶性胶质瘤不良预后的主要原因,AEG-1还可通过NF-κB P65和AP-1与基质金属蛋白酶9(Matrix metalloproteinases-9,MMP-9)启动子结合,提高MMP-9表达,增强人神经胶质瘤的侵袭能力[18]。AEG-1可通过NF-κB通路诱导人乳腺癌细胞MCF-7发生上皮间充质转化,增强了侵袭转移能力[7]。
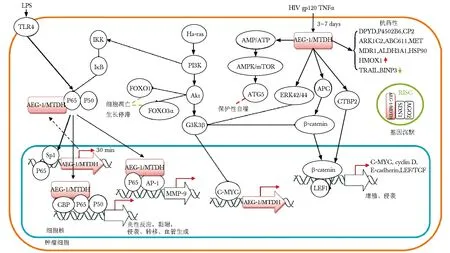
图2 AEG-1复杂作用机制Fig 2 The complex functional mechanisms of AEG-1
AEG-1还可活化Wnt/β-catenin信号通路[5,16]。AEG-1磷酸化活化细胞外信号调节蛋白激酶(extracellular-signal regulated protein kinase 42/44,ERK42/44),后者使糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK3β)磷酸化失活,未被磷酸化的β-catenin移位入细胞核;同时AEG-1使得转录因子淋巴增强因子1(lymphoid enhancer factor 1,LEF1)表达上调,LEF1阻遏物C末端结合蛋白2(C-terminal-binding protein 2,CTBP2)、β-catenin降解复合物组分结肠腺癌样息肉病蛋白(adenomatous polyposis coli protein,APC)表达下调,细胞核内β-catenin与LEF1形成异二聚体活化下游基因转录[5]。Wnt/β-catenin通路的靶基因有C-MYC、cyclinD1、E-cadherin及该途径的自身调节物T细胞转录因子-1(T-cell transcription factor,TCF-1)、LEF1等,共同在肿瘤的发展、侵袭中发挥作用。在胃癌细胞中,AEG-1表达抑制可导致β-catenin、LEF1蛋白水平的降低[11]。
AEG-1可诱导癌细胞启动保护性自噬,利用自身物质提供能量和生物合成所需原料维持生存。高表达的AEG-1使胞内AMP/ ATP比例升高,活化5′-AMP活化蛋白激酶(AMPK),经AMPK/mTOR途径提高自噬调节蛋白5(ATG5)表达,促进自噬体形成,保护永生化人胚胎初级星形胶质细胞免于血清饥饿条件下的凋亡[19]。AEG-1诱导自噬的抑制还可增强癌细胞对化疗药物的敏感程度。
4 AEG-1在肿瘤中发挥作用的具体方面
综述主要关注AEG-1/MTDH在肿瘤发生、发展及侵袭转移过程中的以下几个方面:
4.1 AEG-1与肿瘤血管生成
高表达AEG-1的人肝癌HepG3细胞中血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、胎盘生成因子(placental growth factor,PIGF)、成纤维细胞生长因子α(fibroblast growth factor,FGFα)的表达均显著提高;裸鼠皮下移植后,原不致瘤的HepG3细胞形成大块、高度血管化的肿瘤组织,CD31免疫染色显示有大量微血管形成[5]。AEG-1调节血管生成的作用在转染并高表达AEG-1的永生化克隆大鼠胚胎成纤维细胞、人脐静脉内皮细胞、人恶性胶质瘤细胞中也得到证明,AEG-1促进血管生成素受体2、低氧诱导因子1-α表达,增强了VEGF启动子活性,PI3K/Akt途径在此过程中起重要作用。
4.2 AEG-1与肿瘤耐药
AEG-1可赋予肿瘤细胞广谱的抗药性,包括阿霉素、顺铂、紫杉醇、过氧化氢、4-羟环磷酰胺和辐射等[10]。高表达AEG-1的人肝癌HepG3细胞中,AEG-1可上调多种抗药相关基因的表达,主要涉及药物代谢相关酶类:二氢嘧啶脱氢酶(DPYD)、细胞色素P4502B6、二氢二醇脱氢酶(AKR1C2);代谢酶的转录因子:CP2,活化胸苷酸合成酶转录,后者靶向5-氟尿嘧啶;药物运载蛋白:ABCC11,可将多种化疗药物包括5-氟尿嘧啶排出细胞外[5]。AEG-1还能在不影响转录的基础上,通过PI3K/Akt途径增强MDR1(与多种药物如阿霉素、顺铂排出有关)mRNA与多核糖体的结合,且抑制泛素化后蛋白酶体介导的MDR1降解,在翻译水平增强MDR1表达[20]。然而,AEG-1介导不同肿瘤细胞抗药性的机制还有待进一步研究。
4.3 AEG-1的互作蛋白及在RNA诱导沉默复合体中的作用
通过酵母双杂交[21-22]、免疫共沉淀偶联质谱分析[2,22-23],研究者筛选出一些AEG-1的互作蛋白。作为一种抑制生长、促凋亡的转录阻遏因子,早幼粒细胞白血病锌指蛋白(promyelocytic leukemia zinc-finger,PLZF)在细胞核的核体内,可以SUMO活化形式与AEG-1的N-末端和C-末端相互作用,过量表达的AEG-1通过这种相互作用降低了PLZF与启动子的结合,使其原本抑制的基因(如C-MYC)表达升高,为肿瘤细胞增殖和逃避凋亡提供了可能的途径[21]。
萄菌核酸酶包含结构域1蛋白(staphylococcal nuclease and tudor domain containing 1,SND1)为一种调节mRNA转录、剪切、RNA干扰及mRNA稳定性的多功能蛋白。在胞质中,AEG-1与SND1共同构成RNA诱导沉默复合体(RNA-induced silencing complex,RISC)的组成部分,实现siRNA和miRNA介导的基因沉默。肝癌细胞中,RISC活性增高导致了肿瘤相关miRNA(oncomiRs)介导的抑癌基因mRNA降解(包括:PTEN、P57、P21、SPRY2和TGFBR)和细胞生长、增殖能力的增强,在肝癌发生中起重要作用[22]。而乳腺癌细胞中, AEG-1与SND1强烈促进肺转移,增强肿瘤细胞抗凋亡能力,调节与转移、抗药性相关基因的表达及抑癌基因的沉默[23]。对子宫内膜癌细胞的研究发现,AEG-1阻止应激反应颗粒的形成,AEG-1与SDN1等RNA结合蛋白的结合需要核酸的存在,共同调节有利于癌细胞生存和抗药性mRNA的翻译,对PI3K/mTOR的抑制能改变与AEG-1结合的mRNA[2]。
5 AEG-1与免疫
AEG-1可经Ha-ras、gp120、TNF-α和HIV-1诱导表达,但反应时间较长。AEG-1的表达还可由toll样受体4(TLR4)的配基-脂多糖(Lipopolysaccharides,LPS)诱导的NF-κB途径在短时间(30 min)内产生[24]。AEG-1启动子中未见κB结合部位,且缺少传统的TATA和CAAT box,但是包含多个Sp1结合部位和高含量的GC。有实验证明Sp1可与NF-κB相互作用。因此,LPS诱导的NF-κB通路活化激活AEG-1表达可能涉及Sp1的参与。相反,AEG-1对NF-κB通路的活化又有促进作用,增强了LPS诱导的促炎性反应细胞因子TNF-α、前列腺素E2表达。在LPS刺激下,表达TLR4的乳腺癌细胞系中AEG-1表达上调,活化了NF-κB通路,增强白介素8(Interleukin,IL-8)、MMP-9的表达和细胞侵袭转移能力[25]。可见,AEG-1不仅作为癌基因,还在炎症、自然免疫及其与癌症的联系中发挥作用。
6 问题与展望
从癌基因AEG-1的发现、克隆,AEG-1蛋白结构的研究,到其在肿瘤中发挥作用的具体机制的探究,这一过程为癌基因、肿瘤标志物的筛选提供了很好的范例。AEG-1与多种恶性肿瘤的关系使其有望成为恶性肿瘤早期诊断和分子靶向治疗的新靶标。在肿瘤治疗中,可将AEG-1抑制剂与化疗结合;还可将AEG-1启动子与抑癌基因(如P53、mda-7/IL-24)相连治疗Ras活化导致的癌症。但作为治疗靶点,由于缺乏有效的肿瘤靶向运输体系,AEG-1 siRNA的临床应用还需很长一段时间;因此寻找能阻断AEG-1与某一配体相互作用的小分子物质是更为合理和有效的方法。突变分析有助于发现在蛋白质相互作用中起重要作用的氨基酸残基,有望成为小分子靶向抑制AEG-1功能的热点[22]。同时,对AEG-1的研究还需进一步深化,不同细胞背景下的分子机制有待通过实验验证得到一致结论。
[1] Brown DM,Ruoslahti E.Metadherin,a cell surface protein in breast tumors that mediates lung metastasis[J].Cancer Cell,2004,5:365-374.
[2] Meng X,Zhu D,Yang S,etal.Cytoplasmic metadherin (MTDH) provides survival advantage under conditions of stress by acting as RNA-binding protein[J].J Biol Chem,2012,287:4485-4491.
[3] Liao WT,Guo L,Zhong Y,etal.Astrocyte elevated gene-1 (AEG-1) is a marker for aggressive salivary gland carcinoma[J].J Transl Med,2011,9:205.doi:10.1186/1479-5876-9-205.
[4] Sun S,Ke Z,Wang F,etal.Overexpression of astrocyte-elevated gene-1 is closely correlated with poor prognosis in human non-small cell lung cancer and mediates its metastasis through up-regulation of matrix metalloproteinase-9 expression[J].Hum Pathol,2012,43:1051-1060.
[5] Yoo BK,Emdad L,Su ZZ,etal.Astrocyte elevated gene-1 regulates hepatoellular carcinoma development and progression[J].J Clin Invest,2009,119:465-477.
[6] Thirkettle HJ,Girling J,Warren AY,etal.LYRIC/AEG-1 is targeted to different subcellular compartments by ubiquitinylation and intrinsic nuclear localization signals[J].Clin Cancer Res,2009,15:3003-3013.
[7] Li X,Kong X,Huo Q,etal.Metadherin enhances the invasiveness of breast cancer cells by inducing epithelial to mesenchymal transition[J].Cancer Science,2011,102:1151-1157.
[8] Meng F,Luo C,Ma L,etal.Clinical significance of astrocyte elevated gene-1 expression in human epithelial ovarian carcinoma[J].Int J Gynecol Pathol,2011,30:145-150.
[9] Song H,Li C,Lu R,etal.Expression of astrocyte elevated gene-1:a novel marker of the pathogenesis,progression,and poor prognosis for endometrial cancer[J].Int J Gynecol Cancer,2010,20:1188-1196.
[10] Zhao Y,Moran MS,Yang Q,etal.Metadherin regulates radioresistance in cervical cancer cells[J].Oncol Rep,2012,27:1520-1526.
[11] Xu JB,Wu H,He YL,etal.Astrocyte-elevated gene-1 overexpression is associated with poor prognosis in gastric cancer[J].Med Oncol,2011,28:455-462.
[12] Song H,Li C,Li R,etal.Prognostic significance of AEG-1 expression in colorectal carcinoma[J].Int J Colorectal Dis,2010,25:1201-1209.
[13] Chen W,Ke Z,Shi H,etal.Overexpression of AEG-1 in renal cell carcinoma and its correlation with tumor nuclear grade and progression[J].Neoplasma,2010,57:522-529.
[14] Xia ZB,Zhang N,Jin HW,etal.Clinical significance of astrocyte elevated gene-1 expression in human oligodendrogliomas[J].Clin Neurol Neurosur,2010,112:413-419.
[15] Hui AB,Bruce JP,Alajez NM,etal.Significance of dysregulated metadherin and microRNA-375 in head and neck cancer[J].Clin Cancer Res,2011,17:7539-7550.
[16] Zhang F,Yang Q,Meng F.Astrocyte elevated gene-1 interacts with β-catenin and increases migration and invasion of colorectal carcinoma[J].Mol Carcinog,doi: 10.1002/mc.21894. [Epub ahead of print].
[17] Yoo BK,Emdad L,Lee SG,etal.Astrocyte elevated gene-1 (AEG-1):A multifunctional regulator of normal and abnormal physiology[J].Pharmacol Ther,2011,130:1-8.
[18] Liu L,Wu J,Ying Z,etal.Astrocyte elevated gene-1 upregulates matrix metalloproteinase-9 and induces human glioma invasion[J].Cancer Res,2010,70:3750-3759.
[19] Bhutia SK,Kegelman TP,Das K,etal.Astrocyte elevated gene-1 induces protective autophagy[J].Proc Natl Acad Sci USA,2010,107:22243-22248.
[20] Yoo BK,Chen D,Su ZZ,etal.Molecular mechanism of chemoresistance by astrocyte elevated gene-1[J].Cancer Res,2010,70:3249-3258.
[21] Thirkettle HJ,Mills IG,Whitaker HC,etal.Nuclear LYRIC/AEG-1 interacts with PLZF and relieves PLZF-mediated repression[J].Oncogene,2009,28:3663-3670.
[22] Yoo BK,Santhekadur PK,Gredler R,etal.Increased RNA-induced silencing comples (RISC) activity contributes to hepatocellular carcinoma[J].Hepatology,2011,53:1538-1548.
[24] Khuda II,Koide N,Noman AS,etal.Astrocyte elevated gene-1 (AEG-1) is induced by lipopolysaccharide as toll-like receptor 4 (TLR4) ligand and regulates TLR4 signalling[J].Immunology,2009,128:700-706.
[25] Zhao Y,Kong X,Li X,etal.Metadherin mediates lipopolysaccharide-induced migration and invasion of breast cancer cells[J].PloS One,2011,6:e29363.doi: 10.1371/journal.pone.0029363.
Progress on elevated gene-1 in astrocyte
ZHANG Ting1, YANG Jun2*
(1.Research Center; 2.Dept. of Pathology, the Second Affiliated Hospital, Medical College, Xi’an Jiaotong University, Xi’an 710004, China)
Recently, it has found that the expression of astrocyte elevated gene-1(AEG-1) is elevated in subsets of various malignant cells. AEG-1 plays a potential role in several crucial aspects of oncogenesis, including cancer cell surviving, tumor progression, angiogenesis, antiapoptosis, invasion, metastasis and chemoresistance. Meanwhile, it has close relationship with inflammation and natural immunity. AEG-1 functions as a mediator of several signal pathways PI3K/Akt, NF-κB,Wnt/β-catenin. Moreover, AEG-1 participates in RNA-induced silencing complex mediating gene silencing. Therefore, AEG-1 may be a potential farget for clinical diagnosis and a nticancer medication.
AEG-1; tumor; signal pathway; gene silence; inflammation
2013-02-06
2013-05-07
国家自然科学基金(30872403)
*通信作者(correspondingauthor): yangjundr@yahoo.com.cn
1001-6325(2014)01-0125-05
R 73
A

