熊果酸减轻LPS诱导的THP-1细胞损伤
孙爱平,孙书明,张国俊,王艳华,宋向凤
(新乡医学院 免疫学研究中心, 河南 新乡 453003)
研究论文
熊果酸减轻LPS诱导的THP-1细胞损伤
孙爱平,孙书明,张国俊,王艳华,宋向凤*
(新乡医学院 免疫学研究中心, 河南 新乡 453003)
目的探讨熊果酸减轻脂多糖诱导的THP-1细胞损伤的作用及其机制。方法以脂多糖诱导的THP-1 炎性细胞为模型,MTT法检测不同浓度的熊果酸(0.1、1、5、10、20、40和80 μmol/L) 对细胞增殖的影响,RT-PCR 法检测TLR4、MCP-1和IL-6 mRNA 的表达,ELISA法检测MCP-1和IL-6表达,Western blot法检测P65、磷酸化P65蛋白表达,荧光素酶报告系统检测核转录因子κB(NF-κB)活性。结果与对照组比较,LPS作用组能显著增高MCP-1、TLR4、IL-6 mRNA 和MCP-1、IL-6、P65、磷酸化P65蛋白的表达并上调NF-κB 活性(Plt;0.05);与LPS单独作用组比较,熊果酸(1和5 μmol/L)干预组能够显著降低MCP-1、TLR4、IL-6 mRNA 和MCP-1、IL-6表达水平并下调NF-κB 活性(Plt;0.05)。结论熊果酸可能是通过下调NF-κB 活化减轻脂多糖诱导的THP-1 细胞的损伤。
熊果酸; THP-1细胞; TLR4;MCP-1; IL-6; NF-κB
熊果酸(ursolic acid,UA,3β-hydroxy-12-urs-12-en-28-oic acid) 又名乌索酸、乌苏酸,属于α-香树脂烷(α-amyrin)型五环三萜类化合物[1-2]。它在自然界分布很广,研究表明UA 具有广泛的生物学效应,其中抗肿瘤方面的报道最多[3-5],而抗炎方面的作用及其相关机制研究却报道较少[6]。
炎性反应,俗称发炎,对机体而言如一把“双刃剑”[7]。它是机体的重要防御机制,同时也可产生大量的促炎性细胞因子,如IL-6、TNF-α、IFN-γ、MCP-1等[8]。单核细胞趋化蛋白-1(MCP-1)和白细胞介素(IL)-6是参与机体炎性反应和一系列病理生理过程的重要介质[9-10]。
本研究在细胞及分子水平探讨了熊果酸对脂多糖(lipopolysaccharide,LPS)诱导的THP-1 单核细胞增殖作用的影响,并从TLR4、MCP-1和IL-6的mRNA水平及NF-κB信号途径的蛋白水平对其相关机制作了初步探讨。
1 材料与方法
1.1 材料
人单核细胞系THP-1 细胞(免疫学研究中心保存);熊果酸(Sigma公司,纯度大于90%);RPMI-1640 液体培养基(roswell park memorial institute-1640,Gibco公司);小牛血清(中国医学科学院血液病研究所);噻唑蓝(MTT)和脂多糖(Sigma公司);RNA提取试剂盒(Omega公司);MCP-1和IL-6 ELISA试剂盒(Abcam公司);一抗(兔抗人NF-κB P65和磷酸化P65)(北京博奥森生物技术有限公司),二抗(HRP标记羊抗兔IgG)(武汉博士德生物工程有限公司);报告基因质粒pNF-κB-luc(美国NIH栾好江博士惠赠);Lipofecter脂质体转染试剂(碧云天生物技术有限公司)。
1.2 方法
1.2.1 细胞培养:THP-1细胞用含体积分数为10%胎牛血清的新鲜RPMI-1640培养基培养,内含各100 U/mL青霉素和链霉素,在37 ℃、体积分数为5% CO2、饱和湿度培养箱中培养,细胞浓度不超过1×109/L,2~3 d传代1次。实验前换无血清培养基饥饿1 h,在实验中空白对照组均给予等体积RPMI-1640培养基。取生长状态良好的、对数生长期细胞进行实验。
1.2.2 细胞增殖实验:将THP-1细胞以5×105个/mL接种于96孔板,200 μL/孔,分别加入不同浓度的UA(0.1、1、5、10、20、40和80 μmol/L)和不同浓度的LPS(1、10、100和1 000 μg/L),另设空白对照组,每组设3个复孔,重复3次。在培养箱中作用24 h后,加入无血清RPMI-1640 培养基和5 μg/L MTT 溶液(9∶1),37 ℃、5% CO2细胞培养箱中孵育3 h;弃去上述培养液,加入二甲基亚砜(dimethyl sulfoxide,DMSO),微量振荡器振荡10 min 溶解蓝紫色结晶,酶标仪测定吸光度(测定波长570 nm,参比波长650 nm)并记录A570。
1.2.3 TLR4、MCP-1和IL-6 mRNA表达的测定:将THP-1细胞以5×105/mL个接种于6孔板,3 mL/孔,加入10 μg/L的LPS,在培养箱中作用20 h后,给药组给予不同浓度的UA(0.1、1、5,和10 μmol/L)诱导4 h。用RNA提取试剂盒提取总RNA,A260/280测定RNA纯度。反转录合成cDNA。于PCR反应体系10 μL中加入模板cDNA 2 μL进行PCR扩增,GAPDH作为内参,实验重复3次。引物由苏州金唯智生物科技有限公司合成,各引物序列见表1。PCR 产物经含1.0 μg/mL 溴化乙锭(ethidium bromide,EB) 染色液的1.5%琼脂糖凝胶电泳,分别以目的基因扩增产物电泳条带总灰度与GAPDH电泳条带总灰度之比表示各自mRNA的相对强度。
1.2.4 ELISA法检测MCP-1和IL-6:按试剂盒操作说明进行。
1.2.5 蛋白质印迹(Western blot)法检测P65蛋白的表达: 将THP-1细胞以5×105/mL个接种于6 孔板,3 mL/孔,加入10 μg/L的LPS,在培养箱中作用20 h后,给药组给予不同浓度的UA(0.1、1、5和10 μmol/L)诱导4 h。裂解细胞提取总蛋白,用G-250法进行定量后,将含有等量蛋白的细胞裂解液用样品缓冲液溶解,行SDS-PAGE电泳,用半干电转方法转移至硝酸纤维素膜。用含质量分数为5%脱脂奶粉的TBST封闭,结合一抗(兔抗人)。TBST漂洗,结合二抗(羊抗兔)。TBST再次漂洗,洗后的膜加入化学发光试剂(ECL),反应2 min,暗室曝光显影后冲洗胶片,后用激光扫描仪扫描,分别以目的蛋白总吸光度与β-actin蛋白总吸光度之比表示各自蛋白的相对强度。

表1 用于RT-PCR的引物序列Table 1 The primers used in RT-PCR
1.2.6 荧光素酶报告系统检测NF-κB表达:将THP-1细胞用无血清培养基洗涤,并调整细胞水平至2.5×106/mL待用。1 μg质粒需要3.0 μL Lipofecter试剂,将其按比例混合入不完全RPMI 1640培养基中,涡旋剧烈振荡30 s,室温放置10 min后,每孔加入200 μL Lipofecter、质粒DNA和无血清培养基混合物,再加入20 μL 2.5×109/L的细胞悬液,37 ℃ CO2培养箱中培养。1 h后每孔补充1 mL完全培养基,继续培养32 h;之后,加入10 μg/L的LPS,在培养箱中作用20 h后,给药组给予不同浓度的UA(0.1、1、5和10 μmol/L)诱导4 h后,收集细胞进行荧光素酶活性检测。
1.3 统计学分析
2 结果
2.1 UA对THP-1细胞增殖的影响
熊果酸20、40和80 μmol/L可抑制THP-1细胞增殖(Plt;0.05)(图1),后续实验只使用0.1、1、5和10 μmol/L浓度(图1)。用同样方法检测LPS对THP-1细胞增殖的影响发现10 μg/L的LPS对THP-1细胞的增殖作用最为明显(Plt;0.05),因此后续LPS诱导的THP-1细胞实验均用此浓度。
2.2 UA对LPS诱导的THP-1细胞中TLR4、MCP-1和IL-6 mRNA表达的影响
THP-1细胞经LPS刺激后,TLR4、MCP-1和IL-6 mRNA表达均有显著增加(Plt;0.05);与LPS组相比,UA(0.1、1和5 μmol/L)干预组TLR4、MCP-1和IL-6 mRNA表达明显降低(Plt;0.05)(图2)。
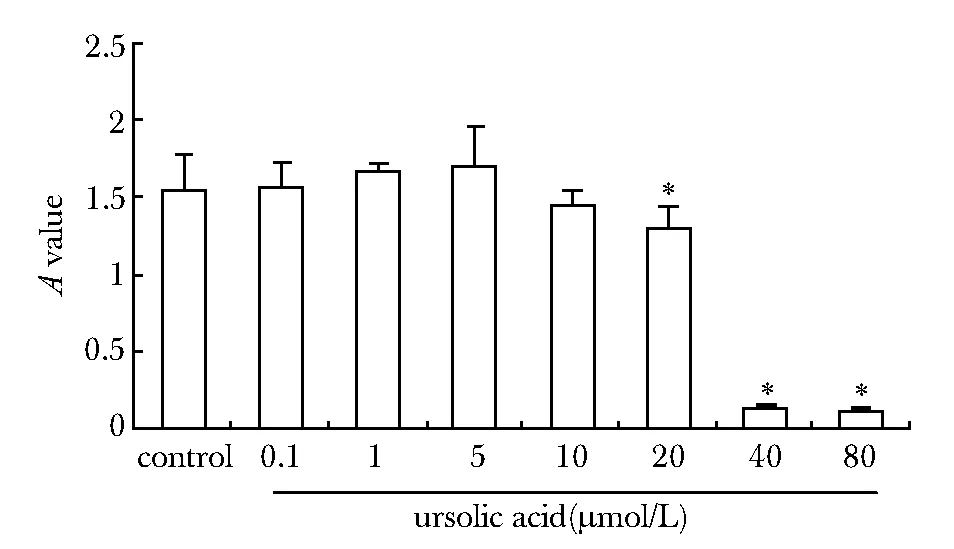
*Plt;0.05 compared with control group图1 不同浓度熊果酸对THP-1细胞增殖作用的影响Fig 1 Effect of ursolic acid on THP-1 proliferation
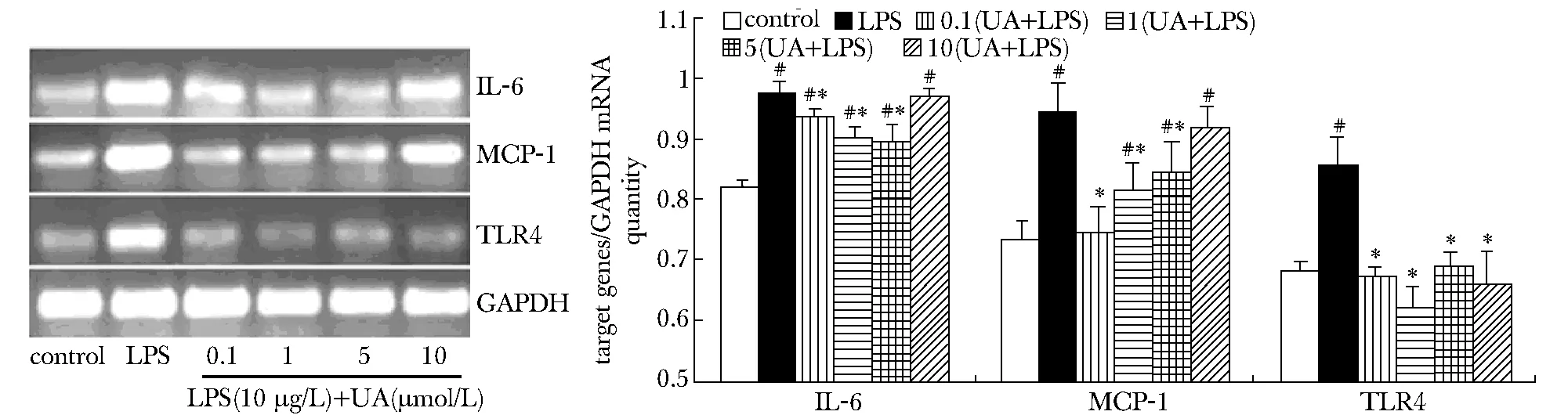
#Plt;0.05 compared with control group; *Plt;0.05 compared with LPS group图2 不同浓度熊果酸对LPS诱导的THP-1细胞 TLR4、MCP-1和IL-6 mRNA的影响Fig 2 Effect of UA on TLR4、MCP-1 and IL-6 expressions of THP-1 cells induced by LPS(±s,n=3)
2.3 UA对LPS诱导的THP-1细胞中MCP-1和IL-6水平的影响
THP-1细胞经LPS刺激后,MCP-1和IL-6显著增加(Plt;0.05);与LPS组相比,UA(0.1、1和5 μmol/L干预组可显著降低MCP-1和IL-6水平(Plt;0.05)(图3)。
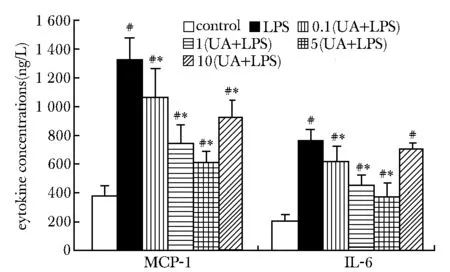
#Plt;0.05 compared with control group; *Plt;0.05 compared with LPS group图3 不同浓度熊果酸对LPS诱导的THP-1细胞MCP-1和IL-6的影响Fig 3 Effect of UA on MCP-1 and IL-6 expressions of THP-1 cells induced by LPS(±s,n=3)
2.4 UA对LPS诱导的THP-1细胞中P65和phospho-P65蛋白表达的影响
THP-1细胞经LPS 刺激后,NF-κB家族中P65和phospho-P65的活性显著增加(Plt;0.05);与LPS组相比,UA(0.1、1和5 μmol/L)干预组可显著降低P65和phospho-P65的活性(Plt;0.05)(图4)。
2.5 UA对LPS诱导的THP-1细胞中荧光素酶报告基因影响
THP-1细胞经LPS刺激后,NF-κB活性检测值增高(Plt;0.05);与LPS组相比,UA(1和5 μmol/L)干预组NF-κB活性检测值明显降低(Plt;0.05)(图5)。
3 讨论
炎性反应对机体的影响具有双面性[11]。在炎性反应发生初期,当巨噬细胞受到相应刺激后便会被激活,这些活化的巨噬细胞可分泌MCP-1和IL-6,而MCP-1和IL-6又可通过特异性地作用于外周血中的单核细胞和细胞信号传导激活核因子-κB(nuclear factor,NF-κB),造成单核细胞的进一步募集和活化,进而更多的炎性介质释放,这样一个MCP-1和IL-6-NF-κB-MCP-1和IL-6恶性循环最终导致炎症的进一步发展[12-13]。因此,MCP-1和IL-6在炎性反应的发生发展中起着举足轻重的作用,降低MCP-1和IL-6的表达水平有助于阻止早期炎性反应。NF-κB是一个经典的核转录因子,在哺乳动物细胞中有5个家庭成员。生理状态下,NF-κB通过对相关基因的适时准确的转录调控,维持各种免疫细胞的正常功能[14]。研究发现,UA 可抑制佛波酯、TNF-α和H2O2对NF-κB 的激活作用,并且无细胞特异性[15],另外,绝大多数炎性反应通过NF-κB 途径介导[16]。本研究表明LPS刺激而活化的THP-1细胞,在经UA作用后,其合成的炎性反应因子MCP-1、IL-6在mRNA和蛋白水平会有所降低,说明UA能减轻LPS诱导的THP-1细胞的损伤,而对P65、磷酸化P65蛋白水平和荧光素酶报告基因的检测,提示熊果酸对LPS刺激THP-1细胞损伤减轻作用可能是通过影响NF-κB通路的活性来实现的。Toll样受体4(Toll-1ike receptor 4, TLR4)是Toll样受体家族(Toll-1ike receptors, TLRs)的成员之一,是哺乳动物将细胞外抗原识别信息向细胞内传递并引发炎性反应的关键跨膜蛋白[17]。TLR4广泛分布于各类与免疫相关细胞,本实验通过对TLR4的检测,发现UA减轻LPS对THP-1细胞的损伤作用可能是通过TLR4,进而影响NF-κB通路活性而实现的。

#Plt;0.05 compared with control group;*Plt;0.05 compared with LPS group图4 不同浓度熊果酸对LPS诱导的THP-1细胞P65和phospho-P65的影响Fig 4 Effect of UA on p65 and phospho-p65 expressions of THP-1 cells induced
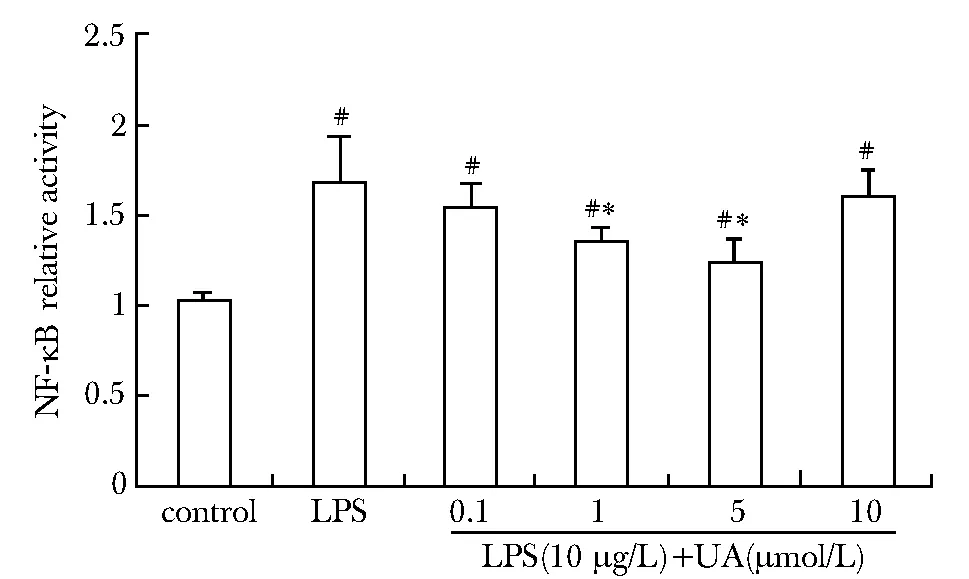
#Plt;0.05 compared with control group;*Plt;0.05 compared with LPS group图5 不同浓度熊果酸对LPS 诱导的THP-1细胞NF-κB影响Fig 5 Effect of UA on the NF-κB activation of THP-1 cells induced by LPS(±s,n=3)
总之,THP-1细胞经LPS作用后,LPS能通过细胞膜上的TLR4,活化NF-κB,进而促进炎性反应因子MCP-1和IL-6的合成和释放;而在UA干预后,相应指标会相对降低,说明UA可能是通过抑制TLR4-NF-κB通路而减轻LPS诱导的THP-1细胞损伤,这为临床上预防和治疗炎症提供了一定的理论依据。
[1] 孟艳秋, 陈瑜, 王趱, 等. 熊果酸的研究进展[J]. 中国新药杂志, 2007, 16: 25-28.
[2] 郑开波, 孙成斌, 毛海立, 等. 熊果酸化学结构修饰与构效关系的研究进展[J].中国药科大学学报, 2009, 40:580-584.
[3] Shin SW, Park JW. Ursolic acid sensitizes prostate cancer cells to TRAIL-mediated apoptosis[J]. Biochim Biophys Acta, 2013, 1833:723-730.
[4] Li J, Liang X, Yang X. Ursolic acid inhibits growth and induces apoptosis in gemcitabine-resistant human pancreatic cancer via the JNK and PI3K/Akt/ NF-κB pathways[J]. Oncol Rep, 2012, 28:501-510.
[5] Wang J, Li Y, Wang X,etal. Ursolic acid inhibits proliferation and induces apoptosis in human glioblastoma cell lines U251 by suppressing TGF-β1/miR-21/PDCD4 pathway [J]. Basic Clin Pharmacol Toxicol, 2012, 1:106-112.
[6] Kim SH, Hong JH, Lee YC. Ursolic acid, a potential PPARγ agonist, suppresses ovalbumin-induced airway inflammation and Penh by down-regulating IL-5, IL-13, and IL-17 in a mouse model of allergic asthma[J]. Eur J Pharmacol, 2013, 701:131-143.
[8] Esche C, Stellato C, Beck LA. Chemokines: key players in innate and adaptive immunity[J]. J Invest Dermatol, 2005, 125:615-628.
[9] Yoshimura T, Leonard EJ. Human monocyte chemoattractant protein-1: structure and function[J].Cytokines, 1992, 4:131-152.
[10] Cavaillon JM. Interleukins and inflammation[J].Pathol Biol, 1990,38:36-42.
[11] Guerra C, Collado M, Navas C, et a1.Pancreatitis-induced inflammation contributes to pancreatic cancer by inhibiting oncogene-induced senescence[J]. Cancer Cell,2011, 19: 728-739.
[12] Gupta M, Chatur vedi R, Jain A. Enhancement of gingival inflammation induced by synergism of IL-1β and IL-6[J]. Biomed Res, 2013, 34:31-40.
[13] Youqi H an, Marschall S, Runge,etal. Role of monocyte chemoattractant protein-1 (MCP-1) as an immune-diagnostic biomarker in the pathogenesis of chronic periodontal disease[J]. Cytokine, 2013, 61:892-897.
[14] Huang WC, Hung MC. Beyond NF-κB activation: nuclear functions of IκB kinase α[J]. J Biomed Sci, 2013, 20:1-13.
[15] Shishodia S, Majumdar S, Banerjee S,etal. Ursolic acid inhibits nuclear factor-kappaB activation induced by carcinogenic agents through suppression of IkappaB alpha kinase and p65 phosphorylation:correlation with down-regulation of cyclooxygenase 2,matrix metalloproteinase 9,and cyclin D1[J]. Cancer Res,2003, 63: 4375-4383.
[16] Fan J, Watanabe T. Inflammatory reactions in the pathogenesis of atherosclerosis[J].J Atheroscler Thromb, 2003, 10: 63-71.
[17] Gordon S. Pattern recognition receptors: doubling up for the innate immune response[J]. Cell, 2002, 111:927-930.
Ursolic acid alleviated the LPS-induced damage in THP-1 cells
SUN Ai-ping, SUN Shu-ming, ZHANG Guo-jun, WANG Yan-hua, SONG Xiang-feng*
(Research Center for Immunology, Xinxiang Medical University, Xinxiang 453003,China)
ObjectiveTo investigate the alleviating effect and mechanism of ursolic acid against LPS-induced damage in THP-1 cells.MethodsTHP-1 cells were exposed to 10 μg/L LPS for 20 h, ursolic acid of different concentrations were added. Cell proliferation was tested by MTT, the expressions of TLR4,MCP-1 and IL-6 mRNA were detected by RT-PCR, enzyme-linked immunosorbent assay(ELISA) was applied to detect the production of monocyte chemoattractant protein1 (MCP-1) and interleukin-6 (IL-6), P65 and Phosphorylation-P65 were detected on protein level using Western blot, the nuclear transcription factor kappa B (NF-kappa B) activity was detected by luciferase report system.ResultsLPS group significantly increased MCP-1, TLR4, IL-6 mRNA and MCP-1, IL-6, P65, Phosphorylation-P65 proteins expression and enhanced NF-κB activity. Ursolic acid (1, 5 μmol/L) intervention groups significantly reduced MCP-1, TLR4, IL-6 mRNA expression and MCP-1, IL-6 proteins expression and inhibited NF-κB activity.ConclusionsUrsolic acid may alleviate LPS-induced damage of THP-1 cells by reducing the NF-κB activity.
ursolic acid;THP-1; TLR4;MCP-1; IL-6; NF-κB
2013-03-25
2013-06-27
新乡医学院博士启动基金(BSQDJJ201208)
*通信作者(correspondingauthor): xfsong@xxmu.edu.cn
1001-6325(2014)01-0088-05
R392.5
A

