JAK2/STAT3通路参与大鼠坐骨神经结扎神经病理性疼痛模型
薛照静,申 乐,王之遥,黄宇光
(中国医学科学院 北京协和医学院 北京协和医院 麻醉科,北京 100730)
研究论文
JAK2/STAT3通路参与大鼠坐骨神经结扎神经病理性疼痛模型
薛照静,申 乐,王之遥,黄宇光*
(中国医学科学院 北京协和医学院 北京协和医院 麻醉科,北京 100730)
目的结扎大鼠双侧坐骨神经复制bCCI模型,观察JAK2/STAT3通路的激活情况。方法60只体质量180~200 g SD雌性大鼠随机分为3组, bCCI组,sham组及Naïve组。分别于bCCI手术术前1 d,术后3、7、14和21 d取腰段脊髓背角,并进行RT-PCR及Western blot观察通路中主要因子的mRNA 水平及蛋白水平的变化。结果bCCI组大鼠对机械、热刺激及冷丙酮刺激的痛觉阈值明显降低。与sham组及Naïve相比,bCCI组STAT3、SOCS3、JAK2及IL-6 mRNA水平显著升高,且3组在不同时间点具有差异(Plt;0.05)。与sham组及Naïve相比,bCCI组P-STAT3、JAK2和SOCS3蛋白水平升高。结论大鼠bCCI神经病理性疼痛模型JAK2/STAT3通路激活。
JAK2;STAT3;神经病理性疼痛
神经病理性疼痛是由神经系统原发性损害和功能障碍所激发或引起的疼痛,由于机制复杂,在临床医疗中是一个巨大的挑战。神经系统与免疫系统之间的相互作用,为治疗神经病理性疼痛提供了新的靶点。JAK(janus kinase,JAK)/STAT(signal transducers and activators of transcription,STAT)信号通路是近年来发现的一条由细胞因子刺激的信号传导通路,在中枢神经系统中,JAK2/STAT3通路在抑制炎性反应、肿瘤[1]及神经退行性变[2]、神经病理性疼痛中发挥重要作用。目前的研究认为,STAT分子家族,尤其是STAT3在免疫调节及应激中占有重要作用。因此,通过对JAK/STAT通路在神经病理性疼痛中的作用的研究,希望能了解神经病理性疼痛的分子机制进而为神经病理性疼痛提供新的治疗方案。
1 材料与方法
1.1 动物实验及分组
SPF级SD雌性大鼠,180~200 g,室温22 ℃左右,相对湿度50%左右,明暗各12 h,自由摄水和食物, 每日更换笼具和垫料。大鼠由北京动物研究所 [许可证SCXK(京):20022003] 提供,饲养于北京协和医院实验动物中心。适应环境3~5 d后手术。
按照随机数字表法将大鼠随机分为bCCI组,sham组及Naïve组(n=60)。bCCI组进行双侧坐骨神经结扎。腹腔注射戊巴比妥40~50 mg/kg,在距坐骨神经起始处上方2 mm用4.0含铬羊肠线结扎坐骨神经4道,每道间隔约1 mm。间断缝合;sham组进行坐骨神经暴露但不进行手术结扎,其余同模型组;Naïve组仅保证相同的饲养时期;手术由同一人操作。对侧同样。
1.2 动物行为学方法
分别于bCCI模型手术前1 d,术后3、7、14和21 d进行动物行为学测量。测定间隔为3 min,每只左右后足重复测量3次,将3次读数取平均值为痛阈值。
1.2.1 机械刺激诱发痛测定:采用电子von Frey测痛仪测定[3]。安静的适应环境10~30 min。用金属探头垂直刺激大鼠后脚底。记录仪自动记录使大鼠产生缩足反射的最小刺激强度。3次平均值作为机械缩足反射阈值(mechanical withdrawal threshold,MWT)。
1.2.2 热刺激诱发痛测定:采用BME-410A热照射疼痛刺激仪测定。安静的适应环境10~30 min。用热测痛仪照射大鼠左、右后脚底,待大鼠产生快速缩足、扬足或添足后停止照射,记录下照射持续时间即为缩足反射的潜伏期(paw withdrawal thermal latency,PWTL)。将3次读数取平均值作为热刺激伤害感受阈,最高阈值设为20 s。
1.2.3 冷刺激诱发痛测定[4]:大鼠适应环境15 min分钟后,将0.1 mL丙酮滴加在大鼠的后足上。记录1 min内大鼠出现抬足、缩足、快速甩足以及甩足后舔足等阳性表现的次数,间隔3 min重复。每只后足重复3次。次数作为冷痛阈值(total number of withdrawal)。
1.2.4 处死动物及取材:深度麻醉后断头处死大鼠。俯卧位,迅速暴露脊髓,小心取出腰膨大,切除脊髓背角,立即放入液氮冷却5~10 min后放入-80 ℃冰箱保存。
1.3 RT-PCR(real time -PCR)
Trizol法进行提取RNA。紫外分光光度仪测定RNA浓度与质量鉴定。每个RNA样本的OA260/OA280值要求在1.8~2.1之间则可以认为RNA的纯度较好,否则弃之不用。RT-PCR反应采用TAKARA反转录及RT-PCR试剂盒。条件合格的RNA样本按照PrimeScriptTMRT Master Mix(Takara DRR036A)说明加入试剂行反转录反应合成CDNA。RT-PCR选用GAPDH基因做为内参,引物设计运用Primer Premier5.0和Oligo 6软件进行引物设计, 各基因引物设计(表1)。cDNA模板按照SYBRPremix ExTaqTMII(Takara RR820A)说明进行RT-PCR反应,每个样品同时做3个复管。AB Applied Biosystems Step-one plus进行RT-PCR反应。PCR结束后根据熔解曲线确定产物的特异性并采用2-ΔΔCT法计算基因表达量。

表1 RT-PCR目的基因引物序列
1.4 Western blot
组织块破碎后(冰上操作),加RIPA(单去污剂)裂解液裂(含蛋白酶抑制剂及磷酸酶抑制剂)匀浆。使用BCA法,通过微孔酶标仪制作标准曲线测定蛋白浓度。按照分子质量大小选择配8%或12%分离胶,取40 μg样品上样,用彩染蛋白分子量指示标准SDS-PAGE胶(10 cm×10 cm)。80 V电压电泳直到跑出浓缩胶,120 V电压直至蛋白指示剂移动到胶的底部。300 mA恒流转膜75 min,5%脱脂牛奶室温封闭1 h。抗体(CST及Santa Cruze公司)。抗pSTAT3抗体(1∶500),抗STAT3抗体(Tyr705,1∶500),抗 SOCS3 抗体(1∶100),抗JAK2抗体(1∶500)4 ℃过夜。TBST清洗3遍,二抗孵育,轻度震荡,室温1 h。ImageQuant LAS 4000mini进行仪器曝光。
1.5 统计学分析

2 结果
2.1 动物行为学变化
各组术前及术后各时间点,左右侧后足痛阈无差异,选择左右平均值作为每个时间的阈值水平。Naïve组与sham组相比,MWT,PMWT及对丙酮冷刺激在术前与术后各时间点无差异(图1)。
2.1.1 大鼠机械刺激缩足反射阈值(MWT)的变化:术后第7天开始至21天,bCCI组双后足机械性痛阈较术前及正常对照组、假手术组显著下降 (Plt;0.05),并在术后第14天达到最低点。
2.1.2 大鼠热反射阈值(PMWT)的变化:术后第7天开始至21天,bCCI组左后足热刺激伤害感受阈阈值较术前及正常对照组、假手术组显著下降(Plt;0.05),并在术后第14天达到最低点。
2.1.3 大鼠对冷丙酮刺激缩足反应的变化:术后第7天起bCCI大鼠的阳性反应次数即显著多于术前(Plt;0.05)。
2.2 RT-PCR结果(图2)
2.2.1STAT3 mRNA:与sham组相比,在bCCI组STAT3 mRNA有明显升高(Plt;0.05),于第14天达到高峰;与Naïve组相比,升高4.98倍(Plt;0.05)。
2.2.2SOCS3 mRNA:与sham组相比,bCCI组SOCS3 mRNA水平明显升高(Plt;0.05),与Naïve组相比,升高10.8倍(Plt;0.05)。
2.2.3JAK2 mRNA:与sham组相比,bCCI组JAK2 mRNA于第14天显著升高(Plt;0.05);与Naïve组相比,升高1.92倍(Plt;0.05)。

*Plt;0.05 compared with sham图1 bCCI组、sham组及Naïve组大鼠后足对不同刺激的行为学变化趋势
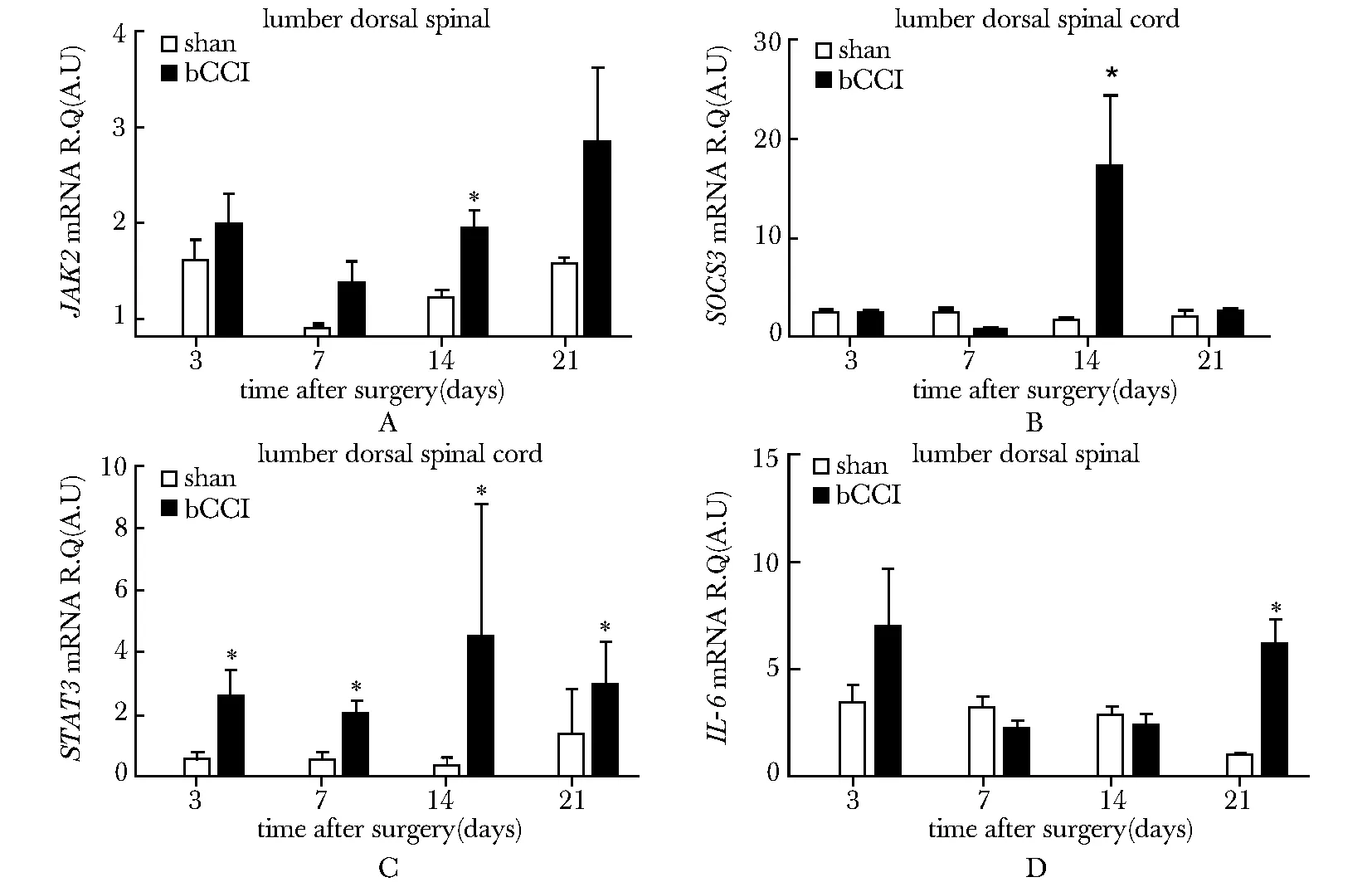
*Plt;0.05 compared with sham图2 目的基因SOCS3、STAT3、IL-6和JAK2 mRNA变化
2.2.4IL-6 mRNA:3 dIL-6 mRNA水平升高,之后下降,与sham组相比,至术后21 dIL-6 mRNA再次升高(Plt;0.05);与Naïve组相比,升高6.15倍(Plt;0.05)。
2.3 Western blot 结果(图3)
2.3.1 P-STAT3:与sham组及Naïve相比,bCCI组P-STAT3蛋白水平无显著升高。
2.3.2 STAT3:与sham组及Naïve相比,bCCI组STAT3蛋白水平无显著变化。
2.3.3 JAK2:与sham组及Naïve相比,bCCI组JAK2蛋白水平无明显升高。
2.3.4 SOCS:与sham组及Naïve相比,bCCI组SOCS3蛋白水平无明显升高。
3 讨论
本研究发现JAK2/STAT3 通路在大鼠bCCI神经病理性疼痛模型中是激活的,与研究假设相符。
单侧坐骨神经结扎模型(uCCI),大鼠术侧重量与非手术侧重量随时间变化逐渐失衡,对刺激的敏感度出现差异,会造成结果的失真。bCCI则避免了这一误差。各组各点左后足与右后足变化水平及趋势基本一致。术后第7天开始至21天,bCCI组双后足痛阈较术前及sham组、Naïve组显著下降,并在术后第14天达到最低点。研究采用雌性、小质量鼠是由于它们对疼痛更为敏感。
本研究发现在mRNA 水平及蛋白水平,JAK2及STAT3均出现升高,其中,JAK2于14 d有显著升高,并且疼痛行为学相一致,表明大鼠bCCI中JAK2/STAT3通路激活,可能与神经病理性疼痛的发生与维持相关。脊髓损伤模型后同样发现STAT3的激活对轴突的再生起着促进作用[5]。结扎脊神经(SNL)后脊髓背角小胶质细胞中的STAT3磷酸化[6],脊髓束半横断损伤模型同样发现JAK2及STAT3的激活[7],说明STAT3的激活在疼痛模型中发挥重要作用。但是其时间趋势与本研究不同。这可能与单侧模型,取材精确度可能受对侧脊髓的干扰导致结果偏差相关。也可能与模型导致机体对刺激的反应过程不同相关。
SOCS基因表达通常为阴性,受到刺激后快速合成, SOCS蛋白结合磷酸化JAK,抑制下游通路的激活,参与JAK/STAT通路的负反馈调节。本研究发现,bCCI组SOCS3 mRNA明显升高。SOCS3蛋白表达先上升后下降,这可能由于手术急性损伤导致,之后通路出现负反馈,使蛋白的表达出现下降。SNL模型同样发现L5~L6脊髓背根神经节会激活SOCS3 mRNA的表达[6]。
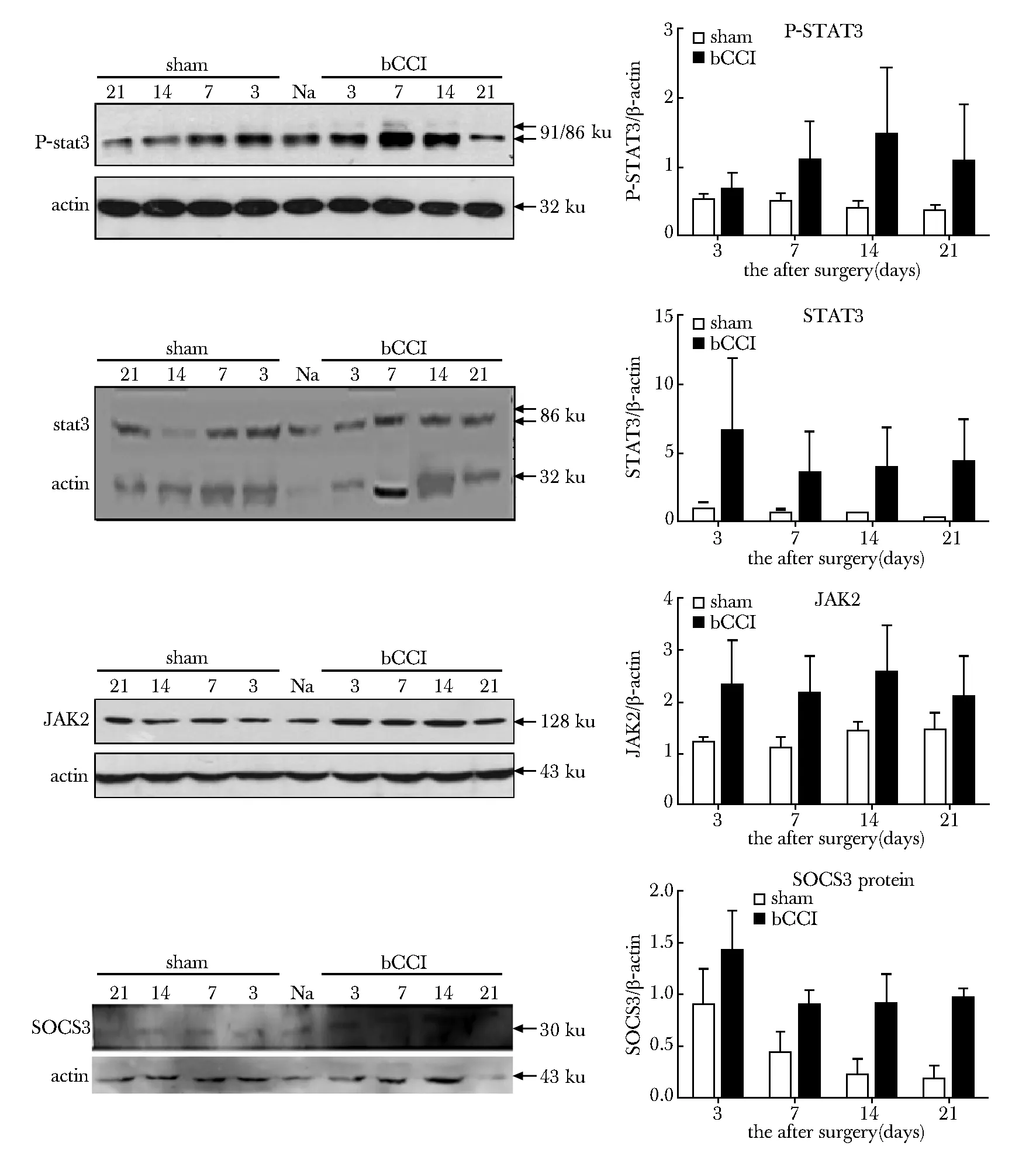
图3 SOCS3、STAT3、P-STAT3和JAK2 mRNA的Western blot结果
本研究发现IL-6 mRNA先升高,后下降,于21 dIL-6 mRNA显著升高。这可能与bCCI大鼠行为学表现在14 d疼痛达到高峰,机体会产生二次应激,从而导致IL-6在21 d再次升高有关。大鼠CCI模型L4~L5脊髓背角神经元IL-6激活[8], SNL后L5~L6脊髓背根神经节IL-6 mRNA表达同样明显升高[6]。
近年来,银杏肉碱B[9]和雷公藤[10]发挥神经保护作用均由JAK2/STAT3通路介导的,提示JAK2/STAT3通路抑制剂可能在治疗神经病理性疼痛中有一定的潜力。因此,下一步将尝试探求JAK2/STAT3抑制剂对神经病理性疼痛的影响。对JAK/STAT信号通路的进一步认识,如STAT1[11],也可为神经病理性疼痛的有效治疗提供新靶点。
[1] 洪璇,张艳桥. JAK-STAT信号传导通路在肿瘤中的研究进展[J]. 基础医学与临床, 2011, 31: 463-466.
[2] Slattery ML, Lundgreen A, Kadlubar SA,etal. JAK/STAT/SOCS-signaling pathway and colon and rectal cancer[J]. Mol Carcinog, 2013, 52: 155-166.
[3] Vivancos GG, Verri WJ, Cunha TM,etal. An electronic pressure-meter nociception paw test for rats[J]. Braz J Med Biol Res, 2004, 37: 391-399.
[4] Datta S, Chatterjee K, Kline RT,etal. Behavioral and anatomical characterization of the bilateral sciatic nerve chronic constriction (bCCI) injury: correlation of anatomic changes and responses to cold stimuli[J]. Mol Pain, 2010, 6: 7.
[5] Bareyre FM, Garzorz N, Lang C,etal.Invivoimaging reveals a phase-specific role of STAT3 during central and peripheral nervous system axon regeneration[J]. Proc Natl Acad Sci U S A, 2011, 108: 6282-6287.
[6] Dominguez E, Mauborgne A, Mallet J,etal. SOCS3-mediated blockade of JAK/STAT3 signaling pathway reveals its major contribution to spinal cord neuroinflammation and mechanical allodynia after peripheral nerve injury[J]. J Neurosci, 2010, 30: 5754-5766.
[7] Schwaiger FW, Hager G, Schmitt AB,etal. Peripheral but not central axotomy induces changes in Janus kinases (JAK) and signal transducers and activators of transcription (STAT)[J]. Eur J Neurosci, 2000, 12: 1165-1176.
[8] Dubovy P, Klusakova I, Svizenska I,etal. Satellite glial cells express IL-6 and corresponding signal-transducing receptors in the dorsal root ganglia of rat neuropathic pain model[J]. Neuron Glia Biol, 2010, 6: 73-83.
[9] Song Y, Zeng Z, Jin C,etal. Protective effect of ginkgolide B against acute spinal cord injury in rats and its correlation with the Jak/STAT signaling pathway[J]. Neurochem Res, 2013, 38: 610-619.
[10] Tang J, Li ZH, Ge SN,etal. The inhibition of spinal astrocytic JAK2-STAT3 pathway activation correlates with the analgesic effects of triptolide in the rat neuropathic pain model[J]. Evid Based Complement Alternat Med, 2012, 185167.
[11] Osuka K, Watanabe Y, Usuda N,etal. Activation of STAT1 in neurons following spinal cord injury in mice[J]. Neurochem Res, 2011, 36: 2236-2243.
JAK2/STAT3 pathway is involvedin bilateral chronic constriction injury rat neuropathic pain model
XUE Zhao-jing, SHEN Le,WANG Zhi-yao, HUANG Yu-guang*
(Dept. of Anesthesiology, PUMC Hospital, CAMS amp; PUMC,Beijing 100730,China)
ObjectiveTo evaluate the contribution of the JAK2/STAT3 pathway to neuropathic pain by animal model.MethodsA rat model of bCCI was established and 60 rats’ behavior tests were performed on the day before surgery and on day 3,7,4 and 21 after surgery, L4~L6 dorsal spinal cord was harvested at the each time point. RT-PCR and Western blot were performed to explore the activation of JAK2/STAT3 pathway.ResultsPain-related behavioral tests socres in the bCCI rats were significant decreased as compared to the sham-operated and naïve group at each time point postoperatively (Plt;0.05).SOCS3 mRNA andSTAT3 mRNA significantly increased on day 14, accompanied byJAK2 mRNA of with a similar time course.IL-6 mRNA level increased on day 3 and showed statistically significant increases on day 21. Western blot analysis showed that JAK2, P-STAT3, SOCS3 increased at different timepoints.ConclusionOur results suggest that the JAK2/STAT3 pathway in the spinal dorsal horn was significantly upregulated in a rat bCCI model of neuropathic pain which will open new avenues for therapeutic intervention.
JAK2;STAT3;neurpathic pain
2013-10-08
2013-11-14
国家自然科学基金 (31070930);国家自然科学基金青年课题(81200869)
*通信作者(correspondingauthor): garybeijing@163.com
1001-6325(2014)01-0062-06
R 164
A

