共培养人脐带间充质干细胞(hUC-MSCs)和兔关节软骨细胞诱导hUC-MSCs分化成软骨细胞
罗二梅, 张家文,胡笑轲,唐明乔,宇 丽*
(暨南大学 1.医学院 生物化学系; 2.理工学院 土木工程系, 广东 广州 510632)
研究论文
共培养人脐带间充质干细胞(hUC-MSCs)和兔关节软骨细胞诱导hUC-MSCs分化成软骨细胞
罗二梅1, 张家文1,胡笑轲1,唐明乔2*,宇 丽1*
(暨南大学 1.医学院 生物化学系; 2.理工学院 土木工程系, 广东 广州 510632)
目的探讨兔膝关节软骨细胞和人脐带间充质干细胞(hUC-MSCs)的共培养对hUC-MSCs成软骨诱导分化的影响及共培养的最佳比例。方法分离培养hUC-MSCs和兔膝关节软骨细胞并鉴定其特异性。在Transwell体系中,按1∶4,1∶3,1∶2,1∶1,2∶1,3∶1及4∶1 的比例(hUC-MSCs:兔膝关节软骨细胞)共培养。倒置相差显微镜观察细胞的形态与增殖;甲苯胺蓝染色及免疫荧光染色分别检测葡萄糖胺聚糖(GAG)和Ⅱ型胶原(COL2A1)(蛋白水平定性);并对各组细胞爬片进行GAG、COL2A1定量检测;同时用实时定量荧光PCR(pPCR)检测GAG、COL2A1 mRNA表达,观察共培养前后细胞的基质分泌情况。结果共培养 21 d 后,阳性对照组和实验组细胞甲苯胺蓝染色及免疫荧光反应均呈阳性;GAG、COL2A1含量及mRNA表达量1∶4实验组均要高于其他实验组和阳性对照组。结论hUC-MSCs和兔关节软骨细胞的共培养可明显促进hUC-MSCs向软骨样细胞诱导分化,且最佳共培养比例为1∶4。
Transwell小室;人脐带间充质干细胞;兔膝关节软骨细胞;共培养;成软骨诱导
近年来,细胞生物学和生物材料技术的高速发展使组织工程在软骨缺损修复中的治疗应用成为可能[1]。目前,软骨细胞和间充质干细胞都被认为可用于构造新生软骨组织。但软骨细胞表型不易维持,容易去分化,因此,其临床应用性受到限制。有研究表明,与软骨细胞相比,人脐带间充质干细胞(human umbilical cord mesenchymal stem cell, hUC-MSCs)极易分离得到,且患者没有创伤,因此是另一种重要的种子细胞来源[2-3]。传统的诱导方法需要生长因子和(或者)基因运输系统来促进细胞生长,费用高,难以有效应用于临床,因此,共培养成为另一种新型的诱导方法[4]。受国外学者将Transwell小室用于促进内皮平滑肌细胞增殖及用于诱导分化成脂肪细胞等的启发[5-6],本实验采用Transwell小室进行hUC-MSCs和兔膝关节软骨细胞的相隔共培养,探讨hUC-MSCs与兔膝关节软骨细胞培养的最佳比例,为软骨组织工程研究寻找一种新的种子细胞获取方法。
1 材料与方法
1.1 材料
实验用新生儿脐带(n=4),取自暨南大学华侨医学院,产妇体健,足月剖宫产,产妇及其家属均签署知情同意书,实验方案经医院医学伦理会批准。新西兰大白兔均由广东省医学实验动物中心提供,3~4周龄,雄性,清洁型。实验过程中对动物的处置符合动物伦理学标准[7]。主要试剂:胶原蛋白酶Ⅱ、胰蛋白酶、胰岛素、转铁蛋白、甲苯胺蓝和阿利新蓝(Sigma公司),维生素C(Amrersco公司)、T25培养瓶和Transwell小室(Corning公司),成骨诱导试剂盒和成脂肪诱导试剂盒(CYAGEN公司),DMEM/F12培养液、DMEM高糖培养液和胎牛血清(Gibco公司),TGF-β1(PeproTech公司),地塞米松,青霉素和链霉素(Hyclone公司),总RNA提取试剂盒、反转录酶试剂盒和real-time PCR试剂盒(TIANGEN公司),引物(Invitrogen公司)。
1.2 方法
1.2.1 hUC-MSCs的原代及传代培养:无菌条件下,取脐带3~5 cm,胶原蛋白酶Ⅱ消化,过滤,离心,收集细胞培养。待细胞长至80%~90%汇合时,消化离心后加入新的培养基置37 ℃、5% CO2饱和湿度培养箱继续培养观察细胞生长情况。
1.2.2 hUC-MSCs的表面标志物及hUC-MSCs诱导分化潜能检测:已发表文章[8]。
1.2.3 兔膝关节软骨细胞的原代及传代培养:无菌条件下,取新西兰大白兔(n=4)双侧膝关节软骨,胰蛋白酶和胶原酶Ⅱ消化后过滤,离心,弃上清,收集软骨细胞,接种于新的培养瓶。待细胞达到80%~90%汇合时,消化、传代成第1代细胞,置37 ℃、5% CO2饱和湿度培养箱继续培养。
1.2.4 hUC-MSCs和兔膝关节软骨细胞共培养:取对数增殖期的第3代hUC-MSCs和第2代兔膝关节软骨细胞,接种于放有多聚赖氨酸处理的无菌盖玻片的Transwell共培养体系中,上室为兔膝关节软骨细胞,下室为hUC-MSCs,按表1所示比例共培养。以单独培养hUC-MSCs为阴性对照,以hUC-MSCs的基本软骨诱导为阳性对照。待细胞长至80%~90%汇合时,阳性对照组加入成软骨基本诱导培养基进行培养;实验组用DMEM高糖溶液继续培养;阴性对照组仍用DMEM/F12培养液进行培养。
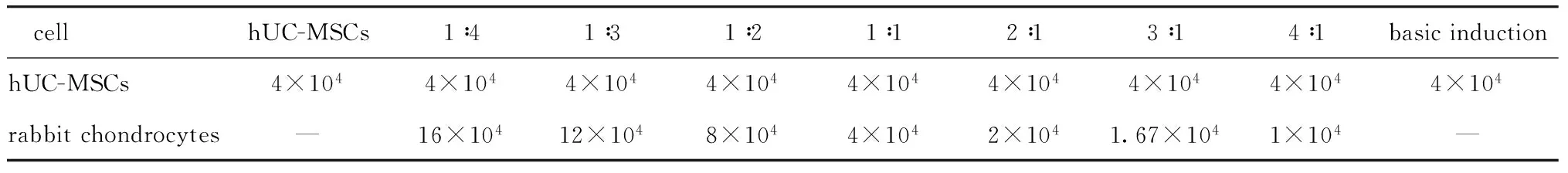
表1 hUC-MSCs和兔关节软骨细胞的共培养比例Table 1 Mixture ratio of hUC-MSCs and Rabbit articular chondrocytes
1.2.5 GAG和COL2A1的定性检测:共培养21 d后,将细胞爬片冲洗1次,多聚甲醛固定,甲苯胺蓝染色;PBS 冲洗至背景干净,晾干,中性树脂封片,观察并拍照。共培养21d后,将细胞爬片洗2次,多聚甲醛固定,PBS洗3次,Triton X-100透膜处理,PBS洗3次,牛血清白蛋白(BSA)室温湿盒封闭30 min。PBS洗2次,一抗4 ℃孵育过夜(溶度为1∶100)。PBS洗3次,二抗室温避光孵育60 min(溶度为1∶64)。PBS洗3次,去离子水洗3次,荧光抗淬灭剂封片,荧光显微镜观察并拍照。
1.2.6 GAG和COL2A1的定量检测:收集共培养及基本软骨诱导7、14和21 d的细胞培养液及细胞进行GAG和COL2A1的定量检测。GAG定量采用阿利新蓝法[9]。各组标本用木瓜蛋白酶消化,消化产物加入阿利新蓝溶液后测定其吸光度值。羟脯氨酸测定试剂盒检测COL2A1定量,按说明书进行,最后在酶标仪560nm波长处测定吸光度值。
1.2.7 定量PCR检测GAG和COL2A1 mRNA表达:取第3代hUC-MSCs、共培养前后及诱导分化后的hUC-MSCs用real-time PCR试剂盒进行实时定量PCR 检测。先提取总RNA,取1 μg总RNA用反转录酶试剂盒反转录为cDNA作为qPCR的模板。用GADPH作为内参。所有样本的结果以GADPH的表达做相对定量分析。数据分析采用△△Ct方法[10],相对表达量=2-ΔΔCt=2-(△Ct实验组-△Ct对照组)=2-[(Ct实验组-Ct内参) - (Ct对照组-Ct内参)],数据取4次重复实验的平均值。所使用引物序列见表2。
1.3 统计学分析
2 结果
2.1 hUC-MSCs表面标志物及诱导分化潜能的检测
hUC-MSCs表面标志物的检测及多向诱导分化潜能结果表明,我们所分离的干细胞为脐带间充质干细胞,见已发表的文章[8]。
2.2 GAG和COL2A1的定性检测
阳性对照组和实验组的下室细胞(原hUC-MSCs)甲苯胺蓝染色均强阳性,胞质及细胞外基质被染成紫蓝色,而阴性对照组的下室细胞没有着色 (图1)。阴性对照组hUC-MSCs免疫荧光染色呈阴性表达,而阳性对照组和实验组的下室细胞染色均强阳性,胞质及细胞外基质均呈现绿色荧光(图1)。
2.3 GAG和COL2A1的定量检测
诱导7、14和21 d后,阴性对照组(hUC-MSCs组)GAGA600 nm值在每个时间点都远低于其他组(Plt;0.05)。实验组1∶4,1∶3和1∶2 GAGA600 nm值明显高于阳性对照组(hUC-MSCs基本诱导),其中,又以1∶4组最显著(Plt;0.05) (图3A)。GAGA600 nm值随着时间的延长而增加。诱导7、14和21 d后,阴性对照组(hUC-MSCs组)羟脯氨酸含量均低于其他组。实验组1∶4,1∶3,和1∶2羟脯氨酸含量均高于阳性对照组(hUC-MSCs基本诱导),其中,1∶4组第21天时羟脯氨酸含量最显著(Plt;0.05)(图3B)。羟脯氨酸含量随时间的延长而增加。
2.4 实时定量PCR检测GAG和COL2A1的mRNA表达
与阴性对照组相比,实验组1∶4,1∶3和1∶2其GAGmRNA表达量均高于阳性对照组(Plt;0.05)。其中,1∶4 组在第21天时相对表达量最高 (Plt;0.05)(图4A)。实验组1∶4和1∶3COL2A1 mRNA表达量均高于阳性对照组(Plt;0.05)。同样,1∶4组在第21天时相对表达量最高(Plt;0.05)(图4B)。GAG和COL2A1 mRNA的相对表达量均随时间的延长而增加。
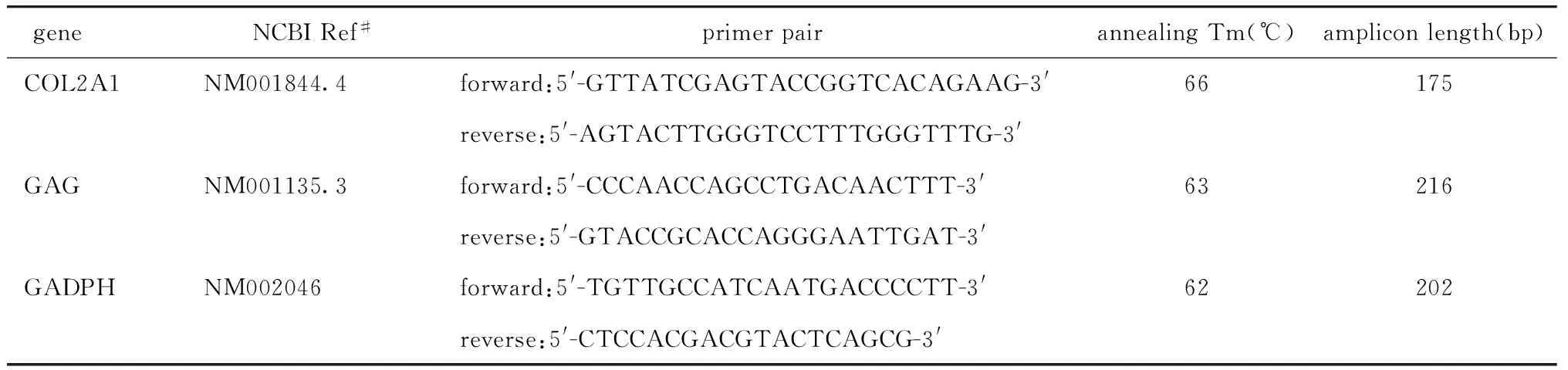
表2 GAG和COL2A的实时定量PCR引物序列Table 2 Real-time quantitative PCR primer sequence of human GAG and COL2A1
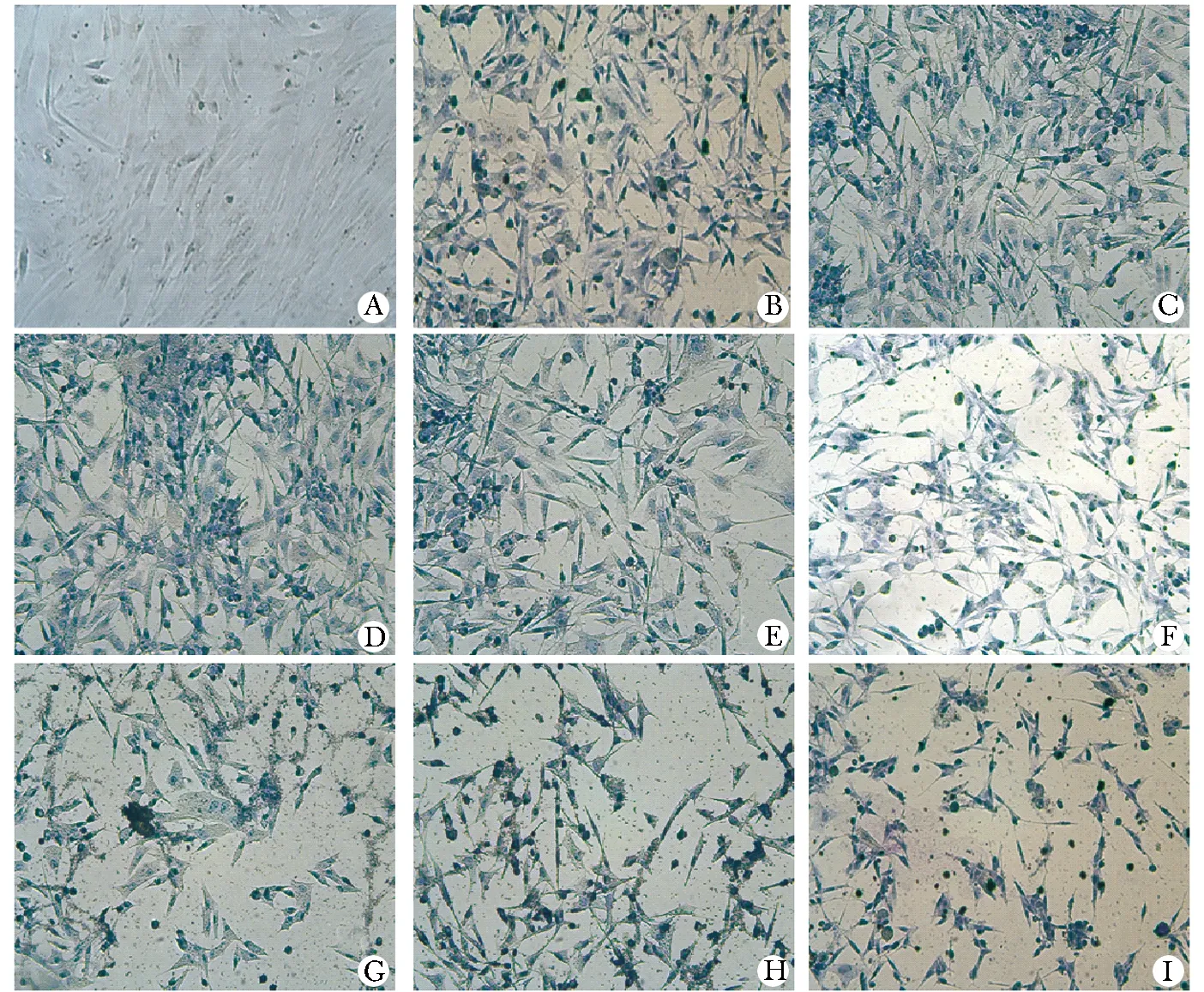
A.hUC-MSCs; B.the basic induction of hUC-MSCs; C.1∶4; D.1∶3; E.1∶2; F.1∶1; G.2∶1; H.3∶1; I.4∶1图1 共培养21 d后甲苯胺蓝染色结果Fig 1 The result of Toluidine blue staining after cocutturing for 21 days(×10)

A.hUC-MSCs; B.the basic induction of hUC-MSCs; C.1∶4; D.1∶3; E.1∶2; F.1∶1; G.2∶1; H.3∶1; I.4∶1图2 共培养21 d后免疫荧光鉴定结果Fig 2 The result of immunofluorescece staining of coculturing for 21 days(×100)
3 讨论
本研究的hUC-MSCs通过Ⅱ型胶原酶消化脐带得到,高表达CD29、CD44和CD105,而其CD31、CD34、CD40、CD45和HLA-DR均低表达或不表达,且前期的流式细胞仪检测周期结果显示[8],大部分hUC-MSCs处于G0/G1期,其余hUC-MSCs均处于增殖分裂期,说明hUC-MSCs处于为分化的状态。茜素红染色、油红O染色以及Alcian blue 染色进一步说明hUC-MSCs具有向成骨、成脂肪和成软骨诱导分化的能力,和骨髓来源的间充质干细胞一致,符合间充质干细胞的特性[11]。
软骨细胞具有分泌作用,可分泌骨形态蛋白、碱性成纤维细胞生长因子、血小板衍生生长因子、胰岛素样生长因子等[12]。早有文献报道,其分泌的细胞因子可以促进间充质干细胞向成软骨细胞诱导分化[13]。本实验将兔膝关节软骨细胞与hUC-MSCs共培养,结果显示实验组上层细胞Alcian blue染色和甲苯胺蓝染色检测成阳性,提示实验组上层细胞能够分泌成软骨细胞特异性表达,证实是软骨细胞。
本实验引进Transwell膜、通过Transwell小室实现软骨细胞与hUC-MSCs的共培养。Transwell膜,聚酯材料,孔径≤3.0 μm,这种膜允许生物大分子自由通过膜的微孔隙,而细胞不可能通过膜的微孔隙,而且选用的聚酯膜为镜下透明膜,故对镜下的直接观察不产生影响[7-8]。所以Transwell膜的引进,完全可以实现关节软骨细胞与hUC-MSCs的共培养,又可以清晰、明了、简单地获取实验结果。
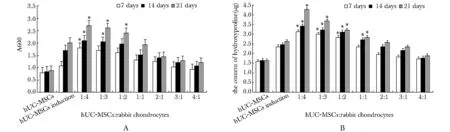
A.the quantitative detection of the content of glycosaminoglycan; B.the quantitative detection of the content of hyelroxy proline;*Plt;0.05 compared with the basic induction group (positive group)
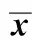
A.the expression level of GAG; B.the expression level of COL2A1;*Plt;0.05 compared with the basic induction group (positive group)
在本研究中,甲苯胺蓝染色和免疫荧光染色表明各实验组中均有GAG和COL2A1的分。GAG和COL2A1为软骨细胞特异性细胞外基质,两者的存在说明有成软骨样细胞的产生。GAG和COL2A1的含量检测结果显示,实验组1∶4其GAG和COL2A1的含量显著高于阳性对照组和其他实验组。qPCR检测软骨细胞GAG、COL2A1 mRNA的表达,提示实验组与阳性对照组细胞GAG、COL2A1表达成阳性,进一步证实实验组hUC-MSCs已向软骨细胞转化,实验组1∶4的GAG、COL2A1含量显著高于阴性对照组。
综上所述,一定比例的Transwell 共培养可明显增强hUC-MSCs的成软骨诱导分化的能力。而且,从本研究中可知hUC-MSCs与兔膝关节软骨细胞的最佳Transwell 共培养比例为1∶4。但hUC-MSCs分化为软骨细胞的具体机制还需进一步研究。
[1] Tsuchiya K, Chen G, Ushida T,etal. The effect of coculture of chondrocytes with mesenchymal stem cells on their cartilaginous phenotypeinvitro[J]. Materials Science and Engineering, 2004, 24: 391-396.
[2] 张玉琳. 人脐带间充质干细胞抑制同种异体脐血淋巴细胞的转化. 2012, 32: 930-934.
[3] 范存刚,周景儒,张庆俊. 人脐带间充质干细胞的生物学性质研究进展[J]. 基础医学与临床. 2010, 30: 215-218.
[4] Andrea R, Elizabeth Y, James P. Andry MD,etal. Coculture of engineered cartilage with primary chondrocytes induces expedited growth[J]. Clin Orthop Relat Res, 2011, 469:2735-2743.
[5] Nam MH, Lee HS, Seomun Y,etal. Monocyte-endothelium-smooth muscle cell interaction in co-culture: proliferation and cytokine productions in response to advanced glycation end products [J].Biochim Biophys Acta, 2011, 1810:907-912.
[6] Song KD, Li WF, Wang H,etal. Investigation of coculture of human adipose-derived stem cells and mature adipocytes [J]. Appl Biochem Biotechnol, 2012, 167:2381-2387.
[7] The Ministry of Science and Technology of the People’s Republic of China. Guidance Suggestions for the Care and Use of Laboratory Animals, 2006-09-30.
[8] 罗二梅, 宇丽, 张家文, 等. 还原型谷胱甘肽对人脐带间充质干细胞成软骨诱导的影响[J]. 中国组织工程杂志. 2013,33: 1-8.
[9] Björnsson S. Simultaneous preparation and quantitation of proteoglycans by precipitation with alcian blue [J]. Anal Biochem, 1993, 210: 282-291.
[10] Tichopad A, Dilger M, Schwarz G,etal. Standardized determination of real-time PCR efficiency from a single reaction set-up [J]. Nucleic Acids Res, 2003, 31: e122.
[11] Ramasamy R, Tong CK, Yip WK,etal. Basic fibroblast growth factor modulates cell cycle of human umbilical cord-derived mesenchymal stem cells [J]. Cell Prolif, 2012, 45, 132-139.
[12] Hoff P, Buttgereit F, Burmester CR,etal. Osteoarthritis synovial fluid activates pro-inflammatory cytokines in primary human chondrocytes [J]. Int Orthop, 2013, 37:145-151.
[13] Tan AR, Dong EY, Andry JP,etal. Coculture of engineered cartilage with primary chondrocytes induces expedited growth [J]. Clin Orthop Relat Res, 2011, 469:2735-2743.
Human umbilical cord mesenchymal stem cells are inducedto differentiate into chondrocytes by co-culture with rabbit chondrocytes
LUO Er-mei1, ZHANG Jia-wen1, HU Xiao-ke1, TANG Ming-qiao2*, YU Li1*
(1.Dept. of Biochemistry, Medical College;2.Dept.of Civil Engineering College of Science and Engineering, Jinan University, Guangzhou 510632, China)
ObjectiveTo determine if the co-culture of rabbit articular chondrocytes and hUC-MSCsinvitrocan affect differentiation of hUC-MSCs into cartilage-like cells, especially chondrocytes, and if so, what the optimal ratio of the two cell types is.MethodsTo co-culture rabbit articular chondrocytes and hUC-MSCs at a chondrocyte: hUC-MSCs ratio of 4∶1, 3∶1, 2∶1, 1∶1, 1∶2, 1∶3,1∶4 for 21 days and cultured in DMEM high glucose medium. Type Ⅱcollagen (COL2A1) and glycosaminoglycan (GAG) were analyzed qualitatively by toluidine blue and immunofluorescence technique, respectively. The contents of COL2A1 and GAG were estimated from the determination of hydroxyproline content and Alcian Blue method separately. The mRNA expressions ofGAGandCOL2A1 were assayed by real-time fluorescence quantitative PCR.ResultsThe expression ofCOL2A1 andGAGon day 21 was much higher in the 4∶1, 2∶1, and 1∶1 groups than in other the experimental group or the induced hUC-MSCs group. Also on day 21, the expression of COL2A1 and GAG proteins in the 4∶1 group was much higher than that in all other groups.ConclusionsThe optimal cell ratio in Transwell co-culture system appears to be 1∶4 (hUC-MSCs:chondrocytes).
transwell co-culture system; human umbilical cord mesenchymal stem cells; rabbit knee articular chondrocytes; co-culture; chondrogenic induction
2013-03-08
2013-06-17
广东省自然科学基金(9151008901000050)
*通信作者(correspondingauthor): doctoryuli@yahoo.com.cn; tmqtmq@jnu.edu.cn
1001-6325(2014)01-0082-06
Q 254
A

