重组结核病疫苗rBCG-IL-12p70-TB10.4的免疫效应
张丰经,何红云,邓仪昊,杨开明
(云南省大理学院 基础医学院 人体解剖学教研室,云南 大理 671000)
研究论文
重组结核病疫苗rBCG-IL-12p70-TB10.4的免疫效应
张丰经,何红云,邓仪昊*,杨开明
(云南省大理学院 基础医学院 人体解剖学教研室,云南 大理 671000)
目的将成功构建的重组卡介苗rBCG-IL-12p70-TB10.4免疫BALB/c小鼠,研究其免疫效应,为结核病新疫苗的研发提供依据。方法将融合基因IL-12p70-TB10.4克隆入pMV361构建重组质粒,以电转化方式将重组质粒导入卡介苗基因组,构建重组结核病疫苗rBCG-12p70-TB10.4 (rBCG-IT)。将此重组卡介苗免疫BALB/c小鼠,分别于免疫后3、6、9和12周,用间接ELISA检测特异性抗体滴度水平,XTT检测脾细胞增值反应, 流式细胞仪检测脾CD4+T、CD8+T细胞亚型的比例,ELISA试剂盒检测细胞因子的诱生。结果在免疫后3~12周,rBCG-IT组脾细胞增殖反应均明显强于其他各组(Plt;0.01),该组IFN-γ诱生量及CD4+T细胞比例均显著高于rBCG-I组、rBCG-T组及BCG组(Plt;0.01)。IgG2a/IgG1比值在免疫后各时间点的变化趋势提示rBCG-IT可诱导Th1型细胞免疫应答。结论重组疫苗rBCG-IT可诱导产生较BCG更强、持续时间更长的特异性细胞免疫应答,可对其免疫保护作用进行深入研究。
重组卡介苗;IL-12p70;TB10.4;免疫效应
由结核分枝杆菌(Mycobacteriumtuberculosis,MTB)感染引起的结核病仍是严重威胁人类健康的重大传染病。目前,预防结核病的唯一有效疫苗是卡介苗(bacilli calmette-guérin, BCG),而BCG的免疫保护作用在某些人群或地区不稳定[1]。在各国学者的努力下,有多种新型MTB疫苗相继问世,有数株疫苗甚至已进入临床前期研究[2-3]。但到目前为止,还没有一种新型结核病疫苗可取代BCG在人类推广使用。
TB10.4只存在于致病性结核分枝杆菌H37Rv[4]。由于TB10.4具有较强的免疫原性,已被广泛应用于多种新型结核病疫苗的研究[5-6]。目前全球有约1/3人群感染MTB,其中90%为潜伏感染者[7]。若要发展针对潜伏感染菌的疫苗,则要求该疫苗不仅具有较强的免疫刺激作用,还应具备刺激机体产生多种细胞因子的功能。Interleukin(IL)-12是体内免疫调节作用最强、调节范围最广的细胞因子,可调节多功能免疫细胞产生多种细胞因子如IL-2、IFN-γ及TNF-α等[8]。因此,在本研究中,向BCG基因组引入免疫刺激性抗原TB10.4的同时,向其导入具有调节多种细胞因子产生的IL-12p70构建新型结核病疫苗,以期获取更理想的、尤其是针对休眠期MTB的结核病新疫苗。
1 材料与方法
1.1 材料
含大肠杆菌-分枝杆菌穿梭表达质粒pMV361的菌液及结核分枝杆菌H37RV基因组DNA(本室保存)。含人细胞因子IL-12p70基因的质粒pORF-IL-12p70 G2(InvivoGen公司);BCG上海株(成都生物制品研究所)。高保真Taq DNA聚合酶、质粒提取试剂盒和DNA连接试剂盒(Omega公司)。限制性核酸内切酶(晶美生物公司)。结核菌素纯蛋白衍生物 (1 mg/L, TB-PPD,北京祥瑞生物制品有限公司);抗结核分枝杆菌TB10.4及抗人IL-12p40单克隆抗体(Abcam公司);PE 标记的CD4+及FITC标记的CD8+IgG(eBioscience 公司);IFN-γ及IL-4检测试剂盒(Bamp;D公司)。
1.2 方法
1.2.1 重组疫苗rBCG-IT的构建及鉴定:根据人细胞因子IL-12p70及TB10.4基因序列设计并合成下述3对引物:P1:5′-GCCAATTGATATGTGTCACAGC AGTTG-3′(MunI);P2:5′-GCTTCGAATGGAAGCATT CAGATAGCT-3′(NspV);P3:5′-GCCAATTGTAATGT CGCAAATCATGTACAAC-3′(MunI);P4:5′-ATTTCG AATCTAGCCGCCCCATTTGG-3′(MunI);P5:5′-GCT TCCACCTCCTCCGCTTCCACCACCTCCGCTTCCACCG CCACCGGAAGCATTCAGATAGCT-3′(Linker);P6:5′-GGTGGCGGTGGAAGCGGAGGTGGTGGAAGCGGA GGAGGTGGAAGCAATGTCGCAAATCATGTACAAC-3′(Linker)。短划线部分为克隆位点,长划线部分为45bp互补linker碱基序列。以pORF-IL-12p70 G2为模板,P1和P2为引物进行PCR扩增获取IL-12-p70,以结核分枝杆菌H37Rv基因组DNA为模板,P3和P4为引物获取TB10.4基因,分别在IL-12-p70上游引物(P5)及TB10.4下游引物(P6)分别引入45bp互补linker碱基序列,通过重叠延伸PCR(spliced overlap extension PCR, SOE PCR)获取融合基因IL-12-p70-TB10.4。将上述基因分别克隆入以大肠杆菌-分枝杆菌穿梭表达质粒pMV361构建重组质粒。向BCG菌苗加入终浓度为5%甘氨酸,37 ℃作用24 h,集菌,10%甘油洗涤,再重悬于10%甘油制备BCG感受态细胞,将上述重组质粒及pMV361空质粒加入感受态BCG,电穿孔仪(BTX)进行电转化,电转化结束后,将菌悬液转入含卡拉霉素的Sauton培养基进行抗生素筛选、提取重组卡介苗基因组进行PCR扩增及基因测序鉴定,对重组卡介苗进行热诱导表达,经Western blot鉴定,重组卡介苗表达相应重组蛋白后分别命名为: rBCG-I(rBCG-IL-12p70),rBCG-T(rBCG-TB10.4),rBCG-IT(rBCG-IL-12p70-TB10.4),rBCG-361。
1.2.2 动物分组及免疫:清洁级、雌性BALB/c小鼠,3~5周龄,96只(昆明医科大学实验动物中心,许可证号:SCXK 滇2005-0008),随机分为6组:即BCG组;rBCG-I组;rBCG-T组;rBCG-IT组;rBCG-361组;对照组:PBST组(0.01 mol/L PBS中含0.05% 吐温80),每组16只。重组卡介苗及BCG以5×105CFU稀释于PBST液(0 .1 mL),皮下多点注射免疫,PBST组注射等体积PBST。
1.2.3 特异性血清IgG、IgG1及IgG2a抗体滴度检测:分别于免疫后3、6、9及12周,每组取4只小鼠,活体摘眼球取血,离心收集血清备用。用间接ELISA(indirect enzyme-linked immunosorbent assay, iELISA)测定血清抗体滴度。TB-PPD(1 mg/L,100 μL)包被酶标板,4 ℃避光放置12 h,将待测血清2倍系列稀释加入酶标板,37 ℃孵育1 h,PBST(0.01 mol/L PBS中含0.05% 吐温20)洗板3次,分别加入适当稀释的HRP标记的羊抗小鼠IgG(稀释度为1∶4 000)、IgG1(稀释度为1∶1 000)或IgG2a(稀释度为1∶1 000),37 ℃温育45 min,洗板后OPD显色,490 nm波长处测吸光度值(A值)。以PBST组为阴性对照。当A490值≥0.05、实验组吸光度值/对照组吸光度值≥2.0认定为阳性。抗体滴度定义为血清样品吸光度值/阴性对照组(PBST)吸光度值≥2.0时的最大血清稀释倍数。每个血清样本进行3次重复实验,计算IgG2a/ IgG1值,观察疫苗诱导的免疫趋向。
1.2.4 特异性脾淋巴细胞增殖实验(XTT):无菌条件下分离脾脏,经研磨、过滤和吹打制成单细胞,置含胎牛血清的RPMI-1640培养基。调整细胞数,加入96孔板,每孔5×104/0.1 mL,每个样本设6个复孔,并设非刺激孔和空白对照孔,刺激孔加入等体积TB-PPD(1 mg/L)进行刺激,非刺激孔加入等量PBS,空白对照孔不加淋巴细胞,以等体积PBS代替。37 ℃、5% CO2孵箱培养72 h,结束培养前4 h加入XTT混合液(1 g/L的XTT 4 mL中含0.15 g/L的PMS 0.1 mL)20 μL,450 nm波长测吸光度(A450),结果用刺激指数SI表示,SI=刺激孔吸光度值/非刺激孔吸光度值。每组细胞进行3次重复实验。
1.2.5 脾CD4+T和CD8+T细胞亚型的比例变化:分别在免疫后3、6、9及12周,将上述分离培养细胞以每孔3×106/1 mL加入6孔板,每个样本设3个复孔,同时加入等体积TB-PPD(1 g/L)进行刺激,37 ℃、5% CO2孵箱培养72 h后收集细胞,PBS洗涤后,分别加入PE标记的羊抗小鼠CD4+IgG(0.01 mol/L PBS稀释,稀释度为:1∶200)及FITC标记的羊抗小鼠CD8+IgG(1∶150),室温孵育1 h,PBS洗涤3次,流式细胞仪检测CD4+T和CD8+T细胞的比例。
1.2.6 细胞因子IFN-γ和IL-4的诱生:将上述脾细胞加入6孔板,每孔2×106/1 mL,每组设3个复孔,等体积TB-PPD(1 g/L)刺激72 h,收集培养液,IFN-γ或IL-4检测试剂盒检测细胞因子的表达,各操作步骤严格按照试剂盒操作指南进行。
1.3 统计学分析
2 结果
2.1 重组疫苗的构建及鉴定
各重组疫苗均构建成功。重组疫苗rBCG-IT可表达相应目的蛋白(图1),而BCG及rBCG-361均不能表达IL-12p70及TB10.4.
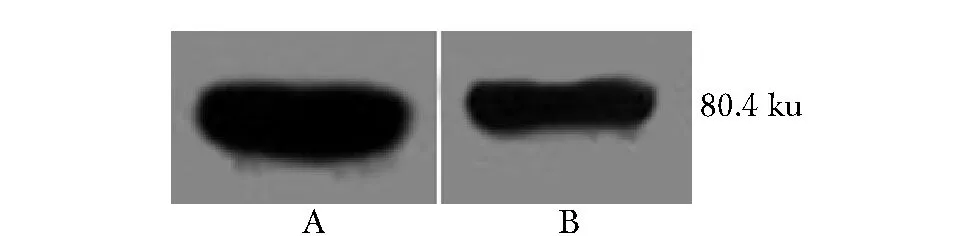
A.expression of rBCG-IT was detected with antibody recognizing IL-12p70; B.expression of rBCG-IT was detected with antibody recognizing TB10.4 图1 重组卡介苗rBCG-IT热诱导表达及Westernblot鉴定Fig 1 rBCG-IT was induced by heating to express and detected by Western blot
2.2 重组卡介苗诱导的特异性血清抗体滴度
重组卡介苗rBCG-IT组IgG、IgG1及IgG2a抗体滴度在免疫后6~12周均明显高于BCG组 (Plt;0.01)。IgG2a/ IgG1比值(图2)变化趋势提示,重组卡介苗rBCG-IT可诱导Th1型细胞免疫应答。而在对照组PBST组,各时间点的抗体滴度均维持在较低的1∶20或1∶40水平。
2.3 脾淋巴细胞增殖实验
从免疫后6~12周,重组卡介苗rBCG-IT组刺激指数显著高于其他各组(Plt;0.01)。在免疫后9周,增殖反应达到高峰,12周时有所下降,但仍维持在较高水平。rBCG-I组、rBCG-T组及rBCG-361组脾细胞增殖反应与BCG相当(图3)。
2.4 免疫小鼠CD4+T和CD8+T细胞亚型受抗原刺激后的比例变化
免疫后9~12周,如表1所示,rBCG-IT组CD4+T阳性细胞百分比均明显高于其他各组(Plt;0.01)。
2.5 细胞因子的诱生
在免疫后各时间点,rBCG-IT组IFN-γ的诱生量均显著高于BCG组 (Plt;0.01,图4)。
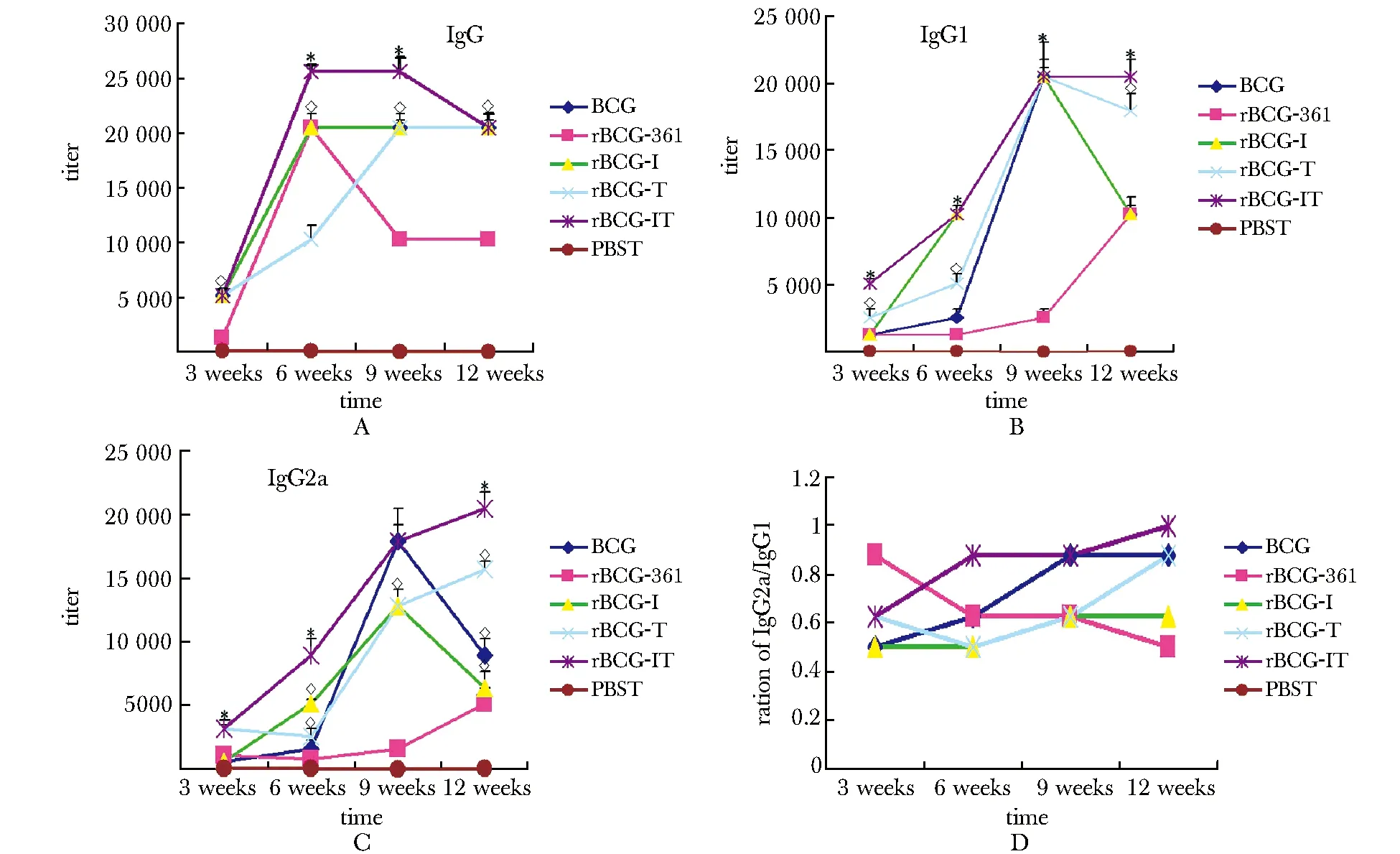
A,B,C.shows antibody levels of IgG, IgG1 and IgG2a, respectively*showsPlt;0.01, versus rBCG-361,BCG or PBST group; the ratio of IgG2a/IgG1(D) indicated a shift towards a Th1 immune response in rBCG-IT group
图2免疫小鼠血清特异性IgG、IgG1和IgG2a抗体滴度水平分析
Fig2AnalysisofIgG,IgG1andIgG2aantibodytitersofimmunizedmice(n=4)
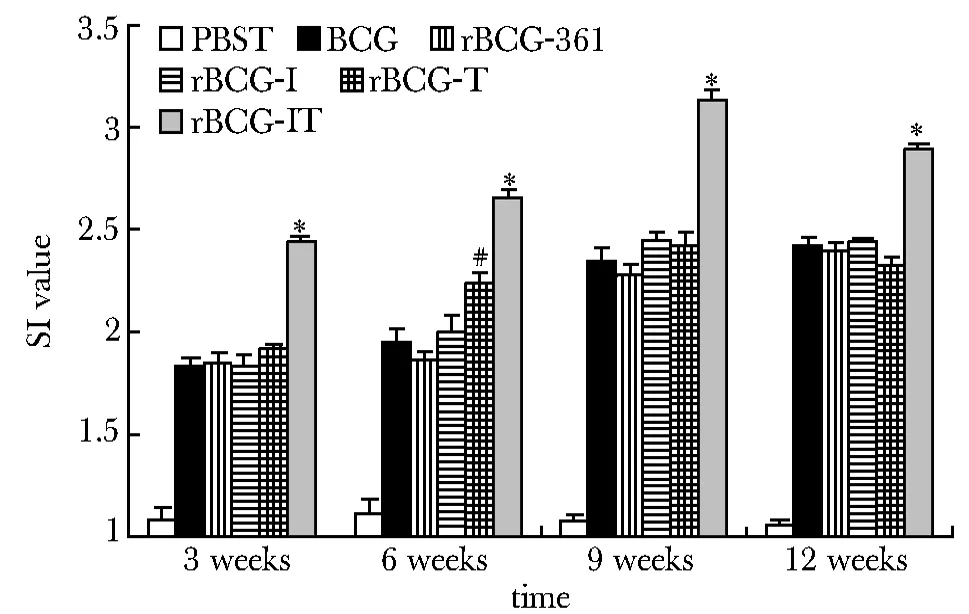
*Plt;0.01 compared with rBCG-I or rBCG-T group; #Plt;0.01 compared with rBCG-361 group, BCG group, or PBST group图3 脾淋巴细胞增殖实验Fig 3 Lymphoproliferative response to specific
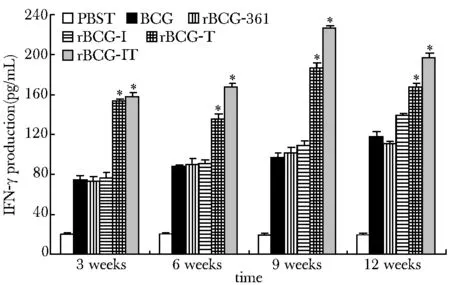
*Plt;0.01 compared with BCG group, rBCG-I group, rBCG-T group, rBCG-361 group or PBST group图4 细胞因子IFN-γ的诱生Fig 4 IFN-γ production by splenocytes from immunized
3 讨论
重组卡介苗具有较多优势,如安全、廉价、容易获取及保存方便,更重要的是,它是活疫苗,可在体内不断繁殖而长期存活,不断分泌自身蛋白及重组蛋白,持续刺激机体产生长期的免疫应答。因此,重组卡介苗在新型结核病疫苗研发中更具可行性及研究价值。
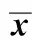
表1 流式细胞仪检测CD4+和CD8+细胞的比例Table 1 Percentages of CD4+ T and CD8+ T splenocyte subsets detected by flow cytometry(±s, %, n=4)
*Plt;0.01 compared with BCG group, rBCG-I group, or rBCG-361 group, or PBST group;#Plt;0.01 compared with BCG group, rBCG-361group, or PBSTgroup;ΔPlt;0.01 compared with BCG group, rBCG-361group, or PBST group.
从本研究结果看,重组疫苗rBCG-IT和rBCG-T均可诱导产生较BCG更强的细胞免疫应答,凸显了TB10.4较强的免疫刺激功能。而与rBCG-T相比,rBCG-IT可诱导产生更强的免疫应答,尤以高水平IFN-γ诱生量及长时间免疫应答的维持最为突出。其原因在于,重组卡介苗rBCG-IT在表达免疫刺激性抗原TB10.4的同时,还可表达免疫调节因子IL-12p70,该细胞因子可广泛调节多功能免疫细胞的功能,促进Th1型细胞因子如IFN-γ等的产生[9],而多种细胞因子的产生则有利于机体对休眠MTB的识别和清除,从而更有效的控制结核病的发生。本研究提示,重组卡介苗rBCG-IT与其他结核病疫苗相比,在预防休眠MTB中更具优势,值得深入探究。
[1] Russell DG, Barry CE, Flynn JL. Tuberculosis: what we don’t know can, and does, hurt us [J]. Science, 2010, 328:852-856.
[2] Aagaard C, Hoang T, Dietrich J,etal. A multistage tuberculosis vaccine that confers efficient protection before and after exposure [J]. Nat Med, 2011, 17:189-194.
[3] 邓毛子, 石春薇, 王芳, 等. 结核分枝杆菌Ag85A蛋白的原核表达、纯化和免疫反应性 [J]. 基础医学与临床, 2010, 30: 117-121.
[4] Kato-Maeda M, RheeJT, Gingeras TR,etal. Comparing genomes within the species Mycobacterium tuberculosis [J]. Genome Res, 2001, 11:547-554.
[5] Hoft DF, Blazevic A, Stanley J,etal. A recombinant adenovirus expressing immunodominant TB antigens can significantly enhance BCG-induced human immunity [J]. Vaccine, 2012, 30: 2098-2108.
[6] Elvang T, Christensen JP, Billeskov R,etal. CD4 and CD8 T cell responses to the M.tuberculosis Ag85B-TB10.4 promoted by adjuvanted subunit, adenovector or heterologous prime boost vaccination [J]. PLoS One, 2009, 4: e5139.doi:10.1371/journal.pone.0005139.
[7] Aristoff PA, Garcia GA, Kirchhoff PD,etal. Rifamycins-obstacles and opportunities [J]. Tuberculosis (Edinb), 2010, 90:94-118.
[8] Trinchieri G. Interleukin-12 and the regulation of innate resistance and adaptive immunity [J]. Nat Rev Immunol, 2003, 3:133-146.
[9] Sutherlang JS, de Jong BC, Jeffries DJ,etal. Production of TNF-alpha, IL-12(p40) and IL-17 can discriminate between active TB disease and latent infection in a West African cohort [J]. PLos One, 2010, 5:e12365.doi:10.137/journal.pone.0012365.
Immunization efficacy of a recombinant tuberculosis vaccine of rBCG-IL-12p70-TB10.4
ZHANG Feng-jing, HE Hong-yun, DENG Yi-hao*, YANG Kai-ming
(Dept. of Anatomy, College of Preclinical Medicine, Dali University, Dali 671000, China)
ObjectiveThe recombinant Bacilli Calmette-Guérin (BCG) of rBCG-IL-12p70-TB10.4 was used to vaccinate in BALB/c mice to investigate its immunogenicity, and to prepare for exploring new vaccines againstMycobacteriumtuberculosis(MTB).MethodsFusion gene of IL-12p70-TB10.4 was cloned into multiple cloning sites of plasmid pMV361 to construct recombinant plasmid. The recombinant plasmid was transformed into BCG using Electroportation Generator to construct MTB vaccine of rBCG-12p70-TB10.4(rBCG-IT) and then Balb/c mice were immunized in 3, 6, 9, 12 weeks after immunization, antibody titer was fitrated by indirect ELSIA, and cellular response was evaluated by XTT, ratios of CD4+T and CD8+T cells were detected by flow cytometry, and IFN-γ production was measured by ELISA kit.ResultsThe recombinant vaccine of rBCG-IT was able to induce high level of specific antibody, stronger proliferative responses and greater IFN-γ production as compared with BCG vaccine.ConclusionsThe recombinant vaccine of rBCG-IT may elicit stronger and more long-lasting humoral and cell-mediated responses compared with BCG vaccine, and was worth exploring its protective efficacy.
recombinant BCG; IL-12p70; TB10.4; immunization efficacy
2013-03-01
2013-05-02
大理学院博士科研启动基金(KYBS201103)
*通信作者(correspondingauthor): deng13032871868@163.com
1001-6325(2014)01-0093-05
R 392.9
A

