左归降糖解郁方对大鼠海马神经元细胞的保护作用
张秀丽,王宇红*,杨 蕙,徐雅兰
(1.湖南中医药大学,湖南 长沙410208;2.湖南省中药粉体与创新药物省部共建国家重点实验室培育基地,湖南 长沙410208;3.湖南中医药大学第一附属医院中药药理(心血管)实验室,湖南 长沙410007)
糖尿病是一种常见的慢性疾病, 我国约有1.43 亿人患有糖尿病, 糖尿病患者易并发抑郁症, 其患抑郁症的可能性是普通人的3~5 倍,复发率是非糖尿病患者的8 倍[1]。 而糖尿病并发抑郁症(Diabetes mellitus with depression,DD)患者的自杀危险性高达10%[2],远高于普通抑郁症患者。 目前尚无一种模型能够完全模拟人类DD 的临床症状与体征,极大限制了DD 发病机制和药物研究。本课题组在前期研究过程中, 基于临床病人发病特征,采用复合式高脂灌胃、 链脲佐菌素(streptozotocin,STZ)注射和慢性应激“三联法”,建立了一种简便、可靠、稳定而又有与人类DD 相似症状的动物模型[3]。 但是,仅有动物模型,很难全面阐释某一疾病的发生发展机制。 DD 发生发展的关键靶器官是海马组织中的海马神经元细胞,该细胞的损伤都是微观的,在体实验中很难观察,只有进一步通过建立DD细胞模型, 才能全面阐明DD 损伤海马神经元细胞的机制。 但国内外仅有糖尿病细胞模型以及抑郁症细胞模型,DD 的细胞模型尚未见报道。 李静等[4]采用CORT(100 μM/L)损伤原代海马神经元细胞,模拟应激状态下高浓度糖皮质激素导致的海马神经元细胞损伤。 与我们前期经CORT 诱导建立抑郁症细胞的实验结果相吻合。 因此我们利用高糖(75 mM/L)联合CORT(100 μM/L)诱导原代海马神经元细胞建立DD 细胞模型。 左归降糖解郁方是针对DD 中医“虚、瘀、郁”基本病机的有效方药,近年来本课题组对左归降糖解郁方对DD 的干预进行了较深入的研究,如细胞模型复制及中药干预[3,5-6]。 本实验采用复方中药左归降糖解郁方对DD 细胞模型进行干预,探讨中医药治疗DD 疗效,为其提供新思路,现将方法与结果报道如下。
1 材料
1.1 动物
SPF 级SD 怀孕大鼠(受孕19 d)1 只与SPF 级SD 大鼠(体质量约200~220 g)30 只购于湖南斯莱克景达实验动物有限公司, 许可证号:SCXK (湘)2011-0003。
1.2 药物
左归降糖解郁方:黄芪18 g,熟地黄15 g,枸杞12 g,山茱萸12 g,丹参12 g,姜黄9 g,菟丝子9 g,杜仲9 g,牛膝9 g,牡丹皮6 g,贯叶连翘3 g。原材料购自湖南中医药大学第一附属医院,并由该院制剂科按比例水煎浓缩后制成口服液100 mL,采用一测多评的质量控制方法,其含主要药效成分分别为黄芪甲苷≥30 μg/mL、 贯叶金丝桃素≥18 μg/mL、 姜 黄 素≥0.4 mg/mL、 丹 酚 酸B ≥1.2 mg/mL、 丹皮酚≥0.2 mg/mL; 盐酸二甲双胍片(规格0.25 g/片,批号1303106,湖南湘雅制药有限公司); 盐酸氟西汀胶囊 (规格20 mg/粒, 批号0972A,法国Patheon France)。
1.3 主要试剂
皮质酮、L-多聚左旋赖氨酸、 二甲亚砜(Sigma,美国);胰蛋白酶、噻唑蓝(MTT) (AMRESCO,美国);胶原酶、D-葡萄糖、DMEM/F12、B27 添加剂、Neurolbasal、胎牛血清(Gibco,美国);NMDAR2A 一抗、二抗(Ambo 试剂公司分装);羊抗兔IgG(二抗)(PROTEINIECH, 美国);TUNEL 试剂盒 (Boehringer,德国);DAB 显色试剂盒、SABC 免疫组化试剂盒 (武汉博士德生物工程有限公司);Penicillin、Streptomycin(碧云天生物技术研究所);葡萄糖氧化酶-过氧化物酶(GOD-POD)试剂盒(中生北控生物科技股份有限公司);NSE 免疫组化试剂盒(北京博奥森生物技术有限公司)。
1.4 主要仪器
DMIRB 倒置荧光显微镜(Leica);TECAN 酶标定量测试仪 (瑞士Bio-Rad);3110 CO2细胞培养箱(Thermo Scientific Forma);BIX-103G 解 剖 显 微 镜(北京陆希科技有限公司);JA1003N 电子天平(天津精密科学仪器有限公司)。
2 方法
2.1 含药血浆的制备
将SPF 级SD 大鼠30 只分为空白组、二甲双胍合氟西汀组及左归降糖解郁方组 (每组10 只)用于制备含药血浆。 给药剂量按前期动物实验结果[5],即二甲双胍按0.18 g/kg、氟西汀按1.8 mg/kg、左归降糖解郁方按20.53 g/kg 给药,1 天2 次,连续3 d,末次给药1 h 后处死动物取含药血浆。 空白组给予相同剂量的蒸馏水后取血浆作为空白血浆。
2.2 细胞培养
将受孕19 d 的SD 大鼠处死后,取出8 只胎鼠的海马组织迅速投入盛有无菌PBS 缓冲液 (1 ℃)的培养皿中,加入与无菌PBS 等体积的0.25%胰蛋白酶和0.2%胶原酶, 轻轻吹打30~50 次,37 ℃消化,每隔3~5 min 手动轻轻混匀1 次,消化至无明显组织沉淀后加入培养液终止消化,混匀,100 目筛网过滤,1 000 r/min 离心5 min 收集细胞。 调整细胞浓度为2×105/mL,按100 μL/孔接种至96 孔板,分4 组(即空白组、模型组、二甲双胍合氟西汀组及左归降糖解郁方组), 每组4个复孔,37 ℃、5%CO2培养箱中培养, 以后每隔3 d 换1 次维持培养液。海马神经元细胞培养约7 d, 至观察到由增大的神经元胞体、明显的光晕、延长的突起形成较为复杂的网络[3]。
2.3 细胞模型建立
将“2.1”接种的模型组与给药组细胞加入高糖(75 mM) 联合100 μM 皮质酮建立DD 细胞模型[4],空白组加入葡萄糖浓度至25 mM。
2.4 给药方法及给药剂量
于“2.2”各组细胞中加入空白血浆及含药血浆,体积为25 μL/孔。
2.5 指标检测
2.5.1 海马神经元细胞一般形态学观察 分别于接种后第6 h、24 h、3 d、7 d 用倒置显微镜对海马神经元细胞进行一般形态学观察,并拍照。
2.5.2 神经元特异性烯醇化酶(NSE)法鉴定神经细胞纯度 培养7 d 的大鼠海马神经元利用NSE 免疫细胞化学染色试剂盒进行纯度鉴定,海马神经元经染色呈弥漫性胞浆着色者为阳性细胞[5],随机选取视野中200个细胞统计阳性细胞比率。
2.5.3 MTT 法检测神经细胞活性 “2.2”项下各组细胞经“2.3”、“2.4”处理后,每孔加入20 μL MTT溶液,分别于6、12、24、48 h 及72 h 运用酶标仪于波长490 nm 测定各孔的OD 值。 细胞活性计算方法如下:
细胞存活率(%)=OD490(实验组)/OD490(对照组)×100%
2.5.4 HE 染色观察神经细胞损伤状况 将分离的海马神经元细胞均匀接种在放有14 mm 圆形盖玻片的24 孔板中,培养7 d 后按分组情况参照“2.3”、“2.4” 加入不同诱导物与含药血浆, 孵育24 h 后,HE 染色观察各组海马神经元的病理改变。
2.5.5 TUNEL 染色检测细胞凋亡情况 将分离的海马神经元细胞按“2.5.4”的方法做前期处理。 待药物干预24 h 后,取出培养有细胞的盖玻片置于4%的中性甲醛中固定10 min, 用PBS 缓冲液清洗2次,TUNEL 染色试剂盒染色。 光镜下随机取15个高倍镜视野观察。
2.5.6 GOD-POD 法检测葡萄糖消耗量 将分离的海马神经细胞植入96 孔板并参照“2.5.3”的方法进行相应药物处理, 分别于孵育2、6、12、18、24 h 后按照各时间点收集各组细胞培养液,37 ℃保温10 min, 用葡萄糖测定试剂盒在酶标仪于波长505 nm 检测培养液OD 值 (理论计算公式:C样本=△A 样本/△A 校准×C校准,其中C校准=5.55 mM/L)。
2.6 统计学分析
采用SPSS 17.0 软件进行统计学分析,所有数据以“±s”表示,两组间的比较采用t 检验,多组间比较采用单因素方差分析(ANOVA)。 P<0.05 为差异有统计学意义。
3 结果
3.1 海马神经元细胞一般形态观察
显微镜下观察发现, 大部分细胞在接种6 h 就已贴壁,圆球状,小且透明,少量细胞有微小突起;培养24 h 后细胞完全贴壁, 有明显光晕, 突起较6 h时稍有见长;培养的第3 天,神经元突起进一步拉长且数量明显增多,交织构成较为稀松的网络;培养的第7 天,神经元胞体继续增大,周围光晕显著,突起延长,形成繁杂而紧密的神经元网络。 结果见封三彩图图1 所示。
3.2 NSE 神经细胞鉴定结果
培养7 d 的大鼠海马神经元胞体及树突着色良好, 视野下海马神经元NSE 染色阳性的细胞比率在93%以上,表明分离的海马神经元纯度高。 结果见封三彩图图2 所示。
3.3 神经细胞活性MTT 检测结果
与空白组相比,各时间点模型组、二甲双胍合氟西汀组及左归降糖解郁方组海马神经元细胞存活率均明显降低,所有时间点均有显著性统计学意义(P<0.01);与模型组相比,左归降糖解郁方组、二甲双胍合氟西汀组细胞存活率在第24、48 h 及72 h 均明显增加,差异具有统计学意义(P<0.05 或P<0.01);与二甲双胍合氟西汀组相比,左归降糖解郁方组海马神经元细胞存活率在6、12、24、48 h时与其作用相当, 但在72 h 时增加更明显 (P<0.05)。 见表1。
表1 MTT 法检测各组不同时间点的细胞存活率 (±s,n=5,%)
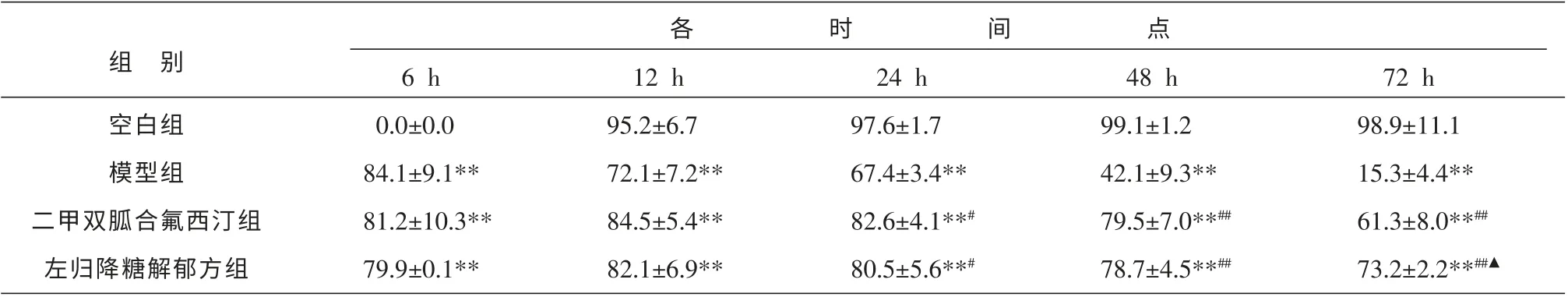
表1 MTT 法检测各组不同时间点的细胞存活率 (±s,n=5,%)
注:与空白组比较**P<0.01;与模型组比较#P<0.05,##P<0.01;与二甲双胍合氟西汀组比较▲P<0.05。
组 别空白组模型组二甲双胍合氟西汀组左归降糖解郁方组6 h 0.0±0.0 84.1±9.1**81.2±10.3**79.9±0.1**12 h 95.2±6.7 72.1±7.2**84.5±5.4**82.1±6.9**24 h 97.6±1.7 67.4±3.4**82.6±4.1**#80.5±5.6**#48 h 99.1±1.2 42.1±9.3**79.5±7.0**##78.7±4.5**##72 h 98.9±11.1 15.3±4.4**61.3±8.0**##73.2±2.2**##▲各时间点
3.4 HE 病理染色结果
镜下观察发现,空白组海马神经元细胞的细胞核成卵圆形,极少数成梭形,且细胞质、细胞核界线分明;模型组绝大多数细胞核呈梭形,近半数海马神经元细胞的细胞核、细胞质已融合在一起,界线模糊;其余两组的损伤程度介于空白组和模型组之间。 结果见封三彩图图3 所示。
3.5 细胞凋亡情况
空白组TUNEL 染色阳性细胞极为少见, 在所选取的15个视野中仅见数个阳性细胞; 模型组免疫阳性细胞较多, 每个高倍镜视野可见4~5个;左归降糖解郁方组和二甲双胍合氟西汀组免疫阳性细胞数明显减少,每个高倍镜视野只见2个左右阳性细胞,细胞核深染呈蓝黑色,形态不规则,有的呈花瓣状。 结果见封三彩图图4 所示。
3.6 各组海马神经元细胞葡萄糖消耗量比较
与空白组比较,模型组葡萄糖消耗量于各时间点均有显著降低(P<0.01);与模型组比较,左归降糖解郁方组和二甲双胍合氟西汀组葡萄糖浓度降低值升高, 并从12 h 开始差异均有显著性统计学意义(P<0.01);与二甲双胍合氟西汀组比较,在24 h时,左归降糖解郁方组培养基中葡萄糖浓度降低值稍高于二甲双胍合氟西汀组,但差异无统计学意义(P>0.05)。 结果见表2。
4 讨论
近年来研究表明,海马是学习、认知功能主要控制区,且参与了许多神经系统病变机制,而DD 的损伤部位主要在海马[6],所以利用海马细胞建立DD损伤模型,研究损伤机制并观察药物对海马神经细胞的保护作用具有重要意义。 目前国内外采用高糖诱导糖尿病模型最为广泛[7],也有许多学者[4]采用皮质酮损伤原代海马神经元细胞,模拟应激状态下高浓度糖皮质激素导致的海马损伤来建立抑郁症细胞模型。 故本实验采用二者联合的方法,采用高糖联合皮质酮诱导建立DD 细胞模型。
表2 各组不同时间点培养基中葡萄糖浓度降低值 (±s,n=5,mmol/L)
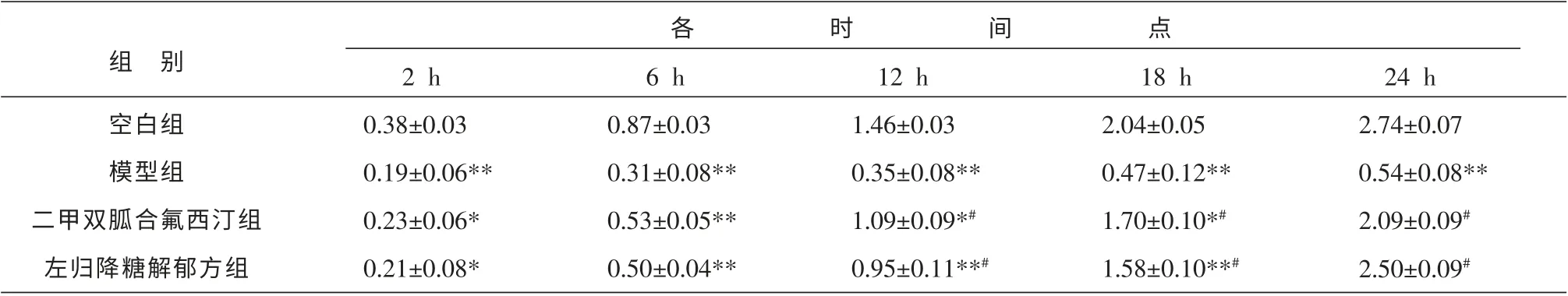
表2 各组不同时间点培养基中葡萄糖浓度降低值 (±s,n=5,mmol/L)
注:与空白组比较*P<0.05,**P<0.01;与模型组比较#P<0.01。
组 别空白组模型组二甲双胍合氟西汀组左归降糖解郁方组2 h 0.38±0.03 0.19±0.06**0.23±0.06*0.21±0.08*6 h 0.87±0.03 0.31±0.08**0.53±0.05**0.50±0.04**12 h 1.46±0.03 0.35±0.08**1.09±0.09*#0.95±0.11**#18 h 2.04±0.05 0.47±0.12**1.70±0.10*#1.58±0.10**#24 h 2.74±0.07 0.54±0.08**2.09±0.09#2.50±0.09#各时间点
本研究结果显示,与空白组比较,模型组各时间点细胞存活率明显降低;海马神经元细胞损伤显著;TUNEL 染色阳性细胞即凋亡细胞增多; 葡萄糖浓度降低值从2 h 开始明显低于空白组(P<0.01);该特征既符合糖尿病细胞模型又与抑郁症细胞模型相一致,表明采用高糖联合皮质酮方法可成功建立DD 细胞模型。
左归降糖解郁方以张景岳的左归饮、左归丸为基础方化裁而成,方中熟地黄为君滋养肾阴,山茱萸、枸杞为臣,合君药以加强滋补肾阴作用,佐以菟丝子、牛膝、杜仲补肝肾,黄芪健脾益气,丹参、牡丹皮活血散瘀,加入化瘀行气、疏肝解郁的姜黄、贯叶连翘,功能滋阴益气,化瘀解郁。 本课题组前期临床研究表明, 左归降糖解郁方能明显缓解DD 患者抑郁状况以及血糖、血脂、胰岛素的升高,实验研究发现其能明显改善DD 大鼠糖脂代谢紊乱、 延缓海马组织的病理损伤[3,5-6]。
本研究采用MTT 法检测海马神经元活性,结果显示左归降糖解郁方组细胞存活率在第24 h、48 h及72 h 均明显高于模型组(P<0.05 或P<0.01),且其在72 h 时也较二甲双胍合氟西汀组高(P<0.05);HE染色后镜下观察发现:左归降糖解郁方组细胞损伤程度介于空白组和模型组之间。TUNEL 染色发现左归降糖解郁方组免疫阳性细胞数明显减少,每个高倍镜视野只见2个左右阳性细胞,且细胞形态较模型组好。 以上结果说明,左归降糖解郁方可有效保护糖尿病合并抑郁症细胞模型中产生的细胞损伤,可明显提升细胞存活率,抑制细胞凋亡。 GOD-POD法检测结果显示, 左归降糖解郁方从12 h 起即可明显增加海马神经细胞的葡萄糖消耗量(P<0.01)。
综上所述, 左归降糖解郁方对DD 模型海马神经细胞模型具有明显的保护作用。 该研究结果将为左归降糖解郁方治疗糖尿病合并抑郁症的有效性提供体外细胞实验佐证,该研究结果也将为进一步结合体内试验研究左归降糖解郁方的中药干预的分子机制奠定基础。
[1]Egede LE, Ellis C. Diabetes and depression:Global perspectives[J]. Diabetes Res Clin Pr,2010,87(3):302-312.
[2]Franois P. Should we screen for emotional distress in type 2 diabetes mellitus[J]. Nat Rev Endocrinol,2009,5(12):665-671.
[3]Wang YH,Yin LT,Yang H, et al. Hypoglycemic and anti depressant effects of Zuogui Jiangtang Jieyu formulation in a model of unpredictable chronic mild stress in rats with diabetes mellitus [J]. Exp Ther Med,2014(8):281-285.
[4]李 静,田 燕,陈红霞,等.小补心汤总黄酮含药血清对皮质酮损伤神经细胞的保护作用[J].军事医学,2011,35(10):765-768.
[5]王宇红.左归降糖解郁方对糖尿病并发抑郁症大鼠血糖血脂的影响[J].中草药,2014,4(11):1 602-1 606.
[6]杨 蕙. 糖尿病并发抑郁症动物模型的建立及中药保护作用[D].长沙:湖南中医药大学,2013.
[7]易 屏. 小檗碱抑制核因子NF-κB p65 表达及转位改善游离脂肪酸诱导的3T3-L1 细胞胰岛素抵抗的分子机制[J].中国中西医结合杂志.2007,27(12):1 099-1 103.

