麻风病患者外周血IL-10与调节性T细胞的相关性研究①
李彩霞 陆 林 周晓鸿 邹子宏 徐元品 王笑彬 丁文立 张晓虹 李晓岚
(昆明医科大学附属延安医院皮肤科,昆明 650051)
麻风病是一种由麻风分枝杆菌引起,可导致毁容、残疾的慢性接触性传染病。该病潜伏期长,被麻风杆菌感染后一般要经过2~7年才会发病,但不是所有感染者都会发展成为麻风病。在与传染性麻风患者同等接触的条件下,只有少数人会发病,这是因为麻风患者存在着不同程度的细胞免疫功能缺陷[1,2],但目前对此机制的研究仍不清楚。研究发现麻风患者外周血CD4+CD25+Foxp3+调节性T细胞(Treg)比正常人明显增高[3,4],而 IL-10 在 Treg 细胞的分化及功能维持等方面起着重要作用,所以我们对麻风患者血清IL-10的浓度进行了检测,并分析它与外周血Treg细胞的关系,以进一步探讨麻风患者免疫功能缺陷的机制。
1 材料与方法
1.1 实验分组 现症麻风患者51例[5],来源于昆明医科大学第二附属医院皮肤科门诊、云南昆明市晋宁县皮肤病防治站、昆明市西山区疾病预防控制中心及昆明市官渡区疾病预防控制中心。其中男38例,女13例,病程2~20个月,平均(31±30.49)个月;治疗时间:1~52个月,平均(19.56±10.16)个月。对照组:56例,为本院健康体检人群,其中男34例,女22例。血清学及肝肾功能检查正常,排除感染结核、麻风、HBV、HCV、肿瘤及患自身免疫系统疾病的人群。
1.2 仪器和试剂 IL-10检测试剂盒、PerCP标记的抗人CD4抗体、FITC标记的抗人CD25抗体、PE标记的抗人 Foxp3抗体、同型对照 FITC-mouse IgG1、PE-mouse IgG1、Human Foxp3 Buffer Set及缓冲液Stain Buffer(FBS)购自美国Becton-Dickinson(B-D)公司。流式细胞仪为Beckman Coulter公司生产的Epics XL型。
1.3 流式细胞微球芯片捕获技术(Cytometric bead array,简称CBA)检测麻风患者和正常对照组血清IL-10的水平。
1.3.1 取被检测者肘静脉血4 ml于普通真空采血管中,室温下静置2 h,3 000 r/min离心10 min后收取上层血清,置于EP管中-20℃冻存,待标本全部收集完毕后统一检测IL-10。
1.3.2 绘制标准曲线 先将试剂盒内的细胞因子标准品按照梯度法稀释为1∶1、1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256 几种浓度,然后加入空白对照管制备标准曲线。
1.3.3 样本制备,获取数据 在12×75 mm FALCON上样管中各加入50 ml捕获微球混悬液,混匀;各管加入50 μl的IL-10 PE信号抗体;各管加入50 μl检测样本;室温避光孵育3 h;各管加入1 ml洗液,1 500 r/min,离心5 min,洗涤1次;各管加入300 μl洗液,重新悬浮微球;上机前充分混匀3~5 s,用流式细胞仪分析样本。使用CellQuest软件获取样本数据,使用BD CBA软件分析结果。
1.4 流式细胞仪检测Treg细胞 取一流式试管,加入 FITC anti-human CD4/PE,anti-human CD25m Ab/AF647,anti-human CD127 各 2 μl,再加 100 μl新鲜肝素抗凝血,混匀,避光孵育20 min,然后加入1 ml溶血素溶血,避光放置5 min,以2 ml 1×PBS洗涤2次,上流式细胞仪进行检测。
1.5 统计学处理 采用SPSS19.0软件包进行统计学分析。经检验,数据满足正态性和方差齐性条件,两组数据比较采用独立样本t检验,数据用表示。两组数据满足线性、等方差性、独立性及正态性条件,采用Pearson相关检验验,P<0.05认为有统计学意义。
2 结果
2.1 麻风患者血清 IL-10浓度(n=30,130.00±54.27)pg/ml比对照组(n=25,15.64 ±7.11)pg/ml高(P<0.05)。见图1。
2.2 麻风患者外周血CD4+CD25+Foxp3+占CD4+T淋巴细胞的比率为(n=51,17.626% ±8.197 7%),比正常对照组(n=56,9.998% ±1.706 2%)高(P<0.05)。
图1 IL-10的标准曲线Fig.1 Standard curve of IL-10
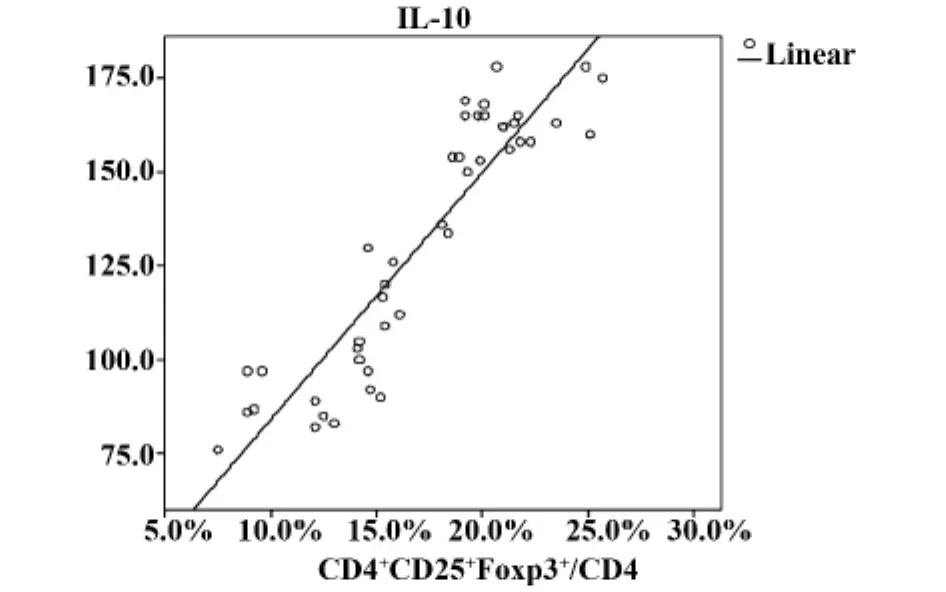
图2 麻风患者血清IL-10浓度与外周血Treg细胞水平的相关性Fig.2 Correlation between IL-10 and Treg cells in leprosy patients
2.3 麻风患者血清IL-10浓度与外周血CD4+CD25+Foxp3+/CD4+细胞水平呈正相关线性关系(r=0.836,F=213.592,P <0.05),见图2。
3 讨论
麻风病是一种与机体免疫功能有关的传染病,其很多损害并不是由麻风杆菌直接引起,而是由该菌所诱发的宿主免疫应答所致[6]。在麻风患者体内,机体的细胞免疫和体液免疫同时起作用,但以细胞免疫为主[7]。机体被麻风杆菌感染后,是否能建立起有效的细胞免疫,涉及到抗原递呈过程中对分枝杆菌的吞噬、抗原传递、T细胞活化、细胞因子产生、最后清除麻风杆菌等一系列的过程[8]。巨噬细胞、T淋巴细胞、树突状细胞、自然杀伤细胞、协同刺激分子、可溶性白细胞介素2受体及肿瘤坏死因子等数量或功能状态的异常也与麻风病发病密切相关[9,10]。
Treg细胞是近年来逐渐被人们所认识的一类具有免疫调节功能的T细胞亚群,主要功能是抑制正常机体中自身反应性T细胞和自身反应性B细胞的活化,具有免疫调节及抑制功能,对维持机体的免疫耐受功能发挥着重要作用。该群细胞可通过分泌免疫下调性细胞因子(如IL-8或IL-10)来发挥抑制T细胞活化、维持免疫耐受以及防止免疫性疾病发生的作用[11]。
白细胞介素10(Interleukin 10,IL-10)是一种具有生物活性的小分子多肽,主要由CD4+Th2辅助性T细胞亚群产生,在免疫系统中具有广泛的生物学活性,不仅可诱导Treg细胞的产生,还参与了Treg细胞的免疫调节作用[12]。另外,IL-10还具有抑制Th1细胞分泌 IL-2、IL-3、干扰素-γ、集落刺激因子和肿瘤坏死因子α的作用[11]。
本研究发现,麻风患者血清IL-10浓度和外周血Treg细胞水平比对照组高,并且两者间呈正相关线性关系。提示机体被麻风杆菌感染后,麻风杆菌刺激T细胞引起Treg细胞扩增,而Treg细胞又可分泌IL-10参与免疫反应。两者相互作用,使机体免疫应答功能受到抑制,麻风杆菌不能被有效清除,最终导致麻风菌大量繁殖,机体患病。
目前关于IL-10与Treg细胞之间如何进行精确调控的机制仍不清楚,充分了解它们在机体免疫应答过程中的作用,将为麻风病的免疫治疗提供新的思路。
[1]Ribeiro-Rodrigues R,Resende Co T,Rojas R et al.A role for CD4+CD25+T cells in regulation of the immune response during human tuberculosis [J].Clin Exp Immunol,2006,144(1):25-34.
[2]Weiss L,Donkova Petrini V,Caccavelli L,et al.Human immunodeficiency virus-driven expansion of CD4+CD25+regulatory T cells,which suppress HIV-specific CD4 T-cell responses in HIV-infected patients[J].Blood ,2004,104(10):3249-3256.
[3]李彩霞,徐元品,邹子宏,等.CD4+CD25+Foxp3+调节性 T细胞在麻风病中的水平和意义[J].中国免疫学杂志,2013,29(1):158-160.
[4]李彩霞,邹子宏,徐元品,等.麻风患者治愈后外周血Th17及Treg细胞的检测[J].中国皮肤性病学杂志,2013,27(3):243-245.
[5]李文忠.现代麻风病学[M].上海:上海科学技术出版社,2006:15.
[6]李桓英.麻风病研究进展[J].中国麻风皮肤病杂志,2006,22(10):648-649.
[7]吴勤学,王洪生.麻风病中的免疫反应[J].中国麻风皮肤病杂,2008,24(4):592-892.
[8]翁小满,胡永秀.麻风病免疫中的树突状细胞与T细胞的相互作用及其研究进展[J].中国麻风皮肤病杂志,2005,21(3):102-302.
[9]Monot M,Honoré N,Garnier T,et al.On the origin of leprosy[J].Science,2005,308(5724):1040-1042.
[10]Scollard DM,AdamsLB,Gillis TP,et al.The continuing challenges of leprosy[J].Clin Microbiol Rev,2006,19(2):338-381.
[11]Liu G,Ma H,Qiu L,et al.Phenotypic and functional switch of macrophages induced by regulatory CD4+CD25+T cells in mice[J].Immunol Cell Biol,2011,89(1):130-142.
[12]Maloy K J,Salaunl,Cahill R,et al.CD4+CD25+T(R)cells suppress innate immune pathology through cytokine-dependent mechanisms[J].J Exp Med,2003,197(1):111-119.

