肿瘤逃避T细胞免疫监视的研究进展①
任一鑫 张嘉宁(大连医科大学生物化学与分子生物学教研室,大连 116044)
免疫监视学说最早是由Ehrlich于1909年提出的,其认为免疫系统的一个关键作用是识别并清除肿瘤,之后又不断有学者(Burnet and Thomas)完善免疫监视学说理论,认为免疫系统能够清除新生的肿瘤病变[1]。而肿瘤能够逃避免疫监视则被视为肿瘤的十大特征之一[2]。尽管免疫监视理论目前仍有争议,T细胞在体内抑制肿瘤发生发展中扮演的重要角色却已得到公认[3,4]。本文将针对T细胞和肿瘤的相互作用做一综述,为理解肿瘤如何逃避T细胞的免疫监视作用提供参考。
1 T细胞在肿瘤免疫监视中的作用
T细胞是通过能够结合抗原肽的T细胞受体(TCR)而被激活的,这些抗原肽也称肿瘤相关抗原(Tumor-associated-antigen,TAA),由主要组织相容性复合物(MHC)分子呈递。MHCⅠ类分子呈递的抗原肽被CD8+T细胞识别,并刺激CD8+T细胞产生肿瘤坏死因子诱导凋亡配体(TNF-related apoptosis inducing ligand,TRAIL)以及穿孔素和颗粒酶杀伤靶细胞。MHCⅡ类分子呈递的抗原肽则被CD4+T细胞识别,在适应性抗肿瘤免疫中也发挥重要作用。CD4+T细胞和CD8+T细胞是最重要的辅助和效应细胞[5]:1型CD4+T细胞(Th1)可通过对CD8+T细胞的辅助作用促进肿瘤组织的破坏,2型CD4+T细胞(Th2)可促进B细胞产生特异性抗体。T细胞的激活还需要辅助分子提供共刺激信号,其中CD28/B7介导的共刺激信号的作用最为主要[6]。活化的CD4+T细胞可通过表达共刺激因子CD40的配体结合树突状细胞(Dendntric cells,DC)表面的CD40提高DC诱导CTL的能力,还可通过分泌白细胞介素2(IL-2)促进CTL的增殖。CTL可迁移至肿瘤微环境,并表达Fas配体(FasL),通过与Fas结合,启动Fas信号途径,导致靶细胞凋亡[7]。此外,能够产生γ干扰素(IFN-γ)的CD4+T细胞和CD8+T细胞被普遍认为在抑制和杀伤肿瘤细胞的过程中具有重要作用[8],活化的CD4+T细胞可通过增加IFN-γ的分泌显著提高天然免疫的细胞组分,如巨噬细胞和自然杀伤(NK)细胞,增加的IFN-γ水平又可提高CD8+T细胞识别高表达MHCⅠ类分子的能力。但是,并非所有的T细胞都具有抗肿瘤效应,如同时表达CD25和转录因子Foxp3的CD4+T细胞(CD4+CD25+Foxp3+),即调节性T细胞(Treg)就被认为具有促进肿瘤生长的作用[9]。
2 肿瘤逃避T细胞免疫监视的机制
2.1 T细胞免疫耐受和识别障碍 T细胞的免疫耐受包括中枢免疫耐受和外周免疫耐受。中枢免疫耐受是指在胸腺发育的过程中消除了对MHC/自身抗原肽复合物具有高亲和力的T细胞,而肿瘤的TAA与这些自身抗原肽是一致的,因此不能被T细胞受体识别和结合。外周免疫耐受是指正常情况下T细胞对自身抗原肽的无能状态,这些无能T细胞需要被抗原呈递细胞(Antigen presenting cell,APC),主要是DC通过交叉致敏激活[10]。在这个过程中,DC首先要通过Toll样受体(Toll-like receptors,TLR)或维甲酸诱导基因1(RIG-1)家族感受源自细菌、病毒等微生物的危险信号分子,称为病原相关分子模式(Pathogen-associated molecular patterns,PAMP),如脂多糖,富含 CpG 的 DNA,病毒RNA等,然后上调CD80和CD86等共刺激分子,与活化的CD4+T细胞共同激活CTL。同时,死亡的肿瘤细胞也会释放一些危险信号,如钙网蛋白、高迁移率族蛋白1(HMGB1),损失相关分子模式(Damage-associated molecular pattern,DAMP)信号通过TLR共同传递给DC,继而打破T细胞的外周免疫耐受[11]。然而,未被PAMP和DAMP激活的DC也能够呈递自身抗原和MHC复合物,但不能提供足以激活T细胞的共刺激分子,识别了自身抗原和MHC复合物的T细胞还是处于无能状态的,最终这些T细胞在被称作交叉耐受的过程中走向凋亡。
肿瘤细胞逃避CTL识别的主要机制包括MHCⅠ类分子的下调或完全缺失,这种下调和缺失现象在多种人源和鼠源肿瘤中被频繁地观察到[12],如头颈鳞癌、食管鳞癌、肺癌和前列腺癌等。造成这种现象的原因包括:染色体6p21上与杂合性缺失相关的MHC基因点突变和大片段缺失[13];特异性转录因子的缺失和表观遗传学改变,如DNA高度甲基化干扰转录水平调控导致MHCⅠ类分子的表达减少;变异的β2-微球蛋白严重地破坏MHCⅠ类分子向细胞表面转运。MHCⅠ类分子的装配和向细胞膜的转运依赖于抗原加工呈递(AMP),AMP包括蛋白酶体亚基低分子量多肽2(LMP2)和低分子量多肽7(LMP7)、抗原处理相关转运蛋白(TAP)1和2以及一些分子伴侣如tapsin的作用[14],而启动子甲基化是阻碍tapsin、TAP1和TAP2表达的原因。IFN-γ在AMP中也起重要作用,特别是针对一个TAP1和LMP2基因共用的 IFN-γ依赖的双向启动子,在IFN-γ存在时,干扰素调节因子1(IRF-1)作为转录因子与TAP1/LMP2启动子内的干扰素调节元件(IRF-E)结合,增强TAP1和 LMP2的表达。表观遗传的改变使IRF-1的转录激活功能受到抑制,IFN-γ无反应性,继而MHCⅠ类分子低表达[15]。
2.2 T细胞的无应答状态 T细胞的无应答状态与细胞毒性T淋巴细胞抗原4(CTLA-4/CD152)和程序性死亡受体1(PD1/CD279)密切相关,这些抑制性受体在T细胞活化的过程中是上调的,并且能够与既表达于DC表面同时也表达在肿瘤表面的B7家族分子相互作用[16]。CTLA-4、PD1和 B细胞与T细胞衰减因子(BTLA)能够提供T细胞抑制信号,这些抑制信号能够导致TCR介导的信号衰减,减弱细胞增殖、细胞因子分泌及细胞周期进程[17]。IFN-γ可上调 PD1,PD1再与表达于卵巢癌、食管癌、尿路上皮癌等多种肿瘤细胞的B7家族成员B7-H1相互作用,并与这些肿瘤患者预后不良密切相关。CTLA-4通过介导对APC表面的CD80(B7.1)和CD86(B7.2)的反式内吞作用阻止CD80和CD86与共刺激分子B7的受体CD28的结合[18]。CTLA-4也能够与CD80和CD86竞争,结合CD28并激活蛋白磷酸酶2A(PP2A)[19]。PP2A使蛋白激酶B(Akt)脱磷酸化并拮抗了TCR/CD28信号通路,导致IL-2分泌减少和细胞周期停滞。
T细胞的无应答状态还可由瘤内高水平的转化生长因子-β(TGF-β)引起[20]。TGF-β 可抑制 T 细胞的增殖、分化和活化。TGF-β介导的T细胞抑制可能是由于TCR组分的mRNA水平下降和T细胞激酶、ZAP70及CD3-zeta等信号分子的水平降低而导致细胞信号转导不足[21]。此外,TGF-β还可通过抑制穿孔素、颗粒酶A和B、FasL以及IFN-γ等细胞毒性介质编码基因的转录阻止CTL的细胞毒作用[22]。前列腺素E2(PGE2)也可诱导T细胞无应答,环氧化酶COX-2的同工酶在多种肿瘤中过表达并产生与肿瘤发生相关的PGE2,PGE2可影响细胞凋亡,血管再生和迁移[23]。
半乳糖凝集素(Galectin/Gal),主要是 Gal-1、Gal-3和Gal-9也可参与肿瘤的免疫逃避[24],Galectin与β半乳糖苷有高度的亲和力,可以影响多种细胞功能,如黏附、迁移、趋化、增殖、凋亡和分化等。Galectin在黑色素瘤、胶质母细胞瘤、前列腺癌、膀胱癌、卵巢癌及乳腺癌中的过表达被证明与这些肿瘤的侵袭相关,并被认为是天然的免疫抑制蛋白,尤其是Galectin-1在诱导T细胞凋亡中起重要作用,其可能的机制是Galectin-1能够干扰TCR复合物在脂筏上的正确装配[25]。
2.3 肿瘤细胞抵抗T细胞杀伤 T细胞杀伤靶细胞(被病毒感染的细胞或恶性肿瘤细胞)一般被认为是通过钙依赖的穿孔素/颗粒酶途径或非钙依赖的死亡受体途径。体内和体外实验已经证明肿瘤细胞可以通过表达丝氨酸蛋白激酶抑制剂PI-9/SPI-6,干扰穿孔素/颗粒酶途径抵抗CTL的杀伤[26]。
肿瘤细胞上的死亡受体如CD95(Fas)、TRAIL受体1和2可以与它们的天然配体CD95L、TRAIL结合形成死亡诱导信号复合物,以诱导肿瘤细胞凋亡。但这种凋亡过程可被肿瘤细胞阻止:黑色素瘤表达高水平的抗凋亡调节因子FLICE被证明与抵抗由TRAIL介导的凋亡相关[27],肿瘤细胞还可通过灭活或下调死亡受体抵抗凋亡,p53功能缺失或癌基因ras对CD95的影响可发生于转录水平,造成CD95的缺失,在结肠癌中也可观察到CD95的减少。不仅是转录水平,基因突变和缺失也可导致CD95和TRAIL受体的功能丧失,如CD95、TRAILR1和R2的胞质信号域缺乏被发现于多发性骨髓瘤、成人T细胞白血病、胃癌和乳腺癌。
肿瘤细胞还可表达诱饵受体(DcR),这些诱饵受体与配体结合,竞争性抑制死亡受体信号途径。CTL上的配体CD95L和TRAIL可分别与多种恶性肿瘤的诱饵受体sCD95、肺癌、结肠癌和胶质母细胞瘤的DcR-3、原发性胃肠癌的TRAIL-R3(DcR-1)、结肠癌的TRAIL-R4(DcR-2)、乳腺癌和前列腺癌的TRAIL-R5结合。
2.4 肿瘤细胞反攻 T细胞的一种特殊死亡方式称为激活诱导细胞死亡(AICD),是指已激活的T细胞的凋亡。肿瘤源外体(TEXs)可下调初始激活T细胞 CD3ζ和 JAK3的表达并介导 CD8+T细胞Fas/FasL途径凋亡[28]。活化的T细胞可以表达水平上调的、在AICD中起重要作用的死亡受体CD95(Fas),当缺乏共刺激信号时,T细胞可表达大量FasL,这就诱导了T细胞自身的凋亡。而且,一些肿瘤如黑色素瘤、肺癌、胰腺癌和乳腺癌等也可表达FasL[29],这就加速了AICD并且有助于肿瘤攻击T细胞。除FasL介导的T细胞凋亡外,还有研究发现肝细胞癌可表达诱导Jurkat白血病细胞株的T细胞死亡的TRAIL。
另一个肿瘤细胞反攻的机制是肿瘤细胞可表达吲哚胺2,3-双加氧酶(IDO)。最初,IDO被认为在防御细菌感染中起作用,但很快就被证明其在建立胎盘免疫屏障,保护胚胎阻止母体T细胞攻击中发挥重要作用[30]。迄今为止,IDO已经被发现表达在一些原发性肿瘤如胃癌、结肠癌、肾细胞癌和一些肿瘤细胞系中。而且有证据证明,经IDO处理的CD8+T细胞缺乏产生穿孔素、颗粒酶A和B的功能,并且可选择性抑制CD8+T细胞线粒体中的呼吸链复合物[31]。
2.5 调节性T细胞和髓源抑制性细胞的抑制免疫作用 在外周T细胞中,有占其总数5%~10%的CD4+T细胞可以表达IL-2受体α链,即白细胞表面标志物CD25,这些特殊的CD4+T细胞能够抑制肿瘤特异性CD4+T细胞和CTL的抗肿瘤作用[32],被定名为调节性T细胞(Treg)。Treg最广泛应用的细胞标志物为CD25、转录因子Foxp3、CTLA-4、淋巴细胞激活基因-3(LAG-3)糖皮质激素诱导的肿瘤坏死因子受体(GITR)[33]。Treg以抑制其他T细胞亚群的活性为特征,无论在患者的血液中还是在肿瘤部位,大量的Treg被发现于头颈癌、肺癌、胰腺癌、乳腺癌、肝癌、卵巢癌和胃肠癌,而且在肿瘤部位出现的Treg往往与患者预后不良有关。Treg聚集到肿瘤部位的机制还不十分清楚,这可能归因于肿瘤细胞或癌间质浸润巨噬细胞分泌的趋化因子CCL22对Treg的趋化作用[34],也可能由于肿瘤抑制免疫的微环境中高浓度的TGF-β诱导浸润到肿瘤部位的 CD4+T 细胞成为 Foxp3+的 Treg[35]。另外,肿瘤局部的树突状细胞不仅能诱生Treg,而且对胸腺来源的天然Treg还具有扩增作用。Treg可分泌多种免疫抑制因子,主要包括IL-10和TGF-β,并通过IL-10依赖的方式抑制效应细胞的功能[36],在动物肿瘤模型实验中,也证明了肿瘤局部Treg分泌的IL-10能够显著抑制机体的抗肿瘤免疫功能。在头颈鳞癌[37]和淋巴瘤[38]中均发现肿瘤局部Treg分泌的TGF-β可显著抑制肿瘤效应性T细胞的活性。由于Treg和效应性T细胞的生长均需要大量的IL-2维持,Treg与效应性T细胞竞争并消耗IL-2,导致效应性T细胞的IL-2缺乏而抑制其生长甚至凋亡[39]。天然Treg还可将组织产生的第二信使cAMP通过间隙连接(Gap junction)转运至效应性T细胞中,而cAMP又可强烈抑制效应性T细胞合成供其生长的IL-2[40]。研究表明,Foxp3+的 Treg 可同时表达CD39和CD73,CD39是一种外核苷酸酶,能使ATP脱磷酸化,还原成ADP和AMP,而达到免疫抑制作用;而CD73能进一步水解AMP成为腺苷,腺苷是一种免疫抑制分子,对多种免疫效应细胞都具有抑制作用。腺苷可抑制IL-2分泌与CD25的表达,从而抑制淋巴细胞的增殖。
另一种抑制肿瘤免疫的细胞是髓源抑制性细胞(MDSC)。MDSC在各种肿瘤源性细胞因子的作用下生成,如在肿瘤部位和外周血出现的MDSC可能与肿瘤细胞产生的粒细胞巨噬细胞集落刺激因子(GM-CSF)水平增高有关。MDSC在不同的分化阶段成为不同的髓样异质细胞群,具有抑制免疫的功能。MDSC在人类组织中一般被描述为 CD14-CD11b+的细胞群,或表达髓系标志物CD33,但缺乏成熟髓系标志物 HLA-DR[41],近年来,几种其他的表面分子,如CD80、CD115及CD124也被用来识别抑制性MDSC[42]。MDSC抑制抗肿瘤免疫的作用以抑制T细胞为主,在肿瘤晚期阶段,外周血MDSC被证明能够抑制 T细胞产生 IFN-γ[43],MDSC 可表达高水平的精氨酸酶1(ARG1)和诱导型一氧化氮合酶(iNOS),消耗肿瘤微环境中的L-精氨酸(L-Arg)。L-Arg的缺乏可抑制T细胞增殖和活化,如下调T细胞 CD3ζ的表达[44],阻碍T细胞表达细胞周期调节因子D3和细胞周期依赖激酶4(CDK4)[45];一氧化氮可抑制T细胞的Janus激酶3(JAK3)、信号转导和转录激活因子5(STAT5)以及MHCⅡ类分子的表达,并诱导T细胞凋亡[42]。另一个重要的有助于MDSC抑制活性的物质是活性氧(ROS)。大量研究表明,荷瘤小鼠和肿瘤患者MDSC的ROS上调是其重要特征,抑制MDSC产生ROS可显著降低其抑制活性。除精氨酸外,半胱氨酸也是T细胞活化的必需氨基酸,而T细胞与MDSC自身都不能合成半胱氨酸,均需要利用微环境中的半胱氨酸或胱氨酸,故MDSC与T细胞竞争半胱氨酸可干扰其活化[46]。
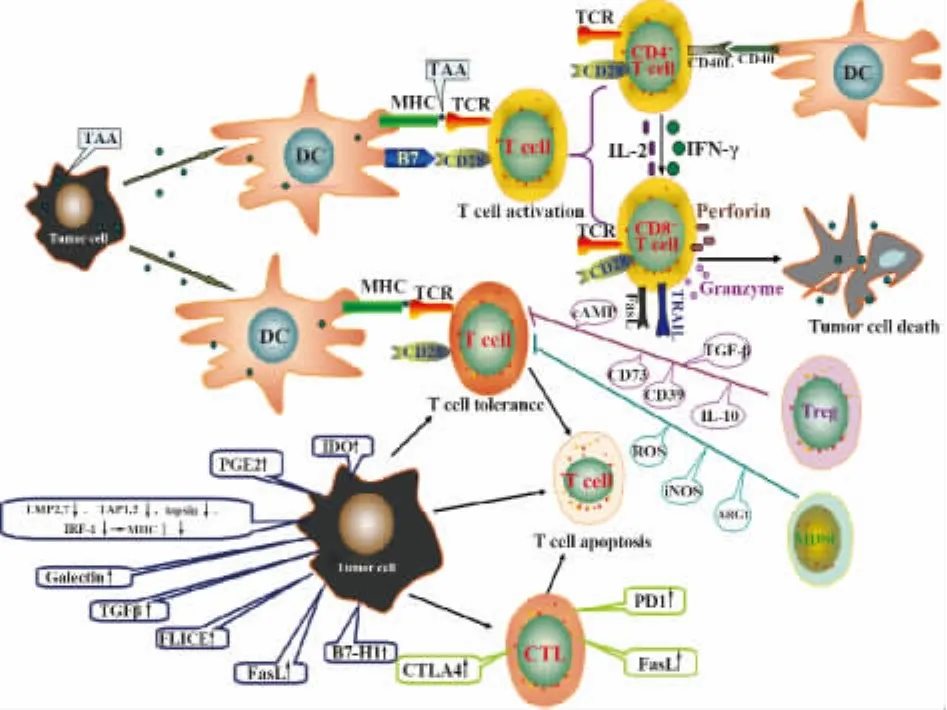
图1 T细胞与肿瘤的免疫关系Fig.1 Immunologicalrelationship between T cell and tumor
3 结语
随着对T细胞和肿瘤相互作用研究的深入,人们更清晰地认识到肿瘤的发生发展与其逃避免疫监视、对抗T细胞的抗肿瘤作用密切相关。了解T细胞与肿瘤的免疫关系(图1),有助于开展肿瘤抗原肽疫苗的研发和启动肿瘤特异性T细胞免疫的研究,为抗肿瘤免疫治疗提供参考,给肿瘤患者带来福音。
[1]Melanie R,Rutkowski,Tom L,et al.Anti-tumor immunity:Myeloid leukocytes control the immune landscape [J].Cell Immunol,2012,278:21-26.
[2]Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[3]Licia Rivoltini,Matteo Carrabba,Veronica Huber,et al.Immunity to cancer:attack and escape in T lymphocyte-tumor cell interaction[J].Immunol Rev,2002,188:97-113.
[4]Alan G.Ramsay.Immune checkpoint blockade immunotherapy to activate anti-tumour T-cell immunity[J].Br J Haematol,2013,162(3):313-325.
[5]Ostrand-Rosenberg S.Immune surveillance:a balance between protumor and antitumor immunity[J].Curr Opin Genet Dev,2008,18(1):11-18.
[6]Paulos CM,June CH.Putting the brakes on BTLA in T cell-mediated cancer immunotherapy[J].J Clin Invest,2010,120(1):76-80.
[7]Barry M,Bleackley RC.Cytotoxic T lymphocytes:all roads lead to death[J].Nat Rev Immunol,2002,2(6):401-409.
[8]Zamarron BF,Chen W.Dual roles of immune cells and their factors in cancer development and progression[J].Int J Biol Sci,2011,7(5):651-658.
[9]Curiel TJ,Coukos G,Zou L,et al.Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival[J].Nat Med,2004,10(9):942-949.
[10]Kurts C,Robinson BW,Knolle PA.Cross-priming in health and disease[J].Nat Rev Immunol,2010,10:403-414.
[11]Scaffidi P,Misteli T,Bianchi ME.Release of chromatin protein HMGB1 by necrotic cells triggers in flammation[J].Nature,2002,418:191-195.
[12]Seliger B,Kiessling R.The two sides of HER2/neu:immune escape versus surveillance[J].Trends Mol Med,2013,19(11):677-684.
[13]Maleno I,Romero JM,Cabrera T,et al.LOH at 6p21.3 region and HLA class altered phenotypes in bladder carcinomas[J].Immunogenetics,2006,58(7):503-510.
[14]Koch J,Tamp'e R.The macromolecular peptide-loading complex in MHC class I-dependent antigen presentation [J].Cell Mol Life Sci,2006,63(6):653-662.
[15]Rodríquez T,Méndez R,DelCampo A,et al.Distinct mechanisms of loss of IFN-gamma mediated HLA class I inducibility in two melanoma cell lines[J].BMC Cancer,2007,7:34.
[16]Zou W,Chen L.Inhibitory B7-family molecules in the tumour microenvironment[J].Nature Reviews Immunology,2008,8(6):467-477.
[17]Wu YL,Liang J,Zhang W,Tanaka Y,Sugiyama H.Immunotherapies:the blockade of inhibitory signals[J].Int J Biol Sci,2012,8(10):1420-1430.
[18]Qureshi OS,Zheng Y,Nakamura K,et al.Trans-endocytosis of CD80 and CD86:a molecular basis for the cell-extrinsic function of CTLA-4[J].Science,2011,332(6029):600-603.
[19]Collins AV,Brodie DW,Gilbert RJ,et al.The interaction properties of costimulatory molecules revisited[J].Immunity,2002,17(2):201-210.
[20]Connolly EC,Freimuth J,Akhurst RJ.Complexities of TGF-β targeted cancer therapy[J].Int J Biol Sci,2012,8(7):964-978.
[21]di Bari MG,Lutsiak ME,Takai S,et al.TGF-beta modulates the functionality of tumor-infiltrating CD8+T cells through effects on TCR signaling and Spred1 expression[J].Cancer Immunology,Immunotherapy,2009,58(11):1809-1818.
[22]Thomas DA,Massague J.TGF-β directly targets cytotoxic T cell functions during tumor evasion of immune surveillance [J].Cancer Cell,2005,8(5):369-380.
[23]Greenhough A,Smartt HJM,Moore AE,et al.The COX-2/PGE2 pathway:key roles in the hallmarks of cancer and adaptation to the tumour microenvironment[J].Carcinogenesis,2009,30(3):377-386.
[24]Cedeno-Laurent F,Dimitroff CJ.Galectins and their ligands:nega-tive regulators of anti-tumor immunity[J].Glycoconj J,2012,29(8-9):619-625.
[25]Chung CD,Patel VP,Moran M,et al.Galectin-1 induces partial TCRζ-chain phosphorylation and antagonizes processive TCR signal transduction[J].J Immunol,2000,165(7):3722-3729.
[26]Medema JP,de Jong J,Peltenburg LTC,et al.Blockade of the granzymeB/perforin pathway through overexpression of the serine protease inhibitor PI-9/SPI-6 constitutes a mechanism for immune escape by tumors[J].Proc Natl Acad Sci USA,2001,98(20):11515-11520.
[27]Griffith TS,Chin WA,Jackson GC,et al.Intracellular regulation of TRAIL-induced apoptosis in human melanoma cells[J].J Immunol,1998,161(6):2833-2840.
[28]Whiteside TL.Immune modulation of T-cell and NK(natural killer)cell activities by TEXs(tumour-derived exosomes)[J].Biochem Soc Trans,2013,41(1):245-251.
[29]Bernstorff WV,Glickman JN,Odze RD,et al.Fas(CD95/APO-1)and Fas ligand expression in normal pancreas and pancreatic tumors:implications for immune privilege and immune escape[J].Cancer,2002,94(10):2552-2560.
[30]Munn DH,Zhou M,Attwood JT,et al.Prevention of allogeneic fetal rejection by tryptophan catabolism[J].Science,1998,281(5380):1191-1193.
[31]Liu H,Liu L,Liu K,et al.Reduced cytotoxic function of effector CD8+T cells is responsible for indoleamine 2,3-dioxygenase-dependent immune suppression[J].J Immunol,2009,183(2):1022-1031.
[32]Sakaguchi S,Ono M,Setoguchi R,et al.Foxp3+CD25+CD4+natural regulatory T cells in dominant self-tolerance and autoimmune disease[J].Immunological Reviews,2006,212:8-27.
[33]Corthay A.How do regulatory T cells work? [J].Scand J Immunol,2009,70(4):326-336.
[34]Ishida T,Ishii T,Inagaki A,et al.Specic recruitment of CC chemokine receptor 4-positive regulatory T cells in Hodgkin lymphoma fosters immune privilege[J].Cancer Res,2006,66(11):5716-5722.
[35]Walker MR,Kasprowicz DJ,Gersuk VH,et al.Induction of Foxp3 and acquisition of T regulatory activity by stimulated human CD4+CD25-T cells[J].J Clin Invest,2003,112(9):1437-1443.
[36]Huang YH,Zozulya AL,Weidenfeller C,et al.T cell suppression by naturally occurring HLA-G-expressing regulatory CD4+T cells is IL-10-dependent and reversible[J].J Leukoc Biol,2009,86(2):273-281.
[37]Strauss L,Bergmann C,Szczepanski M,et al.A unique subset of CD4+CD25highFoxp3+T cells secreting interleukin-10 and transforming growth factor-beta1 mediates suppression in the tumor microenvironment[J].Clin Cancer Res,2007,13(15 Pt1):4345-4354.
[38]Hilchey SP,De A,Rimsza LM,et al.Follicular lymphoma intratumoral CD4+CD25+GITR+regulatory T cells potently suppress CD3/CD28-costimulated autologous and allogeneic CD8+CD25-and CD4+CD25-T cells[J].J Immunol,2007,178(7):4051-4061.
[39]Pandiyan P,Zheng L,Ishihara S,et al.CD4+CD25+Foxp3+regulatory T cells induce cytokine deprivation-mediated apoptosis of effector CD4+T cells[J].Nat Immunol,2007,8(12):1353-1362.
[40]Bopp T,Becker C,Klein M,et al.Cyclic adenosine monoph-osphate is a key component of regulatory T cell-mediated suppression[J].J Exp Med,2007,204(6):1303-1310.
[41]Ko JS,Bukowski RM,Fincke JH.Myeloid-derived suppressor cells:a novel therapeutic target[J].Curr Oncol Rep,2009,11(2):87-93.
[42]Gabrilovich DI,Nagaraj S.Myeloid-derived suppressor cells as regulators of the immune system[J].Nat Rev Immunol,2009,9(3):162-174.
[43]Schmielau J,Finn OJ.Activated granulocytes and granulocyte-derived hydrogen peroxide are the underlying mechanism of suppression of T-cell function in advanced cancer patients[J].Cancer Res,2001,61(12):4756-4760.
[44]Rodriguez PC,Zea AH,Culotta KS,et al.Regulation of T cell receptor CD3zeta chain expression by L-arginine[J].J Biol Chem,2002,277:21123-21129.
[45]Rodriguez PC,Quiceno DG,Ochoa AC.L-arginine availability regulates T-lymphocyte cell-cycle progression[J].Blood,2007,109:1568-1573.
[46]Srivastava MK,Sinha P,Clements VK,et al.Myeloid-derived suppressor cells inhibit T-cell activation by depleting cystine and cysteine[J].Cancer Res,2010,70(1):68-77.

