胰岛素面部注射对大鼠面神经挤压伤的效果
张玉花,王华明,尹洁,景玉宏
面神经损伤是临床常见病和多发病。面神经损伤后的修复受制于复杂的外部环境及损伤程度[1],神经修复过程也是面神经和所支配的面肌建立突触联系的过程[2],骨骼肌的功能状态可以反向影响其支配的神经[3]。有研究显示,失去神经支配后,骨骼肌葡萄糖转运体蛋白4(glucose transporter 4,GLUT4)的表达减少,骨骼肌GLUT4的表达、转位及细胞膜组装依赖于胰岛素信号[4]。我们于损伤面神经支配的骨骼肌周围注射低剂量胰岛素,观察其对损伤面神经的反向影响效应,并探讨其可能的机制。
1 材料和方法
1.1 实验动物及造模
雄性Sprague-Dawley大鼠30只,体质量250~300 g,由兰州大学基础医学院动物中心提供。自由摄食、饮水,12 h光照周期,恒湿恒温饲养。
10%水合氯醛360 mg/kg腹腔注射麻醉。无菌条件下暴露左侧茎乳孔外面神经主干,出茎乳孔3 mm处用蚊式止血钳钳夹面神经干,长约2 mm,力量为2扣,持续15 s。手术显微镜下观察挤压部位呈透明薄膜结构。损伤完成后3-0丝线缝合皮下组织及皮肤,再次消毒后缝线固定。
1.2 神经功能评分标准
术后第1天开始,连续7 d,每天进行神经功能评分。①眨眼反射:5 ml注射器距离鼠眼3 cm,瞬间推内芯吹风2 ml,比较双侧眨眼反射的速度和幅度。双侧正常且对称为0分;减弱或延缓为1分;消失为2分。②触须运动:刺激方法同眨眼反射,比较双侧触须拂动的程度。双侧拂动正常且对称为0分;触须拂动减弱为1分;消失为2分。③鼻尖偏向:观察鼻尖是否偏向健侧。鼻尖居中为0分;偏向健侧为1分。
1.3 分组及处理
经神经功能评分,20只评分为5分的大鼠纳入实验。依据大鼠编号随机分为治疗组和对照组各10只。实验过程中,2只大鼠因感染被排除。组间平衡后,各组实际统计8只。
治疗组局部给予胰岛素注射:围绕损伤侧眼轮匝肌和口轮匝肌取四等分点,微量注射器4点肌内等量注射,共250 ng/kg,每天2次,连续7 d。对照组同法注射等量生理盐水。注射前、注射后40 min自鼠尾采血,检测酶底物法血糖水平。
1.4 荧光金逆行标记
术后第5天,大鼠双侧耳前切口,于双侧面神经颊支注射1%的荧光金(Fluorogold,FG)各2μl,10 min内注射完毕。
术后第7天,大鼠灌注、固定、取脑干,冰冻切片,片厚25μm,冷冻保护液中放置,-20℃保存备用。参照大鼠脑图,选取距前囟-10.56 mm、-10.71 mm、-10.86 mm、-11.01 mm的冠状切片共4张,裱贴于1%多聚赖氨酸处理的载玻片上,50%甘油封片,荧光显微镜紫外激发光观察,拍照。200×视野下对双侧面神经核内阳性细胞计数,4张切片取均值。
1.5 统计学分析
2 结果
2.1 血糖
注射前后两组间血糖水平无显著性差异(P>0.05)。见表1。

表1 局部胰岛素注射对血糖水平的影响(mmol/L)
2.2 神经功能评分
术后1~4 d,两组大鼠评分无显著性差异(P>0.05);术后5~7 d,治疗组各时间点评分均低于对照组(P<0.05)。见表2。
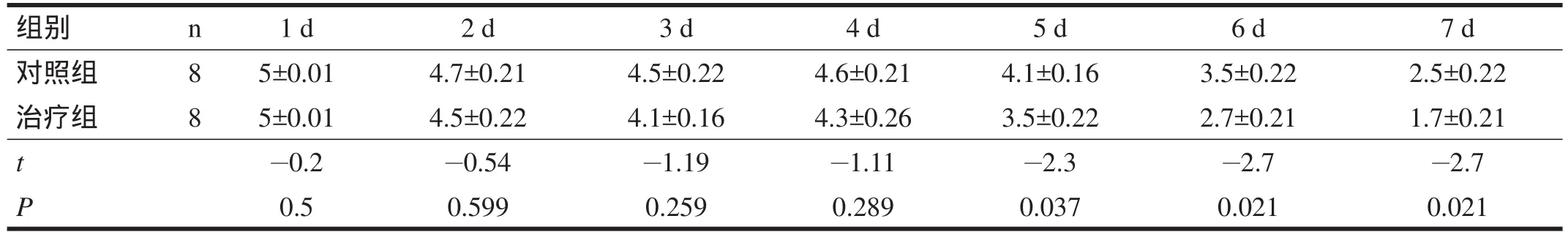
表2 术后两组神经功能评分比较
2.3 荧光金逆行标记
损伤对侧面神经核可见广泛神经细胞被荧光金标记,两组间无显著性差异(P>0.05)。损伤侧荧光金标记的细胞数量减少,治疗组荧光金标记细胞数明显多于对照组(P<0.01)。见表3。

表3 各组损伤同侧及对侧荧光金阳性细胞计数
3 讨论
功能锻炼能促进面神经损伤后的功能恢复;针刺、按摩、局部理疗也能促进面神经损伤后的功能恢复[5]。其他治疗方法在不同个体间,治疗效果有较大差异[6]。
功能锻炼对神经功能的改善作用,与神经纤维支配区微环境的改善有关[7-8]。有研究显示,正中神经损伤后,局部给予胰岛素注射,能够改善神经功能[9]。我们的研究显示,面神经挤压伤后,局部给予胰岛素注射,能够改善大鼠神经功能评分,增强神经纤维的逆行轴浆转运能力,提示胰岛素治疗能够促进神经纤维出芽及与靶器官建立突触联系。
胰岛素面部注射对面神经挤压伤的改善作用是因为其神经营养作用,还是依赖于对骨骼肌葡萄糖利用的促进,还无法完全区分。有报道显示,周围神经上也有胰岛素受体分布[10],但骨骼肌胰岛素受体密度更高;因此局部胰岛素主要与骨骼肌胰岛素受体结合,启动下游信号,尤其促使GLUT4的细胞膜转位和组装,从而促进骨骼肌葡萄糖的利用,具有更多的专一性[11]。失去神经支配的骨骼肌葡萄糖转运及利用下降,而胰岛素则可以通过促进骨骼肌GLUT4的表达和转位,维持神经损伤后骨骼肌细胞的代谢水平。我们推测,局部注射胰岛素对神经损伤的改善作用,至少部分是通过骨骼肌实现的。
我们的实验尚不能证明局部给予外源性的胰岛素注射后骨骼肌及神经纤维结构方面的变化。进一步研究需要揭示局部胰岛素治疗对于失神经支配骨骼肌的GLUT4的表达和转位、骨骼肌营养因子的分泌、损伤神经纤维结构的变化等有何影响,从而探明胰岛素治疗促进神经功能恢复的途径和机制。
[1]Garcia N,Tomàs M,Santafe MM,et al.Localization of brain-derived neurotrophicfactor,neurotrophin-4,tropomyosin-related kinase b receptor,and p75NTRreceptor by high-resolution immunohistochemistry on the adult mouseneuromuscular junction[J].JPeripher Nerv Syst,2010,15(1):40-49.
[2]景孝堂,范文红,王子仁,等.神经肌肉连接形成研究进展[J].国外医学生理病理科学与临床分册,2004,24(4):340-342.
[3]Tsunoda N,Maruyama K,Cooke DW,et al.Localization of exercise-and denervation-responsive elements in the mouse GLUT4 gene[J].Biochem Biophys Res Commun,2000,267(3):744-751.
[4]Huang S,Czech MP.The GLUT4 glucose transporter[J].Cell Metab,2007,5(4):237-252.
[5]Hoang NS,Sar C,Valmier J,et al.Electro-acupuncture on functional peripheral nerve regeneration in mice:a behavioural study[J].BMCComplement Altern Med,2012,12:141.
[6]Maier W,Grauvogel TD,Laszig R,et al.Value of different strategiesin the treatment of vestibular Schwannoma:therapeutic aspects and literature analysis[J].HNO,2011,59(5):425-436.
[7]Machaliński B,Lażewski-Banaszak P,Dąbkowska E,et al.The role of neurotrophic factors in regeneration of the nervous system[J].Neurol Neurochir Pol,2012,46(6):579-590.
[8]Tam SL,Gordon T.Mechanisms controlling axonal sprouting at the neuromuscular junction[J].JNeurocytol,2003,32(5-8):961-974.
[9]Ozkula Y,Sabuncub T,Yazgan P,et al.Local insulin injection improves median nerve regeneration in NIDDM patients with carpal tunnel syndrome[J].Eur JNeurol,2001,8(4):329-334.
[10]Ogata T,Yamamoto S,Nakamura K,et al.Signaling axis in Schwann cell proliferation and differentiation[J].Mol Neurobiol,2006,33(1):51-62.
[11]Leto D,Saltiel AR.Regulation of glucose transport by insulin:traffic control of GLUT4[J].Nat Rev Mol Cell Biol,2012,13(6):383-396.

