美国和加拿大药品专利链接体系要素的选择及其对中国的启示
刘立春,朱雪忠
(1.华中科技大学知识产权战略研究院,湖北 武汉 430074;2.同济大学知识产权学院,上海 200092)
药品专利链接简称专利链接,是在药品注册 审批过程中,考察待审批仿制药与已批准新药的有效专利之间关系的程序[1]。完善的专利链接体系能够预防药品专利侵权和提高药品注册审批质量[2]。
近年来,我国药品专利链接制度的建设引起了学术界的重视,学者从国外专利链接制度介绍[3-4]、中外专利链接制度对比[5]、我国制度完善措施等方面进行了研究[6-7]。然而这些研究大多集中在宏观层面,很少涉及具体的要素以及实际操作模式的研究。本文在现有宏观制度研究基础上,归纳出我国药品专利链接体系在实际运行中的不足,参照发达国家专利链接运行机制的原理并结合我国国情,在操作层面提出具体的完善建议。
1 药品专利链接国外发展状况
药品专利链接体系主要针对进入链接程序药品的种类、登记专利的类型、职能部门间的相互协同等进行设计。国情的差异使得各国专利链接体系的结构不尽相同,美国和加拿大的专利链接体系具有很强的代表性,对于我国的专利链接体系的构建具有一定的借鉴意义。
1.1 美国
美国是药品专利链接制度创始者,通过Hatch-Waxman法案,美国已建立了一套较为完整的药品专利链接体系(见图1)。
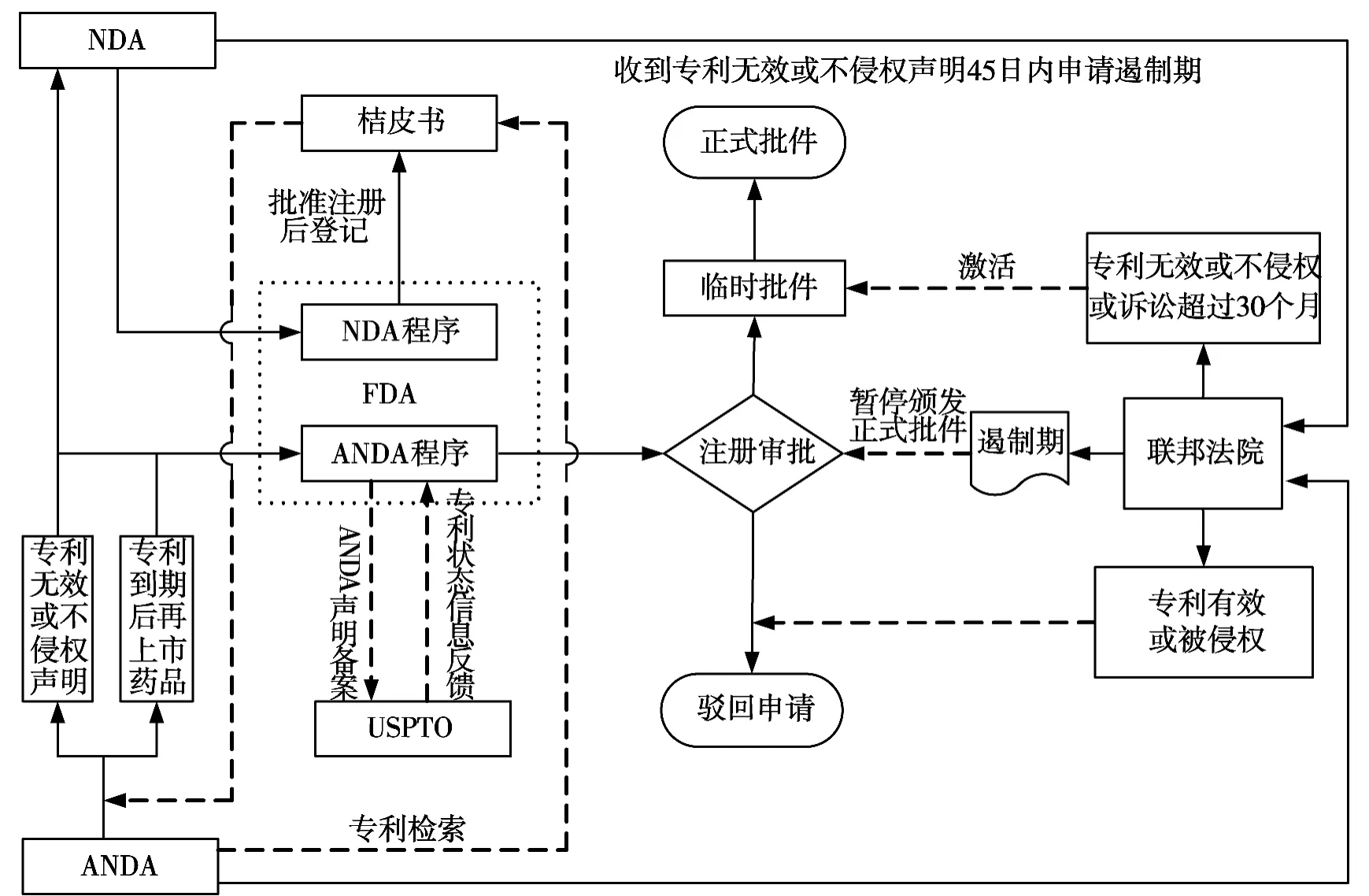
图1 美国药品专利链接体系
(1)FDA内部的专利链接。
在美国,新药申请人在提交新药申请(New Drug Application,NDA)时,需向食品药品监督管理局(FDA)提交与该新药活性成分直接相关的产品专利和方法专利。在NDA被批准的同时,FDA会将所有与NDA同时提交的有效专利的信息录入到《经治疗等同性评价批准的药品》,又称为橘皮书(Orange Book),录入橘皮书的专利称为登记专利。
利用已注册药品临床试验数据的仿制药需要通过简化新药申请(Abbreviated New Drug Application,ANDA)进入FDA的注册审批程序。FDA要求申请人在提交ANDA时,必须就申报的仿制药涉及的每个登记专利至少做出以下一条声明:专利不存在、专利已到期、存在有效专利但在专利到期后上市、专利无效或不侵权。登记专利能够使FDA迅速地评估出ANDA的专利状态,未进入橘皮书的专利不能阻止FDA批准侵权的ANDA[8]。
(2)FDA与美国专利商标局(USPTO)的专利链接。
FDA在受理ANDA时,会将ANDA申请人提交的涉及登记专利的信息报送USPTO备案,并得到USPTO关于该药品专利状态的信息反馈,以此作为FDA的审查依据。FDA与USPTO在药品注册过程中涉及专利审查时的相互联系,可以最大程度地降低FDA批准侵犯登记专利的ANDA的概率。
(3)FDA与联邦法院的专利链接。
ANDA申请人的专利无效或不侵权声明将会传达给专利权人,并且有可能激活专利诉讼[11]。专利权人在收到声明之日起45日内,可以向联邦法院提起专利诉讼。在专利权人提起诉讼后,FDA在30个月(遏制期)内不能对涉案ANDA颁发正式的上市批件,但是FDA的技术性审评在此期间并不会中断。如果专利诉讼在遏制期内未能终结且FDA认为ANDA符合美国《食品、药品和化妆品法案》(Food,Drug&Cosmetic Act,FDCA)的规定,则会颁发临时批件。若联邦法院随后判决专利有效或被侵权,则FDA将会撤销临时批件,驳回ANDA;若判决专利无效或不侵权,或诉讼期超过30个月,则FDA会将临时批件转为正式批件颁发给ANDA申请人。对在遏制期后诉讼终结前颁发的正式批件,即使随后ANDA申请人败诉,FDA也不会撤销该批件。如果专利权人在接到声明通知45日内未向联邦法院提起诉讼,且ANDA符合FDCA,FDA便可批准仿制药上市。
1.2 加拿大
1993年,为限制涉及新药专利的仿制药在专利到期前上市,从而侵犯新药厂商的利益,加拿大参考美国专利链接制度制定了《药品(NOC)专利链接的管理办法》(NOC Regulations),并在加拿大卫生部设置了专利药品及联络办公室负责药品注册过程中的专利链接工作[9]。经过2006年和2011年两次修正后整个体系已非常完善,对加拿大制药行业的发展起到了非常重要的作用(见图2)。
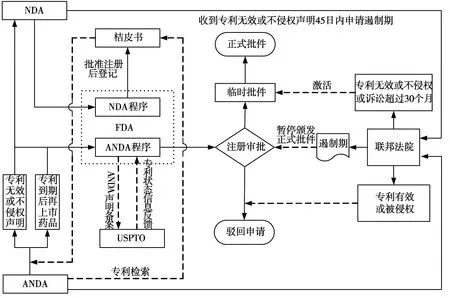
图2 加拿大专利链接体系
(1)卫生部内部的专利链接。
按照NOC Regulations的规定,药品第一申请人进行新药申请(New Drug Submissions,NDS)、新药补充申请(Supplemental NDS,SNDS)时,必须提交与其申请注册药品有关的有效专利的信息。NDS、SNDS经卫生部审核颁发批准通知(Notice of Compliance,NOC)后,由专利药品及联络办公室将专利录入专利登记簿。
而第二申请人进行 SNDS、简略新药申请(Abbreviated New Drug Submissions,ANDS)时则需要经过2次专利链接。如果专利登记簿中存在相关有效专利,第二申请人必须在提交药品注册申请时附有包括相关专利基本信息的《申请表Ⅴ》;如果未检索到相关专利,则需提交专利不存在或已到期声明。
第1次专利链接是在申请资料被卫生部接收后正式受理前,专利药品及联络办公室会对《申请表Ⅴ》或专利不存在/已到期声明进行形式审查。如果二者都没有被提交,则进入专利阻止(Patent Hold)程序,直至申请人补正相关专利材料之后才能进入技术审评程序。
第2次专利链接是在完成技术审评后颁发NOC前,审查的内容包括第一申请人是否在审评期间增加或修改其登记专利信息,第二申请人是否得到第一申请人的回复,是否存在专利纠纷等。如果涉及的专利纠纷没有解决,将再次进入专利阻止,直至专利纠纷解决或临时禁令到期后,再由卫生部决定是否颁发NOC。
(2)卫生部与加拿大知识产权局(CIPO)的专利链接。
卫生部对于第一申请人提交的专利,可以通过专利链接程序向CIPO进行咨询,CIPO将给予建议供卫生部参考。在专利链接程序中,卫生部对登记专利的审查仅仅是作为是否颁发NOC的依据[10],对卫生部作出的决定,当事人可以通过司法途径进行救济。
(3)卫生部与联邦法院的专利链接。
第二申请人必须向第一申请人提供支持其专利无效或不侵权主张的声明通知(Notice of Allegation,NOA)。第一申请人在接到NOA后的45日内,可以向联邦法院申请为期24个月的临时禁令,在临时禁令期内,卫生部不会中止对涉案申请的技术性审评,但除非第一申请人的专利到期、第二申请人胜诉或诉讼超过24个月,否则卫生部不得批准第二申请人的SNDS和ANDS。
1.3 美国和加拿大专利链接体系的特征
第一,在药品注册管理部门内部,专利链接程序分为专利登记程序和专利审查程序。含有专利的新药申请进入专利登记程序,仿制药申请进入专利审查程序,而对仿制药进行专利审查的依据是登记专利,换言之,即使仿制药侵犯了未登记的专利,在专利链接程序中也不视为侵权[11]。
第二,进行专利链接审查的是利用已有临床试验数据的仿制药。药品注册管理部门之所以会对仿制药是否会侵犯登记专利进行审查,主要是为了平衡仿制药申请人的权利和义务,因为仿制药使用了已注册药品的临床试验数据,这极大地节约了仿制药申请人的成本[12]。
第三,仅登记与申请药品直接相关的有效专利,登记时间为新药申请被批准后,未授权的专利申请只有在授权后才能被登记,而已登记但过期的专利将从专利数据库中删除。这种做法保证了登记专利作为仿制药申请人查询依据的权威性,也充分发挥了专利链接在药品注册程序中减少专利纠纷的作用。
第四,药品注册管理部门与法院和专利主管部门的链接仅是职能上的协同,而非职能干涉。美国和加拿大的专利链接仅仅是激活专利诉讼,并不涉及对专利有效性和专利侵权的实质审查。两个国家的药品注册管理部门从未对专利链接中的专利纠纷做出法律意义上的判决。
2 中国药品专利链接体系的现状
我国2002年《药品注册管理办法(试行)》(简称《试行办法》)中首次将药品注册与药品专利联系起来。现行的是2007年《药品注册管理办法》,其中第8条“信息公示”、第18条“药品专利状况和不侵权声明”、第19条“仿制药申请期限限制”、第20条“数据独占”和第66条“监测期保护条款”,以及专利法相关条款被认为是我国药品专利链接体系的基础[13]。
2.1 中国药品专利链接体系的运行机制
在中国,不论是申报新药还是仿制药,都需要就申请药品所涉及的全部领域专利提供不侵权书面保证,但是无需针对每个专利进行不侵权理由论述[14]。国家食品药品监督管理总局(CFDA)不会参照新药申请人提交的专利对仿制药申请人的不侵权声明进行专利链接审查。
在当前中国专利链接体系下,不论是在国家知识产权局(SIPO)进行专利无效宣告审查期间还是在法院进行专利诉讼期间,CFDA的技术性审评都不会中断。如果专利纠纷解决后CFDA没有作出审批决定,那么处理结果可能会影响CFDA的审批结果。如果药品注册批件在纠纷结束之前已经颁发,那么即使专利被判有效或被侵权,CFDA也不会撤销注册批件(见图3)。

图3 当前的中国专利链接体系
2.2 中国药品专利链接体系存在的问题
中国专利链接体系大量参考了Hatch-Waxman法案[15],但是一些关键要素的细微区别使专利链接体系的实际效果在中国发生了变化(见表1)。
(1)专利链接审查涉及的药品范围过宽。
与美国和加拿大不同,在中国的专利链接程序中,新药申请除了进入专利登记程序外,还必须和仿制药一样进入专利链接审查程序。覆盖范围过宽的专利链接审查可能会满足跨国制药公司的需求并且会在短期内提升中国的知识产权声誉。但是,由CFDA通过专利链接审查决定新药是否侵权显然超出了CFDA的职能范围,并且也会延缓新药审批的速度。
(2)注册药品专利数据库缺乏权威性。
与美国和加拿大仅登记有效专利不同,CFDA专利数据库还公布未授权的专利申请和无效专利,这导致数据库的法律效力不足,产生一系列的负面效应:
第一,不具备法律效力的数据库很难使新药申请人认真对待提交的专利信息。申请人会认为在中国无论向CFDA提交专利与否,都不会影响CFDA对注册申请的审批进度和结果,以至于新药申请人有时不愿将与新药相关的专利进行登记[16],或是仅登记一些能够激活专利诉讼的专利[17],而将核心专利作为证据在司法诉讼中使用。这将使得专利链接体系失去赖以生存的基础。
第二,不具备法律效力的数据库不能确保药品申请人的不侵权保证的正确性。药品申请人做出的专利不侵权保证是针对有效专利而言的,其对登记的未授权的专利申请声明不侵权不能视为虚假陈述,然而如果未授权的专利申请在不侵权保证做出后被授权,则药品注册申请人会构成事实上的侵权,前述的不侵权保证也会成为空谈,这直接导致CFDA专利数据库的权威性大打折扣。
(3)专利不侵权保证不能及时告知专利权人。
由于CFDA既不会将书面不侵权保证转发专利权人也没有规定仿制药申请人的通知义务,因此专利权人只能通过CFDA公示的药品注册信息和其他途径了解其专利是否被侵权,然后通过司法途径进行救济。然而由于药品注册信息公示的滞后性使得专利权人通常不能在第一时间获知相关信息,这势必影响专利权人提出异议的效率,不利于及时解决潜在的专利纠纷。
(4)CFDA同法院和SIPO的链接有待加强。
CFDA与SIPO不需要进行业务上的链接,并且其审批决定不会为未决专利诉讼做出保留。因此,除了在药品注册申请批准前会参考法院或SIPO处理结果外,CFDA与二者没有任何协同。部门间的相互协作的欠缺使CFDA对侵权药品批准注册的概率不可避免地增加。因此,在药品注册审批过程中,如何实现CFDA与法院和SIPO在处理专利纠纷时的部门间有效协同是专利链接体系构建的重要内容。
3 对中国专利链接体系的修改建议
针对当前中国专利链接体系中微观层面中出现的问题,结合美国和加拿大的实际经验,提出新的专利链接体系的构思(见图4)。

图4 中国专利链接体系的构思
3.1 缩小进入专利链接程序的药品范围
专利链接会降低药品的审批速度[18]。为了提高CFDA对新药的审批速度和对仿制药审批的质量,使CFDA不超越其法定权限、技术专长及人力资源去解决新药的侵权问题,应限定进入专利链接程序的药品范围。
(1)进入专利链接程序的药品。
第一,专利药。被发明专利保护的药品是不可能属于仿制药,也就不能利用已有的临床试验数据进行注册申报,CFDA也就没有义务在专利链接程序中对其进行专利审查,因此专利药只需进行专利登记。
第二,利用已有临床试验数据的仿制药。为了权利和义务的平衡,有必要保证该类仿制药不侵犯在先药品的专利权,对该类药品的专利链接审查应限于公示专利。
(2)不需进入专利链接程序的药品。
第一,改变了活性成分、给药途径、剂型、规格和适应证的非专利药。这类非专利药必须进行临床试验,因此应被排除在专利链接审查程序之外,由于其没有专利也不需要进行专利登记。
第二,进行了临床试验的仿制药。2007年《药品注册管理办法》没有规定仿制药不能进行临床试验,因此从理论上讲,仿制药申请人可以使用自己的临床试验数据进行申报,该类药品不应进入专利链接程序。
有学者认为这可能导致仿制药申请人在专利到期前进行临床试验规避专利链接审查[19]。但此种情况出现的可能性极低:一方面进行临床试验需要大量的时间和金钱成本;另一方面,侵权的仿制药在专利到期前上市也会被专利权人提起侵权诉讼。出于对成本和风险的考虑,仿制药申请人不可能将该类仿制药设定一个可负担的价格,所以其通常不会利用临床试验规避专利链接审查。
3.2 仅公示有效专利和限定公示专利的时间
第一,CFDA应仅公示与申请新药直接相关的完整准确的有效专利。完整准确的专利公示可以使CFDA在药品申批时减少批准侵权注册申请的数量。此外,为了避免公示过多的不相关专利、未授权的专利申请和无效专利,CFDA可以要求专利权人列举至少一条公示专利的理由。
第二,新药的专利公示应该在新药申请被批准后。这样做的目的是防止在新药申请获得批准前,其专利对仿制药专利链接审查的限制,毕竟按照专利链接的原理,如果新药申请被驳回,其专利不应成为专利链接审查的依据,出现在CFDA专利数据库中则会影响数据库的权威性。
公示有效专利和限定公示专利的时间将极大地提高专利数据库的法律效力,而数据库权威性的增加势必会提升专利链接体系的地位,使其得到药品申请人的重视。
3.3 要求仿制药申请人提交详细的不侵权理由并且规定通知义务
详细的不侵权理由和通知义务可以促进专利纠纷更早地解决和减少不必要的专利诉讼[20]。其一方面强化了仿制药申请人的义务;另一方面也使专利权人对提供的专利信息的准确性更加重视。因为在药品审批过程中,由于专利权人提供专利信息不准确而导致CFDA批准注册了侵权的药品,CFDA不对之负责。
3.4 加强药品审批过程中CFDA与SIPO的链接
在药品进行审批过程中,无论是涉及专利公示还是专利链接审查,CFDA都应与SIPO进行协同。第一,对需要公示的专利,CFDA审查其是否与新药直接相关,遇到技术性问题可以咨询SIPO;第二,对公示后的专利,CFDA可以与SIPO建立通知程序,由SIPO及时通知CFDA删除失效专利;第三,在专利链接审查中,对专利无效或不侵权保证的理由,CFDA在通知专利权人的同时,也可以向SIPO进行咨询。
3.5 设定合理的注册审查保留时间
CFDA应该根据中国专利诉讼的平均持续时间设置保留时间上限。一方面,设置自动保留时间后,专利权人不能无休止地拖延专利纠纷以阻止仿制药的审批和上市;另一方面,由于专利纠纷的处理时间一般长于药品注册审批时间,设置保留期间,能够使CFDA在合理的期限内等待法院和SIPO处理结果,然后再作出审批决定,这无疑会提高CFDA的审批效率。
我国一审法院通常在案件提交12个月之内解决国内专利侵权纠纷,对涉及国外当事人的案件时间会略长[21]。SIPO的专利复审委员会的复审时间通常会在24个月以上[22]。对一审来讲,24个月的保留时间可能比较合理,也能与2007年《药品注册管理办法》第19条相呼应,该条允许仿制药申请人在专利到期前2年提交仿制药申请。
4 结束语
当前的中国专利链接体系与美国和加拿大相比,基本上流于形式,未能真正发挥专利链接在药品注册中的实际作用,得不到药品申请人的重视。因此对当前的专利链接体系的完善首先应加强体系的权威性,这种权威性不应该仅仅停留在制度宏观表面上,最重要的是落实到实际的操作中。权威性的体现并不是指权力范围的扩大,相反在专利链接体系中应谨慎地使用CFDA的行政权力。特别是当涉及实际的专利冲突时,专利链接仅仅需要激活使SIPO和法院处理当事人之间的专利纠纷的法定条件,将专利无效和侵权诉讼留给SIPO和法院去解决,而不是在专利链接程序中做出结论。
[1]Commission Executive Summary of the Pharmaceutical Sector Inquiry Report[R].2009.23.
[2]Galantucci,R.Data protection in a US-Malaysia free trade agreement:new barriers to market access for generic drug manufacturers[J].Fordham Intellectual Property,Media and Entertainment Law Journal,2007,17(4):1083.
[3]杨悦,董丽.美国FDA处理药品注册专利链接问题的研究[J].中国医药导刊,2006,8(5):387-390.
[4]陈唯真.谈加拿大药品上市审批中的专利链接管理[J].中国新药杂志,2006,15(14):1129-1131.
[5]丁锦希,韩蓓蓓.中美药品专利链接制度比较研究[J].中国医药工业杂志,2008,39(12):950-955.
[6]汪虹,刘立春.药品专利链接制度研究[J].中草药,2010,41(9):1558-1563.
[7]肖建玉,沈爱玲.构建符合我国国情的药品专利链接制度[J].现代中药研究与实践,2010,24(5):83-85.
[8]Harkins,C.A.A budding theory of willful patent infringement:orange books,colored pills,and greener verdicts[J].Duke Law and Technology Review,2007,6(8):6.
[9]Blanchard,A.,J.Clark,et al.Canada:A Review of Intellectual Property and Regulatory Issues and Trends for the Life Science Industry[R].Gowling Lafleur Henderson LLP,2006.
[10]Eli Lilly & Co.v.Apotex Inc.,[1997]76 C.P.R.(3d)1,5-6(Can.)
[11]Baker,B.K.Ending drug registration apartheid:taming data exclusivity and patent/registration linkage[J].American Journal of Law and Medicine,2008,34(4):305-307.
[12]Bouchard,R.A.I'm still your baby:Canada's continuing support of U.S.linkage regulations for pharmaceuticals[J].Marquette Intellectual Property Law Review,2011,15(1):72.
[13]丁锦希,韩蓓蓓.中美药品专利链接制度比较研究[J].中国医药工业杂志,2008,39(12):953.
[14]Halverson,K.China's WTO accession:economic,legal and political implications[J].Boston College International and Comparative Law Review,2004,27(2):352-353.
[15]Ho,C.Access to Medicine in the Global Economy:International Agreements on Patent and Related Rights[M].New York:Oxford University Press,2011.278.
[16]Mahn,T.G.Drug labels:the new orange book[J/OL].FDLI Update,July/August 2006:11(2012-08-18).http://www.fr.com/files/News/874b66ce-218f-407b-a2a4-0a2355a593b2/Presentation/NewsAttachment/1a67113f-e386-4093-acc2-0435add0bafa/DrugLabels.pdf.
[17]Crowne,E.A.,C.Mihalceanu.Innovators and generics:proposals for balancing pharmaceutical patent protection and public access to cheaper medicines in Canada(or Don't NOC the players,hate the regulations)[J].IDEA:The Intellectual Property Law Review,2011,51(4):714-715.
[18]Mittal,A.Patent linkage in India:current scenario and need for deliberation[J].Journal of Intellectual Property Rights,2010,15(5):195.
[19]Hemphill,C.S.,B.N.Sampat.When do generics challenge drug patents?[J].Journal of Empirical Legal Studies,2011,8(5):613.
[20]Wroblewski,M.,M.Bye,et al.Trade Comm‘N,Generic Drug Entry Prior To Patent Expiration:An FTC Study[R].Federal Trade Commission,2002.4.
[21]Carnabuci,C.Patent Litigation in Asia:People's Republic of China[R].Freshfields Bruckhaus Deringer,2007,1.
[22]Bai,J.B.,P.J.Wang,et al.What multinational companies need to know about patent invalidation and patent litigation in China[J].Northwestern Journal of Technology and Intellectual Property,2007,5(3):453.

