白背飞虱RAPD-PCR 反应体系的正交设计优化
谢家楠,郭建军,金道超
(贵州山地农业病虫害重点实验室,贵州大学昆虫研究所,贵阳 550025)
RAPD (Randomly Amplified Polymorphic DNA,随机扩增多态性DNA 标记)是一种基于PCR(Polymerase Chain Reaction)技术建立的较为传统的分子标记技术,由William 等20 世纪90年代提出(曹天文等,2009)。由于其具有技术简单、对DNA 纯度要求较宽松、不需要任何分子遗传背景、可用引物多等特点,广泛应用于昆虫遗传多样性检测、基因定位、品系鉴定、遗传图谱的构建和系统学等诸多领域(李东伟等,2010)。
白背飞虱Sogatella furcifera (Horváth)属半翅目Hemiptera 飞虱科 Delphacidae (葛仲麟等,1984),是广布性重要水稻害虫(秦厚国和叶正襄,2003)。自20 世纪50年代后期水稻种植制度改制以来,白背飞虱危害逐年扩大,特别在近年因其暴发为害造成水稻大量减产甚至绝收的情况屡见不鲜(赵悦,2011)。在此背景下,展开了白背飞虱的广泛研究(胡国文和刘芹轩,1981;马巨法等,1996;程遐年等,2003;沈君辉等,2003),如对白背飞虱虫源研究表明广西东北部早前迁入虫源主要来自越南北部、海南、广西西南及南部稻区(齐会会等,2011)。分子标记技术应用于白背飞虱研究成果较少,仅见于Liu 等(2010)采用ISSR (inter-simple sequence repeat)标记开展云南稻区不同地理种群白背飞虱遗传多样性研究,对白背飞虱RAPD 及其PCR 体系系统优化研究尚未见报道。
本研究采用正交设计法对白背飞虱RAPD-PCR 体系进行了优化研究,分析了Mg2+浓度、Taq DNA 聚合酶量、dNTPs 浓度、模板DNA 量和Primers 浓度对白背飞虱RAPD-PCR 体系的影响,获得了白背飞虱RAPD-PCR 反应的最优体系,为白背飞虱的遗传多样性分析和分子生态学研究提供了有益借鉴。
1 材料与方法
1.1 试验材料
样本:白背飞虱成虫,采自2013年6月贵州省花溪区稻田,经实验室饲养去寄生和饥饿处理。
引物:摘选近年相关研究中发表的随机引物序列,委托上海生物工程有限公司合成,经初步筛选,获得10 条引物进行本研究。
试剂:dNTPs、Taq DNA 聚合酶、10× PCR buffer、MgCl2等为宝生物工程有限公司产品。
1.2 基因组DNA 提取
白背飞虱基因组DNA 提取采用SDS 法(王桂荣等,2001)并略加修改。BIO-RAD SmartSpec plus 核酸蛋白测定仪检测DNA 浓度和质量。基因组DNA-20℃保存。
1.3 RAPD-PCR 体系正交设计
为获得白背飞虱最优RAPD-PCR 反应体系,对Mg2+浓度、Taq DNA 聚合酶量、dNTPs 浓度、模板DNA 量和Primer 浓度5个因素4个水平选用L16(45)正交优化表做正交优化试验 (表1、表2),试验重复3 次。反应体系包括上述5个成分外,添加2μL的10× PCR Buffer (10 mmol/L Tris-HCl;50 mmol/L KCl),最后ddH2O 补充至20μL。
1.4 RAPD-PCR 扩增反应
PCR 反应在iCycler Thermal Cycler (BIO-RAD)PCR 仪上进行,参数为:94℃变性4 min;94℃变性30 s,退火60 s,72℃延伸90 s,40个循环;72℃延伸10 min。扩增产物2%琼脂糖凝胶(含GoldView I 核酸染料)电泳检测,UNIVERSAL HOOD‖(BIO-RAD)凝胶成像系统拍照。
1.5 引物退火温度及反应循环筛选
正交优化试验建立白背飞虱RAPD-PCR 体系,RAPD 引物以Tm 值为基础浮动5℃进行退火温度筛选,以条带丰富、稳定为优。以35、40、45 次3个梯度进行RAPD-PCR 反应循环次数筛选,试验重复3 次。
2 结果与分析
2.1 直观分析法评分
分析白背飞虱RAPD-PCR 正交试验产物电泳图(图1),依据条带丰富度、清晰度及背景干扰强弱做直观分析。泳道条带数量多、清晰度高、背景干扰低的PCR 产物记分最高,记16,相反记分最低,记1。图1 自左至右结果记分依次记1、9、5、3、11、6、14、8、15、13、2、7、16、12、10、4。16个处理结果取3 次重复试验记分平均值。

表1 白背飞虱RAPD-PCR 体系因素水平设计Table 1 Factors and levels of RAPD-PCR reaction of Sogatella furcifera
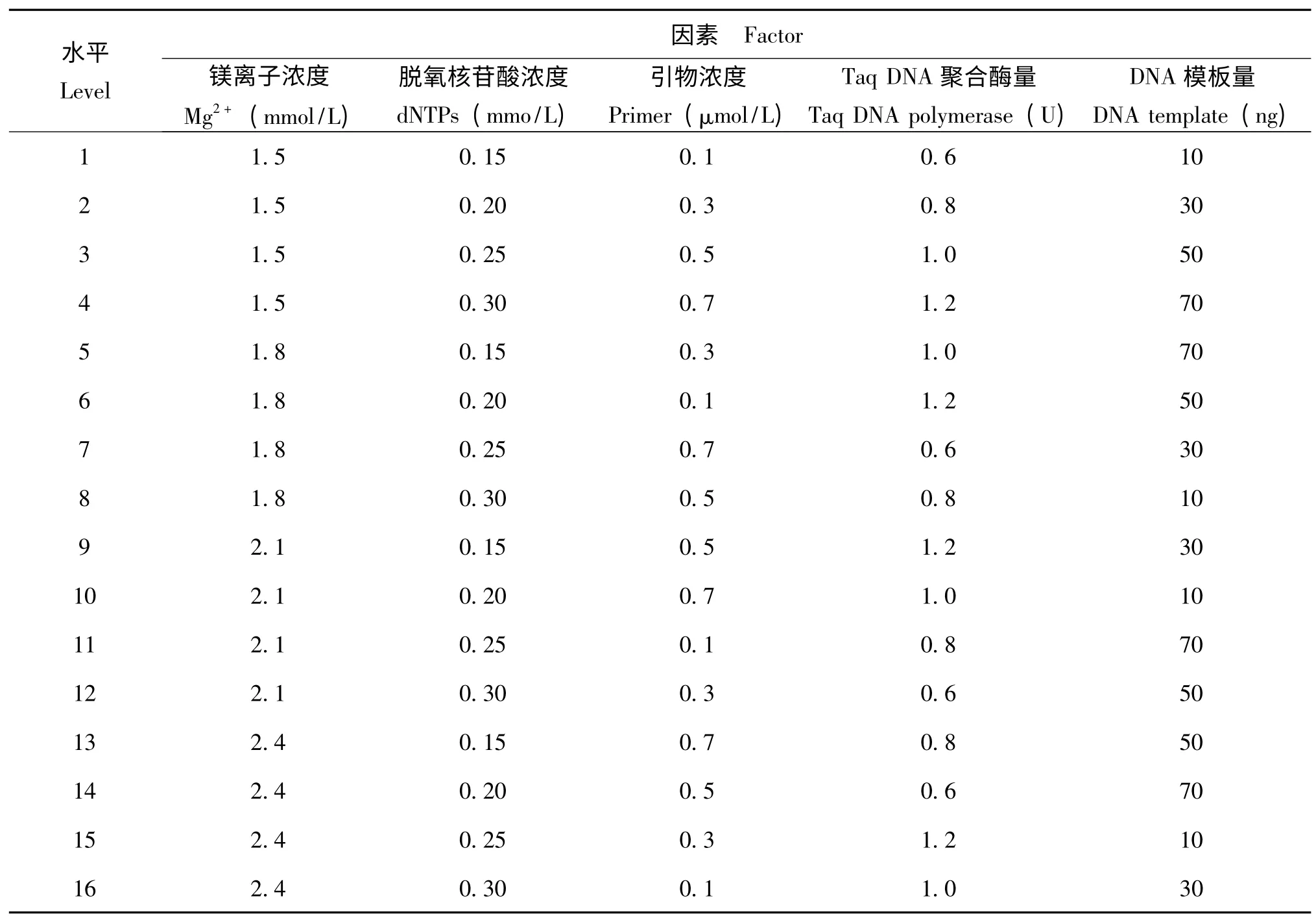
表2 白背飞虱RAPD-PCR 正交试验设计表[L16(45)]Table 2 Orthogonal design for RAPD-PCR reaction of Sogatella furcifera

图1 白背飞虱RAPD-PCR 正交试验产物电泳结果Fig.1 Sogatella furcifera electrophoresis map of RAPD-PCR products of the orthogonal tests
2.2 RAPD-PCR 反应影响因素分析
采用正交设计助手II 软件对试验结果进行方差分析,F 比值表明:白背飞虱RAPD-PCR 反应5个因素影响程度不同:Primer 浓度>Mg2+浓度>dNTPs 浓度>模板DNA 量>Taq DNA 聚合酶量。
2.2.1 Mg2+浓度对白背飞虱RAPD-PCR 反应的影响
白背飞虱RAPD-PCR 反应Mg2+浓度因素指标值曲线表明(图2):Mg2+浓度由1.5 mmol/L至1.8 mmol/L、2.1 mmol/L 至2.4 mmol/L 变化,因素指标值增大;1.8 mmol/L 至2.1 mmol/L,因素指标值减小。表明,白背飞虱RAPD-PCR 反应Mg2+浓度2.4 mmol/L 时最优。
2.2.2 dNTPs 浓度对白背飞虱RAPD-PCR 反应的影响
白背飞虱RAPD-PCR 反应dNTPs 浓度因素指标值曲线表明(图2):dNTPs 浓度由0.15 mmol/L至0.3 mmol/L 变化,因素指标值降低。白背飞虱RAPD-PCR 反应dNTPs 最优浓度为0.15 mmol/L。
2.2.3 Primer 浓度对白背飞虱RAPD-PCR 反应的影响
白背飞虱RAPD-PCR 反应Primer 浓度因素指标值曲线表明(图2):Primers 浓度由0.1μmol/L至0.7μmol/L 变化,因素指标值增大;白背飞虱RAPD-PCR 反应引物最优浓度为0.7μmol/L。

图2 白背飞虱RAPD-PCR 反应因素指标曲线Fig.2 The RAPD-PCR factor index curve map of Sogatella furcifera
2.2.4 Taq DNA 聚合酶量对白背飞虱RAPD-PCR 反应的影响
白背飞虱RAPD-PCR 反应Taq DNA 聚合酶因素指标值曲线表明(图2):Taq DNA 聚合酶量由0.6 U 至0.8、1.0 U 至1.2 U 变化,因素指标值增大;0.8 U 至1.0 U,因素指标值减小。白背飞虱RAPD-PCR 反应Taq DNA 聚合酶量0.8 U 时最优。
2.2.5 模板DNA 量对白背飞虱RAPD-PCR 反应的影响
白背飞虱RAPD-PCR 反应模板DNA 因素指标值曲线表明(图2):模板DNA 量由10 ng 至30 ng,因素指标值增大;30 ng 至70 ng,因素指标值减小。白背飞虱RAPD-PCR 反应模板DNA量为30 ng 时最优。
2.3 退火温度对白背飞虱RAPD-PCR 反应的影响
合适的退火温度有利于RAPD-PCR 反应。筛选的10 条引物,做退火温度梯度筛选(图3),获得各引物的最优退火温度,位于35-39℃间(表3)。

表3 白背飞虱RAPD-PCR 引物信息Table 3 The primer information of RAPD-PCR for Sogatella furcifera

图3 引物P-2、P-10、P-11、P-24 退火温度梯度筛选(自左向右)Fig.3 The results of RAPD-PCR at different annealing temperatures with primer P-2、P-10、P-11、P-24 (from left to right)
2.4 循环次数对白背飞虱RAPD-PCR 反应的影响
白背飞虱RAPD-PCR 反应循环次数筛选试验设置了35、40、45 次循环3个梯度,综合条带的丰富度及泳道弥散情况表明(图4),40 次循环为白背飞虱RAPD-PCR 反应最优循环次数。

图4 白背飞虱RAPD-PCR 反应循环次数筛选Fig.4 The results of different RAPD-PCR cycles
3 结论与讨论
本研究结果揭示Mg2+、Taq DNA 聚合酶、dNTPs、DNA 模板和Primer 因素综合影响PCR 反应产物,各影响因素间存在相互作用。正交设计优化法以PCR 体系各因素综合作用为研究对象,相对单因素分别优化法,正交设计优化试验简化了试验步骤,降低了试验成本,缩减了试验周期,获得的最优因素组合更符合试验实际情况(朱英等,2012)。
Mg2+作为PCR 反应中Taq DNA 聚合酶激活剂,浓度过低降低聚合酶的活性,导致PCR 产物量降低;浓度过高导致PCR 产物中非特异产物增加,在一定范围内的高浓度Mg2+才会有助于获得足量的特异性PCR 产物。dNTPs 作为合成PCR 产物原料,浓度过低则PCR 反应不完全,产物量降低;浓度过高影响Mg2+的作用,在满足合成产物的情况下,低浓度的dNTPs 有助于PCR 反应。模板DNA 浓度高低影响着与引物的结合几率,过低或过高都会降低结合几率,影响产物量(张杨等,2012)。本研究基于正交优化设计对白背飞虱RAPD-PCR的5个因素进行4 水平优化,构建了最优体系,即:2μL 10×PCR Buffer (10 mmol/L Tris-HCl;50 mmol/L KCl),2.4 mmol/L Mg2+,0.15 mmol/L dNTPs,0.7μmol/L 引物,0.8 U Taq DNA Polymerase (TAKARA)和30 ng 模板DNA,ddH2O 补充至20μL。这一结果与褐飞虱RAPD 研究采用的PCR 体系相近(关秀杰等,2004),而与灰飞虱(万由衷等,2001)和小绿叶蝉(付建玉等,2007)RAPD-PCR 体系存在不同,这可能与褐飞虱生物学及遗传学特性更接近白背飞虱有关;同时也表明物种间RAPD-PCR 并不完全相同,构建优化RAPD-PCR 体系是进行物种RAPD 研究的基础。
退火温度对PCR 结果有较大影响(杨家强等,2012),温度过低会增加引物与DNA 模板的非特异性结合,从而导致反应结果中出现大量非特异性结合条带;温度过高会降低引物与DNA 模板的特异性结合,导致反应结果中特异性结合条带减少。本研究对10 条白背飞虱RAPD-PCR 引物做退火温度梯度筛选,获得了各引物最优退火温度。各引物最优退火温度不尽相同,在35-39℃间。循环次数对RAPD-PCR 反应结果有一定的影响,较少的循环次数会导致扩增产物量偏少,目的条带检测困难;较多的循环次数会导致非特异产物的增加,导致泳道弥散严重。研究显示40 次循环为白背飞虱RAPD-PCR 反应最优循环次数。
References)
Cao TW,Zhang M,Wang R,et al.RAPD analysis of genetic diversity of five populations of Pieris rapae (L.)in Sanxi Province,China[J].Acta Ecologica Sinica,2009,29 (7):3939-3945.[曹天文,张敏,王瑞,等.山西不同地域菜粉蝶RAPD 遗传多样性[J].生态学报,2009,29 (7):3939-3945]
Chen XN,Wu JC,Ma F.Study and Management of Brown Rice Planthopper (Nilaparvata lugens (Stål))[M].Beijing:China Agriculture Press,2003:1-373.[程遐年,吴进才,马飞.褐飞虱研究与防治[M].北京:中国农业出版社,2003,1-373]
Chu D,Chen GF,Xu BY,et al.RAPD analysis of population genetic structure of Bemisia tabaci biotype B and biotype Q [J].Acta Entomologica Sinica,2007,50 (3):264-270.[褚栋,陈国发,徐宝云,等.烟粉虱B 型和Q 型群体遗传结构的RAPD分析[J].昆虫学报,2007,50 (3):264-270]
Fu JY,Han BY.Studies on genetic relationships among populations of Empoasca vitis (Gothe)from tea gardens in seven provinces based on RAPD analysis [J].Acta Agriculturae Zhejiangensis,2007,19 (1):11-14.[付建玉,韩宝瑜.七省茶园假眼小绿叶蝉的RAPD 分析及其亲缘关系探讨[J].浙江农业学报,2007,19 (1):11-14]
Guan XJ,Fu Q,Wang GR,et al.The DNA polymorphism of host-associated populations of Nilaparvata lugens (Stål)with different virulence[J].Acta Entomologica Sinica,2004,47 (2):152-158.[关秀杰,傅强,王桂荣,等.不同致害性褐飞虱种群的DNA 多态性研究[J].昆虫学报,2004,47 (2):152-158]
Hu GW,Liu QX.Migration regularity of Sogatella furcifera (Horváth)[J].China Plant Protection,1981,3:41-47.[胡国文,刘芹轩.白背飞虱的迁飞规律[J].中国植保导刊,1981,3:41-47]
Kuoh CL,Ding JH,Tian LX,et al.Economic Insect Fauna of China:Homoptera:Delphacidae [M].Beijing:Science Press,1984:113-148.[葛仲麟,丁锦华,田立新,等.中国经济昆虫志:同翅目飞虱科[M].北京:科学出版社,1984,113-148]
Li DW,Gao SJ,Pang BP,et al.The genetic divergence of nine population of Oedaleus asiaticus in Mongolia based on RAPD[J].Chinese Bulletin of Entomology,2010,47 (3):472-478.[李东伟,高书晶,庞保平,等.内蒙古地区亚洲小车蝗不同地理种群的RAPD 分析[J].昆虫知识,2010,47 (3):472-478]
Liu JN,Gui FR,Li ZY.Genetic diversity of the planthopper,Sogatella furcifera in the Greater Mekong Subregion detected by inter-simple sequence repeats (ISSR)markers[J].Journal of Insect Science,2010,10:52 available online:insectsicence.org/10.52.
Luo D,Huang B,Hou M.Analysis of diamondback moth populations under host plants stress by RAPD[J].Chinese Journal of Applied Entomology,2011,48 (2):273-279.[罗德,黄斌,候有明.寄主胁迫下小菜蛾种群的RAPD 分析[J].应用昆虫学报,2011,48 (2):273-279]
Ma JF,Tang JY,Takahashi A,et al.Investigation on overwinter of planthopper,Nilaparvata lugens (Stål)and Sogatella furcifera(Horváth)in south China.In:Zhang ZL,Pu YF,Wu JW.Proceedings of The national Symposium on IPM in China [C].Beijing:China Agriculture Press,1996:292-297.[马巨法,汤金仪,高桥明彦,等.中国南部褐飞虱、白背飞虱越冬虫源的再考察.见:张芝利,朴永范,吴钜文.中国有害生物综合治理论文集[C].北京:中国农业科学出版社,1996:292-297]
Qi HH,Zhang YH,Jiang CX,et al.Analysis of the source areas of the early immigration of white-backed planthopper in northeast Guangxi of China [J].Scientia Agricultura Sinica,2011,44(16):3333-3342.[齐会会,张云慧,蒋春先,等.广西东北部稻区白背飞虱早期迁入虫源分析[J].中国农业科学,2011,4 (14):3333-3342]
Qin HG,Ye ZX.Theory and Practice of White-backed Planthopper Population Management [M].Nanchang:Jiangxi Science &Technology Press,2003.[秦厚国,叶正襄.白背飞虱种群治理理论与实践[M].南昌:江西科学技术出版社,2003]
Ren L,Zhang JZ,LI CX,et al.Analysis on the genetic divergence of five populations of Locusta migratoria by using RAPD[J].Journal of Shanxi University (Natural Science Edition),2005,28 (4):415-420.[任俐,张建珍,李春选,等.飞蝗五个自然种群的遗传分化研究[J].山西大学学报(自然科学版),2005,28 (4):415-420]
Shen JH,Shang JM,Liu GJ.Management of the white-backed planthopper,Sogatella furcifera in China:A mini-review[J].Chinese Journal of Rice Science,2003,17 (suppl.):7-22.[沈君辉,尚金梅,刘光杰.中国的白背飞虱研究概况[J].中国水稻科学,2003,17 (增):7-22]
Wang GR,Fan YY,Zhuang JY,et al.DNA-based genetic variation in rice brown planthopper Nilaparvata lugens [J].Acta Entomological Science,2001,44 (1):123-126.[王桂荣,樊叶杨,庄杰云,等.稻褐飞虱的DNA 遗传变异性分析[J].昆虫学报,2001,44 (1):123-126]
Wang YZ,Qv ZC,Cao QY,et al.The RAPD analysis of distribution of Laodelphax striatellus populations [J].Journal of Fudan University (Natural Science),2001,40 (5):535-538.[万由衷,曲志才,曹清玉,等.不同种群灰飞虱 (Laodelphax striatellus)的RAPD 分析[J].复旦学报 (自然科学版),2001,40 (5):535-538]
Xie XB,Su SK,Yan WY,et al.Studies on the genetic diversity detected by RAPD in the offspring of the nutritional crossbreed between Apis cerana cerana and Apis mellifera ligustica[J].Journal of Zhejiang University (Agriculture & Life Sciences),2005,31(6):741-744.[谢宪兵,苏松坤,颜伟玉,等.中蜂与意蜂营养杂交后代随机扩增多态性DNA 研究[J].浙江大学学报(农业与生命科学版),2005,31 (6):741-744]
Xue YB,Li XA,Ge FC,et al.The study on genomic polymorphism among different groups of local Changbaishan Apis Cerana ceranas[J].Scientia Agricultura Sinica,2007,40 (2):426-432.[薛运波,李兴安,葛凤晨,等.长白山中华蜜蜂基因组DNA多态性的研究[J].中国农业科学,2007,40 (2):426-432]
Yang JQ,Wang XJ,Guo ZJ,et al.Establishment and optimization of ISSR-PCR reaction system with orthogonal design for Plutella xylostella[J].Plant Protection,2012,38 (6):90-94.[杨家强,王相晶,郭兆将,等.小菜蛾ISSR-PCR 反应体系的建立与正交设计优化[J].植物保护,2012,38 (6):90-94]
Zhang JZ,Guo YP,Zhang M,et al.Study on DNA polymorphism of three species of Oxya from Yunnan in China [J].Acta Zootaxonomica Sinica,2005,30 (3):447-452.[张建珍,郭亚平,张敏,等.云南三种稻蝗基因组DNA的RAPD 多态性分析[J].动物分类学报,2005,30 (3):447-452]
Zhang Y,Zhang CX,Wang JX,et al.Establishment and optimization of ISSR-PCR reaction system for Eleusine indica [J].Plant Protection,2012,38 (3):90-94.[张杨,张朝贤,王金信,等.牛筋草ISSR-PCR 反应体系的建立与优化[J].植物保护,2012,38 (3):90-94]
Zhao Y,Zhang XX,Zhai BP.Identifying the source regions of Southern rice black-streaked dwarfvirus (Horváth)in Shangyou,Jiangxi Province[J].Chinese Journal of Applied Entomology,2011,48(5):1321-1334.[赵悦,张孝羲,翟保平.江西上犹2009、2010年南方水稻黑条矮缩病的毒源地分析[J].应用昆虫学报,2011,48 (5):1321-1334]
Zhu Y,Liu YX,Huang YH,et al.Optimization of SRAP-PCR system and primer screening for Bletilla[J].Guizhou Agricultural Sciences,2012,40 (11):1-3.[朱英,刘永翔,黄永会,等.白芨属SRAP 引物筛选及反应体系优化[J].贵州农业科学,2012,40 (11):1-3]

