不同省区鸡源大肠杆菌耐药性调查与系统进化群分析
曲志娜,胡学远,王 娟,赵思俊,李玉清,黄秀梅,刘焕奇,王君玮
(1.中国动物卫生与流行病学中心,山东青岛266032;2.青岛农业大学动物科技学院,山东青岛266109)
禽致病性大肠杆菌(Escherichia coli,E.coli)不仅能引发禽大肠杆菌病,严重危害养禽业健康发展,也与人类肠外致病性大肠杆菌密切相关,是毒力基因的贮存宿主,可引发人类食源性疾病。该病的发生不仅与环境卫生差、机体免疫力低下等有关,也与禽致病性大肠杆菌的致病性、耐药性以及二者的传播密切相关。耐药性和致病性的结合可造成该类细菌引发的疾病更加难以预防和治疗,且随着抗菌药的广泛使用和盲目滥用,导致临床菌株耐药更加严重,同时加强了抗菌药物在畜禽体内的残留,而且其携带的耐药基因可随着食物链间接对公众健康造成影响,给我国畜牧业的持续发展和人类的身体健康带来潜在危害。
本研究采用PCR法对不同省区鸡源大肠杆菌进行系统进化群分析,通过致病性试验,了解鸡源大肠杆菌致病菌株的分布情况,结合耐药性检测结果,分析不同地区间及致病菌群与低/非致病菌群之间的耐药差异,为临床合理用药和细菌性疾病的防治提供依据。
1 材料
1.1 实验菌株 438株鸡源大肠杆菌(山东167株,河南50株,安徽50株,山西42株,内蒙59株,重庆60株,从表观健康鸡的泄殖腔拭子分离获得),以及O2标准菌株,均由中国动物卫生与流行病学中心动物产品安全监测室提供。大肠杆菌ATCC25922,购自中国兽医药品监察所。
1.2 主要试剂和仪器 胰蛋白胨大豆肉汤、LB肉汤、Mueller-Hinton肉汤(MHB)、细菌琼脂粉均购自北京陆桥生物技术有限公司;96孔药敏板,购自天津市金章科技发展有限公司;GoTaqGreen Master Mix、DNA Marker DL2000和琼脂糖购自TaKaRa公司;电热恒温培养箱(上海爱朗仪器有限公司EYELS SLI-700型)、快速涡匀器(中外合资深圳天南海北有限责任公司SK-1)、PCR仪(BIORAD公司)、电泳仪(北京六一仪器厂)和Gel Doc XR凝胶成像分系统(BIO-RAD公司)。
2 方法
2.1 系统进化群分群试验 采用PCR法检测大肠杆菌菌株的chuA和yjaA基因以及DNA片段TspE4.C2,根据分群标准进行系统进化群分群[1]。引物序列由上海生物工程有限公司合成,具体见表1和表2。DNA模板按菌落煮沸裂解法制备。PCR扩增体系25 μL,包括GoTaq Green Master Mix 12.5 μL、上下游引物各 0.5 μL、模板 2 μL,双蒸水9.5 μL。PCR反应条件:94℃预变性5 min,然后94℃变性45 s,60 ℃退火45 s,72 ℃延伸50 s,共35个循环,最后72℃延伸5 min。
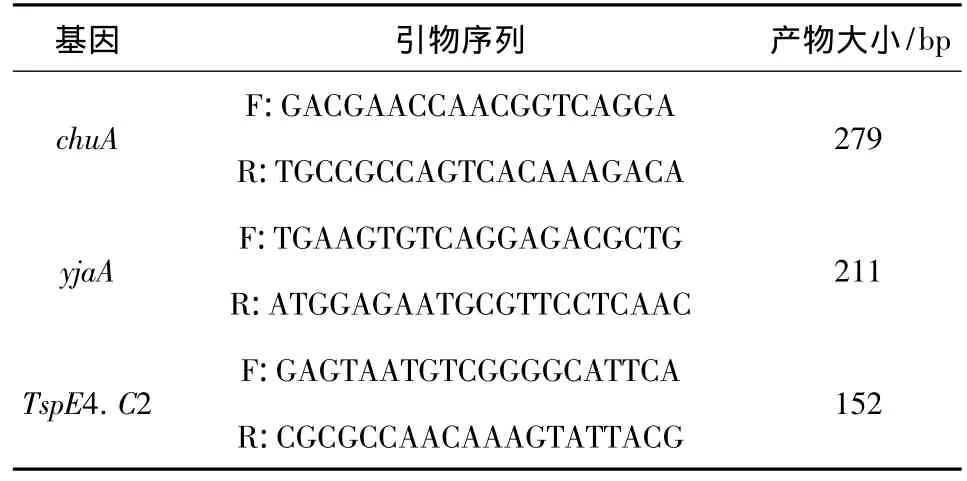
表1 chuA基因、yjaA基因和DNA片段TspE4.C2的引物序列
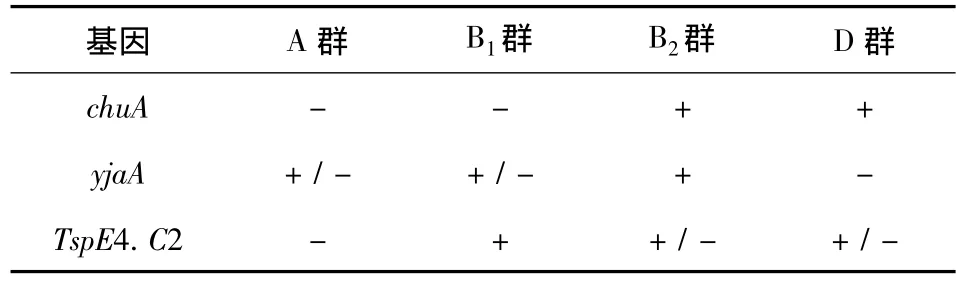
表2 大肠杆菌系统进化群判定标准
2.2 动物致病性试验 选取B2、D、B1和A群各15株菌株作为攻毒组,标准菌株O2作为阳性对照组,空白对照组为阴性对照组,每株菌3只21日龄雌性BALB/C小白鼠,取0.2 mL的1010CFU/mL菌液对每只小鼠进行皮下注射。根据小鼠的死亡数和病变程度确定分离株的致病性[1]。
2.3 最低抑菌浓度测定试验 按照CLSI推荐的微量肉汤稀释法进行测定和判读。
2.4 统计学分析 用SPSS17.0软件对两组样本率χ2检验或两尾Fisher精确检验进行数据分析。当P<0.05时差异显著,具有统计学意义。
3 结果
3.1 系统进化群分群结果 438株鸡源大肠杆菌中,B1群和 A群菌相对较多,分别占 38%(167/438)和 34%(149/438),D 群占 21%(93/438),而B2群菌株最少为6%(27/438)。不同基因片段PCR产物的电泳结果见图1。

图1 不同基因片段PCR产物电泳图
3.2 动物致病性试验结果 试验组:攻毒后小白鼠表现为精神萎靡,食欲下降,消瘦,体重下降,被毛蓬乱,拉稀,肌肉震颤,眼帘粘连,反应迟钝,蜷缩于笼子一角等临床症状,有的甚至死亡。解剖注射大肠杆菌死亡的小白鼠发现,注射部位皮肤出现坏死灶,肝脏灰色肿大,脾脏比健康小白鼠的明显缩小,边缘呈暗紫色,胃内充满内容物,十二指肠水肿,肠内充满黄色内容物,肠壁变薄,下颌淋巴结肿大。各群菌株病死情况:D群,17 h内所有小鼠均死亡;B2群,24 h内67%的小鼠死亡;B1群,96 h内33%的小鼠死亡;A群,直到168 h也未见小鼠死亡。阳性对照组:致病性菌株O2组小白鼠出现与试验组相似的临床症状,且24 h内有67%的小鼠死亡。阴性对照组:空白对照组小白鼠均健活,扑杀时未见任何肉眼变化,心血、肝等器官未分离出任何细菌。
综合临床症状、死亡率及病死脏器分离菌株的鉴定结果,D群和B2群菌株致病性强,属于高致病株;B1群菌株具有一定毒力,属于低致病株;A群菌株虽有一些临床症状,但基本不致病,属于非致病株。
3.3 不同省区鸡源大肠杆菌菌株的药敏试验结果438株鸡源大肠杆菌对13种药物具有不同程度的耐药。耐药严重的是青霉素类、四环素类和磺胺类(耐药率≥80%),粘杆菌素E最为敏感;多重耐药问题突出,433株为多重耐药菌株,多重耐药率高达98.86%,耐7种药以上的菌株占77.18%;耐药性存在空间差异,不同省区鸡源大肠杆菌菌株对个别药物的耐药性差异显著。结果见表3和图2。
3.4 不同系统进化群大肠杆菌菌株耐药结果 不同系统进化群鸡源大肠杆菌菌株对13种药物呈现不同程度的耐药。高致病群B2和D群菌株的耐药程度相对严重,其中 OFL、GM、SPT、EFT、SF、SXT、A/C等7种药物差异显著(P<0.05);多重耐药问题相对突出,高耐菌株比例高于B1和A群菌株,79.17%的菌株耐8~12种药物。具体结果见表4和图3。

图2 鸡源大肠杆菌多重耐药统计情况

表4 不同系统进化群大肠杆菌菌株耐药情况比较
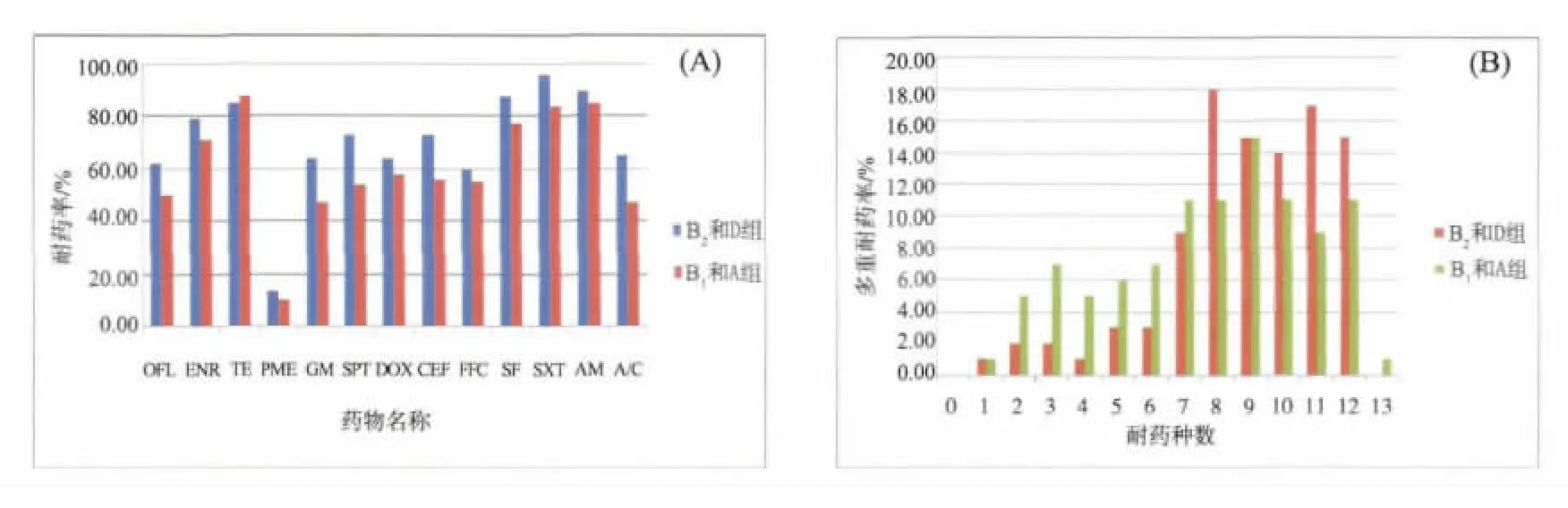
图3 不同系统进化群大肠杆菌菌株耐药率(A)和多重耐药(B)比较
4 讨论
4.1 系统进化群分群分析 大肠杆菌系统进化群可以分为 4个群:A、B1、B2和 D,它们依靠出现chuA、yjaA基因和 TspE4.C2非编码区区分。A和B1群一般存在于共生株中,而B2和D群属于携带毒力相关基因的条件肠外病原体[2]。Tetsuo Asai等[3]研究发现不同病死动物大肠杆菌系统进化群分布不同,A(49.4%)和D(44.9%)主要分布于鸡源大肠杆菌,而B2群只出现在患病鸡分离株上。Obeng等[4]研究了2008.12-2009.6期间南澳大利亚251株禽源大肠杆菌,结果发现32.3~39.4%的分离株属于共生群A和B1,11.2~17.1%属于毒力群B2和D,17株多重耐药菌株属于B2和D群。巴西和日本的研究也显示,健康牛、鸡和猪中未见B2群大肠杆菌[5]。Rodriguez等[6]研究美国患病家禽大肠杆菌发现,A群(38%)和D群(28%)分布较多,B2群的检出率为19%。本实验显示,A和B1群的检出率与其他国家相似,但高致病群存在差异,D群菌株检出率比多数国家高出10%,并从健康鸡中分离到B2群菌株,其他国家未见报道,说明我国鸡大肠杆菌的毒力较强,在适宜条件下更易导致家禽发病。
4.2 不同省区鸡源大肠杆菌耐药情况分析 近年来禽源大肠杆菌耐药问题日渐突出,耐药谱不断扩大,耐药程度日趋严重。李昆明等[7]检测了河南17株禽大肠杆菌对24种抗菌药的耐药情况,结果显示21种药物的耐药率大于70%,其中链霉素、青霉素、四环素、氯霉素等10种药物的耐药率高达90%。杨泽晓等[8]对四川87株大肠杆菌进行26种抗菌药的耐药性检测,受试菌株均有不同程度多重耐药,对青霄素G(100%)、强力霉素(89.66%)、复方阿莫西林(85.20%)、四环素(82.76%)、头孢氨苄(63.22%)、头孢噻吩(52.87%)和复方新诺明(51.72%)的耐药性较强。本实验显示,438株鸡源大肠杆菌耐药情况与以往报道相似,对青霉素类、四环素类和磺胺类药物的耐药较为严重,其中对氨苄西林的耐药率高达87.21%,四环素和复方新诺明均为86.99%。本实验也发现,不同省区鸡源大肠杆菌菌株的耐药性存在不同程度的差异,个别药物差异显著,如奥格门丁在山东和山西两省耐药率均达到80%以上,而河南、安徽、内蒙和重庆四省则在20%左右,头孢噻呋在山东和重庆均达到83%以上,其他省份则在36%左右。
4.3 不同系统进化群菌株耐药情况分析 已有报道系统进化群可能与耐药性的散播有关联。本研究也发现,除了四环素外,B2和D群菌株对其余12种抗菌药的耐药率均高于 B1和A群菌株,其中OFL、GM、SPT、EFT、SF、SXT、A/C 等 7 种药物差异显著(P<0.05);79.17%的B2和D群菌株耐8~12种药物,而B1和A群耐8~12种药物的菌株则有56.92%。说明高致病群B2和D群菌株的耐药程度相对严重,但与 Johnson[9]和 Picard[10]等报道临床B2大肠杆菌分离株的抗菌药耐药性低于非B2分离株的结果不一致。
综上所述,相比其他国家,我国鸡源大肠杆菌致病力强,耐药问题突出,临床菌株普遍产生耐药性,而且高致病菌群菌株比低致病群和共生群菌株的耐药程度更为严重,使得此类细菌性疾病的防治更加难以控制。目前对毒力和耐药性之间的遗传关系了解甚少,但已有报道证实,大肠杆菌毒力因子与耐药性之间存在相关关系,下一步需要确定该类细菌在细菌谱系中的遗传特征,研究调查在遗传水平上耐药性和毒力之间的相互作用,同时确定其表达机制,以便改进对此类疾病的预防和控制。
[1]苏志新.鸡源禽致病性大肠杆菌分离鉴定及其毒力相关基因分布特征分析[D].江苏:南京农业大学,2011.
[2]Clermont O,Bonacorsi S,Bingen E.Rapid and simple determination of the Escherichia coli phylogenetic group[J].Appl Environ Microbiol,2000,66:4555-4558.
[3]Tetsuo Asai,Kaori Masani,Chizuru Sato,et al.Phylogenetic groups and cephalosporin resistance genes of Escherichia coli from diseased food-producing animals in Japan[J].Acta Veterinaria Scandinavica,2011,53:52.
[4]Obeng A S,Rickard H,Ndi O,et al.Antibiotic resistance phylogenetic grouping and virulence potential of Escherichia coli isolated from the faeces of intensively farmed and free range poultry[J].Vet Microbiol,2012,154(3/4):305-315.
[5]Carlos C,Pires M M,Stoppe N C,et al.Escherichia coli phylogenetic group determination and its application in the identification of the major animal source of fecal contamination[J].BMC Microbiol,2010,10:161.
[6]Rodriguez-Siek K E,Giddings C W,Doetkott C,et al.Comparison of Escherichia coli isolates implicated in human urinary tract infection and avian coli bacillosis[J].Microbiology,2005,151:2097-2110.
[7]李昆明,姚惠霞,刘晓琳,等.河南部分地区17株禽源大肠杆菌的耐药性分析.安徽农业科学,2010,38(31):17733-17735.
[8]杨泽晓,庞 歌,王 印,等.四川省部分地区大肠杆菌的耐药性监测[J].畜牧与兽医,2011,43(02):84-87.
[9]Johnson J R,M A Kuskowski,K Owens,et al.Phylogenetic origin and virulence genotype in relation to resistance to fluoroquinolones and extended-spectrum cephalosporins and cephamycins among Escherichia coli isolates from animals and humans[J].J Infect Dis,2003,188:759-768.
[10]Picard B and P Goullet.Correlation between electrophoretic types B1and B2of carboxylesterase B and sex of patients in Escherichia coli urinary tract infections[J].Epidemiol Infect,1989,103:97-103.

