鲤鱼肺炎克雷伯氏菌分离与鉴定
卢玉婷,郑丹丹,胡扬扬,张雅斌,张培军,李月红* ,冷东泽
(1.吉林农业大学动物科学技术学院,长春130118;2.吉林农业大学食药用菌教育部工程研究中心,长春130118;3.吉林省水产科学研究院,长春130000;4.吉林省卫生监测检验中心,长春130000)
肺炎克雷伯氏菌(Klebsiella pneumoniae)属于肠杆菌科肠道杆菌属,广泛存在于人和动物肠道、呼吸道以及水、土壤中。肺炎克雷伯氏菌是当前危害动物和人类最为严重的条件致病菌之一[1],肺炎克雷伯氏菌分布广泛,最先从大叶性肺炎病人的肺组织中分离到,当机体免疫力降低或长期服用抗生素导致菌群失调时易引起感染,若治疗不当则死亡率极高[2]。随着我国特种经济动物养殖业的迅猛发展,该病对毛皮动物和人类的危害日益严重,曾多次报道该病在人和动物中的发生和流行[3]。1999年至2002年北京、广东、湖北和辽宁地区41家三级甲等医院均出现人感染肺炎克雷伯氏菌疾病的案例[4]。该菌寄生在动物体内,也造成了养殖业的巨大损失。2006年周玉龙[5]做了奶牛感染肺炎克雷伯氏菌后急性死亡的研究。2012年王孝友[6]从患病兔体内分离出肺炎克雷伯氏菌。而该菌对水生动物危害的报道很少,对鲤鱼更是鲜有报道。1992年Singh[7]在海水鱼、淡水鱼等水产品中检测到肺炎克雷伯氏菌;2007年唐毅[8]从发病白鲢肝脏和鳃部分离出肺炎克雷伯氏菌。2009年邓国成[9]从发病鳗鱼体内分离出肺炎克雷伯菌。目前尚未有研究性文献明确该菌对鲤鱼的危害。本试验首次从患病鲤鱼上分离到肺炎克雷伯氏菌,建立了该菌对鲤鱼的发病模型,对其进行耐药性测试并筛选了防治药物,为预防和治疗肺炎克雷伯氏菌引起的鲤科鱼类疾病提供一定的参考依据。
1 材料与方法
1.1 材料 试验病鱼来自吉林农业大学蓝湖,病鱼鳃后缘、腹鳍基部、臀鳍基部、生殖口处均出现充血现象,部分鱼腹部出现溃烂症状。鱼鳃部微白。解剖病鱼,有严重腥臭味腹水流出,肠道、肝胰脏、脾脏等处均出现充血症状,部分鱼肌肉充血,胆囊肿大。
1.2 试验仪器及试剂 150G全温振荡培养箱(金坛市国旺实验仪器厂);立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);电热恒温鼓风干燥箱(DHG-9101-OSA型,上海三发科学仪器有限公司);超净工作台(SW-CJ-2FD型,上海博迅实业有限公司医疗设备厂);PhoenixTM-100凤凰全自动细菌鉴定/药敏检测系统;革兰氏染色试剂盒(上海铭睿生物科技有限公司)。
1.3 方法
1.3.1 病原菌的分离纯化 在无菌条件下进行患病鲤鱼鳃和肝胰脏组织的采取,用研钵碾碎后制成组织悬液,用接种环挑取组织液在普通琼脂平板上划线,在37℃培养24 h后观察菌落生长情况。挑取形态和结构,颜色相同的单个菌落在普通琼脂平板上划线分离纯化,待菌落成单个均匀分布,挑取单个菌落采用甘油保藏法保存。
1.3.2 病原菌的鉴定
1.3.2.1 革兰氏染色法 在洁净的载玻片上滴一滴生理盐水,将分离纯化的细菌在无菌条件下用接种环挑取单个菌落,均匀涂布于生理盐水中干燥固定,经结晶紫染色、碘染、酒精脱色、蕃红染色后镜检。
1.3.2.2 生化鉴定 采用PhoenixTM-100凤凰全自动细菌鉴定系统,鉴定板为革兰氏阴性菌鉴定板,51孔,试验周期15 h结束后观察实验结果并分析。
1.3.2.3 药物敏感试验 采用PhoenixTM-100凤凰全自动细菌药敏检测系统,鉴定板为革兰氏阴性菌药敏板,85孔,试验周期15 h结束后观察试验结果并分析。
1.3.2.4 回归试验 取体格健壮、游动活跃的黄河鲤鱼192条,平均规格200 g左右。随机分为4组,分别为试验组1,试验组2,试验组3和对照组,每组48条。将4组鱼同时放入相同水环境不同鱼缸中(浴缸规格为80 cm×60 cm×100 cm),30℃暂养一周。待鱼基本稳定后,试验组每条鱼用腹腔注射法注射菌液(培养液为普通肉汤)0.5mL,对照组每条鱼注射相同无菌普通肉汤培养液0.5 mL。30℃水温下饲养7 d,观察鱼体变化,并记录。
1.3.2.5 细菌的分离鉴定 对1.3.2.4中发病鱼进行细菌分离培养,方法同1.3.1。对分离出的细菌进行革兰氏染色和生理生化检验,分析结果。
2 试验结果
2.1 革兰氏染色结果 革兰氏染色后在显微镜下观察到短杆状、红色细菌,单个存在或2个相连(见图1),表明该细菌呈革兰氏阴性.来自于鲤鱼肝脏和鳃部分离的菌株具有相同的菌体特征。

图1 革兰氏染色镜下图
2.2 生化鉴定结果 如表1可知该菌与七叶苷、PNP-BD-糖苷、Beta-葡二糖等反应呈阳性,表明该菌能发酵或利用这些物质;而与戊二酰-甘氨酸-精氨酸-AMC、黏菌素、4MU-N-乙酰-BD-氨基葡萄甘等反应呈阴性。
2.3 药物敏感试验结果 如表2所示,可知该菌对亚胺培南、美洛培南、头孢他啶、头孢噻肟、左氧氟沙星、环丙沙星等高度敏感,对氨苄西林耐药性最强。
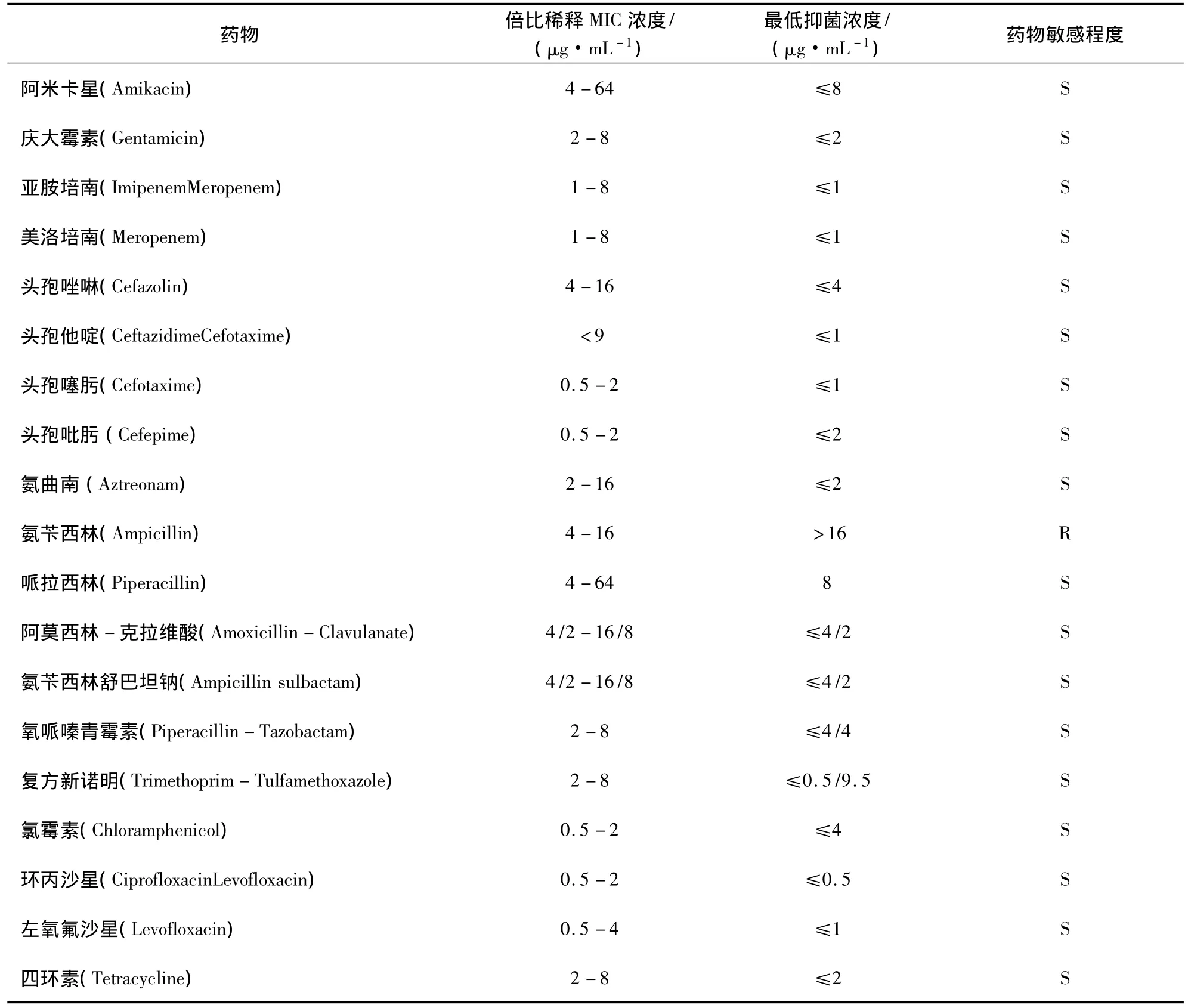
表2 药敏试验结果
2.4 回归试验结果 在注射菌液36 h后,鱼吃食量明显下降甚至不吃食。48 h之后部分鱼开始死亡。试验周期结束后,试验组三个鱼缸均出现不同数量发病死鱼,而对照组鱼无发病死亡出现(见表3)。
观察死亡鱼,发现其体表有明显充血块,尤其是在胸鳍、腹鳍和生殖口处明显,部分鱼体腹鳍基部出现溃烂现象。解剖病鱼有浓烈腥臭味的腹水流出,鱼内脏严重充血,肝胰脏、脾脏及肠道均出现明显充血现象。
2.5 细菌的分离鉴定结果 根据上述革兰氏染色反应及生理生化检验,得到细菌的特征与上述分离的肺炎克雷伯氏菌的特征完全相符。
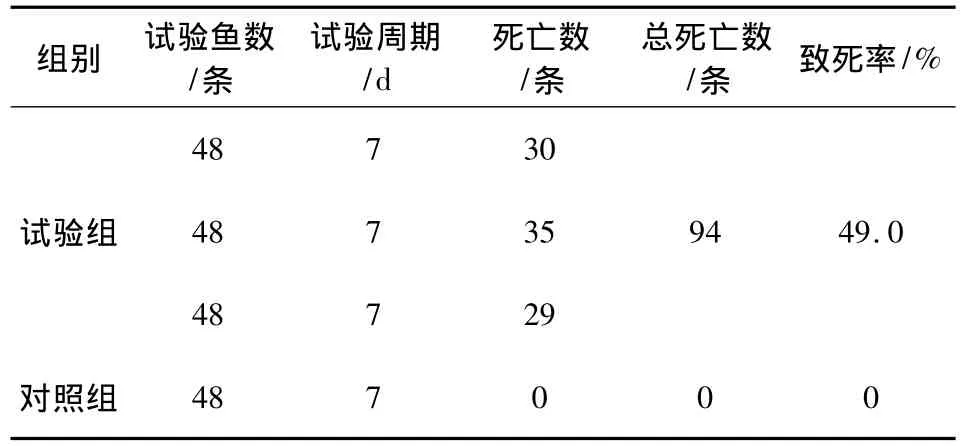
表3 回归试验结果
3 讨论与小结
本试验首次从发病鲤鱼体内分离出肺炎克雷伯氏菌。该菌使鲤鱼发病,表现出身体大部分充血,部分鱼腹部出现溃烂症状,鱼鳃部微白。解剖病鱼,有严重腥臭味腹水流出,内脏多处出现充血症状,部分鱼肌肉充血,胆囊肿大。此发病现象与唐毅[8]等人研究的白鲢感染该菌的症状相似。
从革兰氏染色结果来看,该菌在显微镜下呈现短杆状、红色,单个存在或2个相连,此结果和徐海圣[10]的基本相同。生化鉴定结果中得到该菌与七叶苷、PNP-BD-糖苷、Beta-葡二糖等反应呈阳性,表明该菌能发酵或利用这些物质;与戊二酰-甘氨酸-精氨酸-AMC、黏菌素、4MU-N-乙酰-BD-氨基葡萄甘等反应呈阴性。
人患克雷伯氏菌肺炎较一般肺炎病情重,对一般肺炎常用的首选药物青霉素无效[11]。大量的流行病学调查资料显示,近年来由于各种抗菌药物的广泛使用,导致肺炎克雷伯氏菌耐药性普遍存在,且多数的分离株都为多重抗药性的菌种,耐药性日趋严重,其耐药机制又较复杂,在治疗上造成极大的困扰[12]。本试验所做的肺炎克雷伯氏菌药物敏感试验,分离出了一些高度敏感的药物:亚胺培南、美洛培南、头孢他啶、头孢噻肟、左氧氟沙星、黏菌素和环丙沙星。说明该菌对这些药物十分敏感,这对开发治疗由肺炎克雷伯菌引起的疾病有很好的帮助作用[13],此结果和张芬[14]等人的研究结果基本一致。而该菌对氨苄西林产生耐药性,说明该菌对氨苄西林已经产生抵抗能力,继续使用该药物已经达不到良好的效果。
本试验所进行的试验最终确定该病原菌为肺炎克雷伯氏菌。药敏试验结果分离出几种高度敏感的药物,为治疗和预防该菌对鲤鱼的危害提供可靠实验数据和依据。因鲤鱼感染肺炎克雷伯菌的研究较少,一些具体的发病机制和毒力基因等方面的研究仍需要进一步探究。
[1]陈永林,关孚时,张成林,等.引起大熊猫腹泻的克雷伯氏菌强毒株.中国兽药杂志.1997,2(31):34-36.
[2]马 磊,颜其贵,万 莉,等.竹鼠肺炎克雷伯氏菌的分离鉴定.中国人兽共患病学报[A].2011,27(9):825-827.
[3]高建新,卢兆芸,涂俊凌,等.婴幼儿配方乳粉中检出肺炎克雷伯氏菌肺炎亚种的报告[J].中国人兽共患病学报[A],2009,25(6):611-612.
[4]马 越,李景云,张新妹,等.1999~2002年北京、广东、湖北和辽宁地区大肠埃希氏菌及肺炎克雷伯氏菌临床分离株耐药性比较分析[A].中国抗生素杂志,2004,4(29):226-234.
[5]周玉龙,李国军,李 阳,等.奶牛肺炎克雷伯氏菌的分离与鉴定[B].奶牛保健.2007,6:36-38.
[6]王孝友,杨 睿,沈克飞,等.兔肺炎克雷伯氏菌的分离与鉴定[B].中国兽医杂志,2012,2(48):43-44.
[7]Singh B R,Kulshreshtha S B.Preliminary Examina-tions on the Enterotoxigenicity ofIsolates ofKlebsiella pneumoniaefrom Seafoods[J].Food Microbiology,1992,16(4):349-352.
[8]唐 毅,张 芬,孙翰昌,等.白鲢肺炎克雷伯氏菌的分离鉴定[A].西南大学学报(自然科学版),2007,29(6):965-113.
[9]邓国成,罗 霞,江小燕,等.鳗肺炎克雷伯菌的分离与鉴定[A].上海海洋大学学报,2009,18(2):193-197.
[10]徐海圣,舒妙安.中华鳖肺炎克雷伯氏菌病的病原研究[A].浙江大学学报(理学版).2002,29(6):702-706.
[11]杨艳玲,陈峙峰,王成福,等.水貂肺炎克雷伯氏菌的分离鉴定[A].特产研究,2012,4(3):10-12.
[12]王林峰,王选锭.肺炎克雷伯氏菌耐药机制研究进展[A].中国抗生素杂志,2004,6(29):324-328.
[13]赖小美,郭有能,肖黎莉,等.肺炎克雷伯氏菌分布及细菌耐药性分析[R].江西医药,2006,41(11):888-890.
[14]张 芬,丁诗华,孙翰昌等.淡水鱼肺炎克雷伯氏菌的药物敏感性研究[A].西南大学学报(自然科学版).2008,10(30):84-88.

