连翘苷含药血清的制备及测定
任 杰,武果桃*,韩一超,孟冬霞,赵 娟,曹日亮,徐 芳,刘国敏,栗 艳
(1.山西省农科院畜牧兽医研究所,山西太原030032;2.沁源县畜牧兽医中心,山西沁源046500;3.长治市畜牧局动物卫生监督所,山西长治046000)
连翘具有广谱抗病原微生物作用[1-3]。其主要活性成分连翘苷在抗菌、抗病毒、抗氧化和解热抗炎等方面都起着重要作用[4]。连翘苷含药血清的研究不但能揭示连翘苷及其代谢产物的药理作用,而且能反映可能由连翘苷诱导机体内源性成分所产生的作用,更接近其在体内环境产生的真实过程[5]。
研究旨在选用山西省道地中药材连翘,对实验动物兔进行灌胃,制备含药血清,将含药血清按一定色谱条件进样分析,测定血清中主要活性成分连翘苷的含量;并与连翘标准品中的有效成分连翘苷进行对比。从中药药代动力学方面揭示连翘在动物体内吸收和代谢,为连翘在临床上的推广应用提供了理论及试验资料依据。
1 材料与方法
1.1 仪器 离心机(sigma 2-16K),LUMTECH高效液相色谱仪(UV DETECTOR K-2501检测器,Autosampler进样阀),Eastchrom色谱工作站。
1.2 试剂 甲醇(色谱纯),上海陆忠试剂厂;95%甲醇(分析纯),江西同盟试剂化工厂;连翘苷对照品,中国药品生物制品检定所提供,批号:1108212200406,供含量测定用;连翘(连翘苷含量13.11 mg/g[6]),山西双鹤药业;连翘苷(含量 80%以上),山西奥康动物保健公司。
1.3 实验动物 健康家兔15只,山西医科大学实验动物中心,体重2.1 ~2.8 kg。
1.4 药物制备
1.4.1 提取物的制备 称取100 g连翘,将药物放入药锅内,加干净的冷水浸泡药物,加水量与药物的比为10∶1,浸泡过夜。用大火将浸泡好的药煮沸后,改用中、小火,维持药物沸腾煎煮30 min,倒出药液,重复煎煮一次,合并两次药液浓缩,干燥至粉末得到26 g提取物备用。
1.4.2 煎剂的制备 称取100 g连翘,将药物放入药锅内,加干净的冷水浸泡药物,加水量与药物的比为10∶1,浸泡过夜。用大火将浸泡好的药煮沸后,改用中、小火,维持药物沸腾煎煮30 min,倒出药液,重复煎煮一次,合并两次药液浓缩至100 mL,4℃保存。
1.4.3 粗粉的制备 称取100 g连翘,粉碎至粉末备用。
1.5 样品处理
1.5.1 取15只家兔随机分为5组,分别为提取物组(A组),煎剂组(B组),粗粉组(C组),连翘苷组(D组)和空白对照组。给药前禁食不禁水24 h,连续3 d给药,每天两次,给药剂量A组1 g/d,B组4 mL/d,C 组4 g/d,D 组5 mg/d[7]。最后一次给药后在0.5、1、1.5、2、4 h 采血,每试验组各时间段血液混合放入离心管静置3 h,4000 r/min离心取上清血清。分装-20℃保存。
1.5.2 精密称取连翘苷对照品 2.001 mg,置于10 mL容量瓶中,用甲醇溶液溶解,稀释至刻度,摇匀作为对照品储备液.吸取该对照品溶液20 μL经0.45 μm 微孔滤膜过滤,作为对照品溶液[6]。
1.5.3 取含药血清 100 μL 加 300 μL 乙腈涡旋2 min,10000 r/min离心 10 min,取上清液,氮气吹干,用 100 μL 流动相溶解,0.45 μm 微孔滤膜过滤,作为测定样品[8]。
1.6 HPLC测定连翘苷的方法学考察
1.6.1 色谱条件 色谱柱PT-230AColume heater Apollo C18 柱(150 mm ×4.6 mm,5 μm),流动相为乙腈-水 25∶75,流速 0.8 mL/min,检测波长为235 nm,柱温25℃。
1.6.2 线性关系试验 精密吸取对照品溶液2、6、10、15、20 μL ,按上述色谱条件进样,平行 3 次,测定连翘苷峰面积,以峰面积平均值(μV·s)对进样量(μg)进行线性拟合,连翘苷的回归方程为Y = 2.36 × 105X+1.87 × 103,r=0.999。表明连翘苷进样量在0.4~4.0 μg时,线性关系良好。
1.6.3 精密度试验 精密吸取连翘苷对照品溶液10 μL进样,重复5次,测得连翘苷峰面积相对标准偏差(RSD)为0.6%,表明仪器精密度良好。
1.6.4 稳定性试验 精密吸取供试品溶液,按上述色谱条件分别在1、3、5、7、12 h 进样一次,计算,测得RSD为0.5%。证明样品在12 h内稳定。
1.6.5 重现性试验 精密吸取供试品溶液样品5份,每份10 μL进样分析,测得连翘苷峰面积的RSD为1.4%(n=5),表明该方法重现性好。
1.6.6 加样回收率试验 精密吸取已知连翘苷含量样品5份,分别加入适量的连翘苷对照品,制备进样溶液,进样分析,连翘苷平均回收率为97.1%,RSD 为1.2%(n=5),结果见表1。
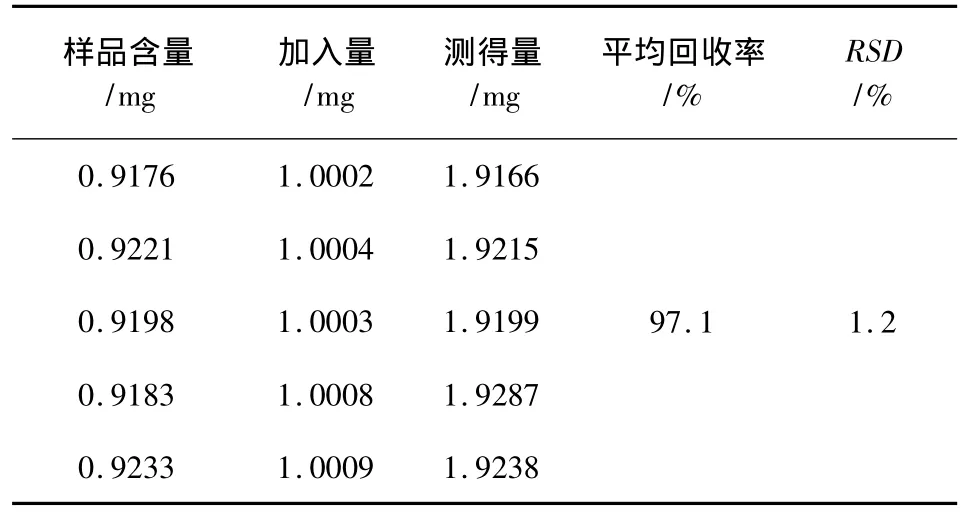
表1 加样回收率结果
2 测定结果
煎剂组(B组)和粗粉组(C组)在5个时间点都测不出连翘苷的含量,提取物组(A组)只有在1.5 h可以测到含量极低的连翘苷,连翘苷纯品组(D 组)在 0.5、1、1.5、2、4 h 的连翘苷含量分别为:0.205、0.266、0.099、0.046、0 mg/mL。其测定结果见图1-图9。
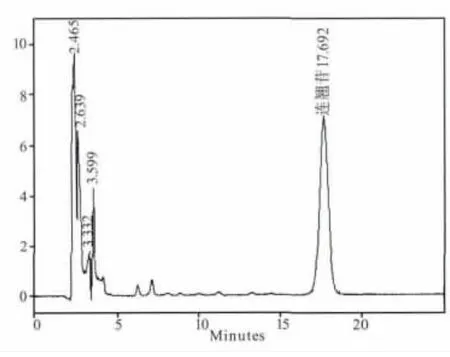
图1 标准品色谱图
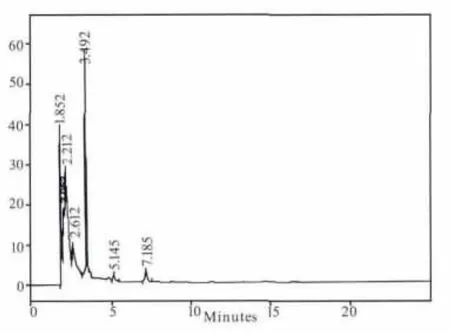
图2 空白对照组色谱图

图3 A组1.5 h样品色谱图
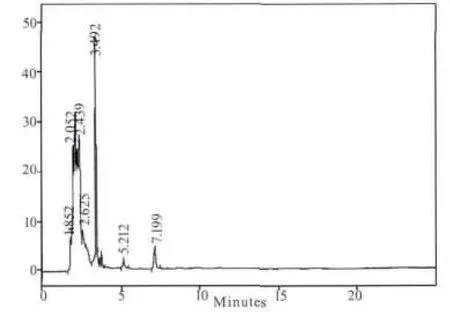
图4 B组样品色谱图
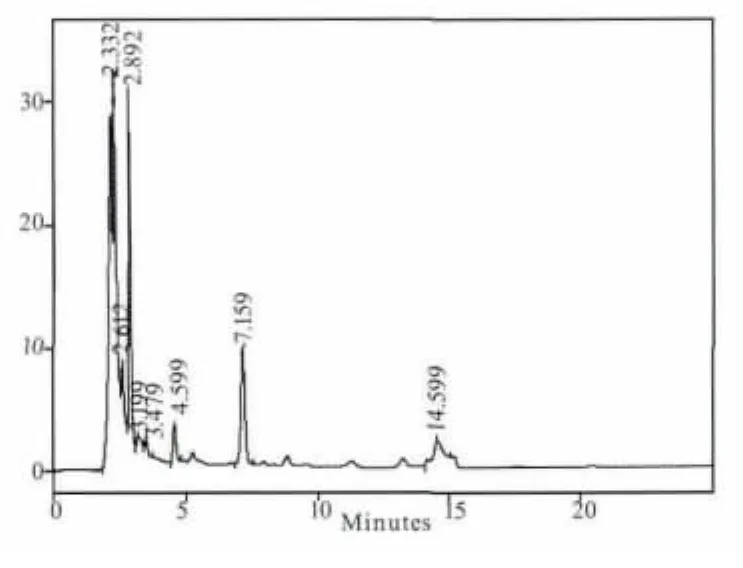
图5 C组样品色谱图
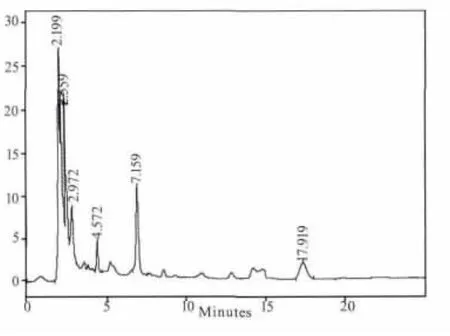
图6 D组样品0.5 h色谱图
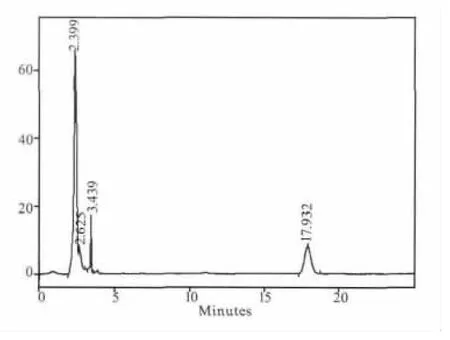
图7 D组样品1 h色谱图
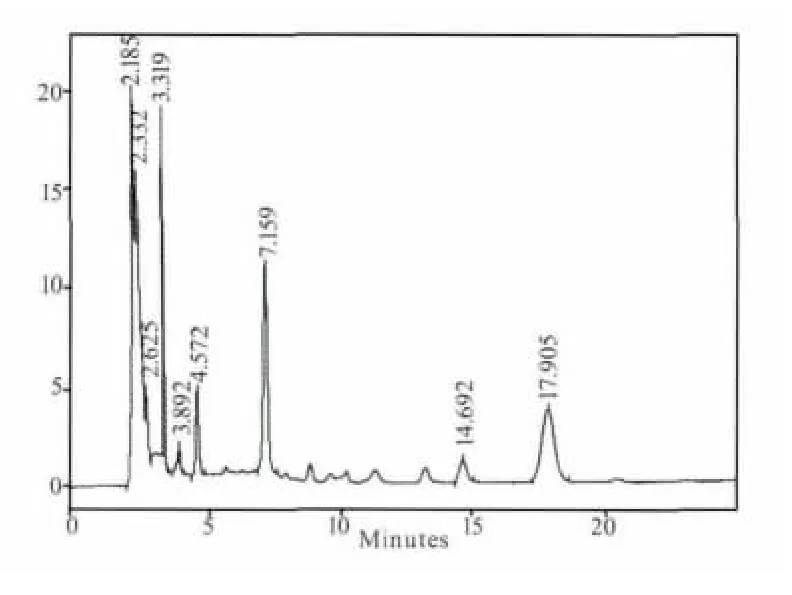
图8 D组样品1.5 h色谱图
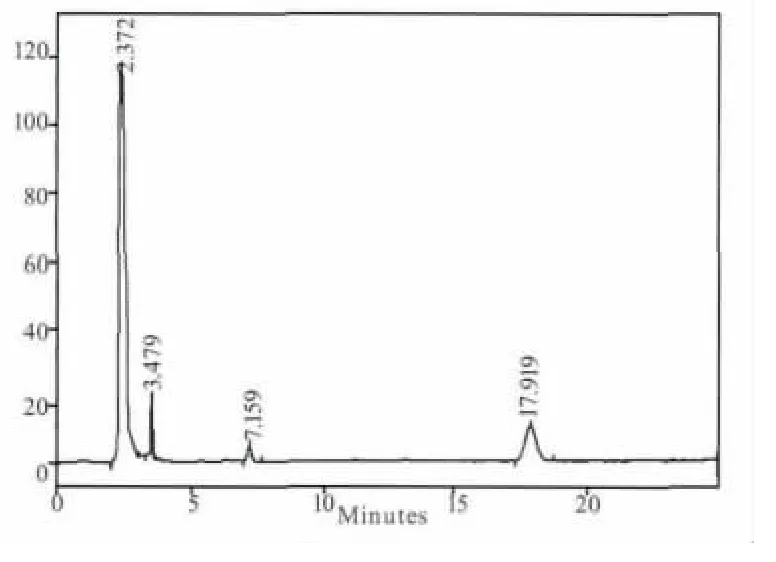
图9 D组样品2 h色谱图
3 讨论
连翘成分复杂,血清中连翘苷含量很少,选择恰当的测定方法是本试验关键。试验经过查资料和条件优化对比得到试验中的方法[9],该方法简便易行、灵敏度和准确度高,重现性好,适用于连翘苷的含量测定,也可用于中药连翘的质量控制。
连翘粗粉和煎剂中连翘苷的含量很低,再经肠胃代谢,很难在血清中测到,提取物给药所得含药血清中连翘苷含量较低,所以作为分析用的连翘苷含药血清用有效成分纯品给药效果最为理想。
针对连翘苷的含药血清制备中,采血时间也应适当控制。蒋红等发现制备银翘天甘含药血清时于最后一次给药后31 min采得的含药血清中连翘苷含量为最高[10],而本试验中30 min和1 h所测得数据基本接近.所以采血时间应在0.5~1 h以内。董新荣等研究在给药后3 h,血药浓度即降到很低,随后药物浓度下降缓慢,此时血液和组织中的药物基本上达到平衡,其药物半衰期在3 h以上[11]。这与本试验在4 h时已测不出连翘苷含量的结果相一致。另外在预试验中发现动脉血比静脉血的连翘苷含量高些。
[1]张海燕.连翘化学成分及药理活性的研究进展[J].中药材,2000,23(10):657.
[2]刘 明.中药连翘药理作用的研究近况[J].现代医药卫生,2007,23(16):2438.
[3]赵建平,张 玲,王世伟,等.连翘临床新用简介[J].山西中医,2004,20(6):53.
[4]厉世伟,司宁宁,李 龙,等.连翘有效成分对炎症模型的作用[J].中兽医药杂志,2012,31(1):16-19.
[5]崔晓兰.中药药理研究的新思路—中药血清药理学[J].中国中医药科技,1997.4(4):239.
[6]武果桃,刘红霞,任 杰,等.HPLC法测定山西道地中药连翘中连翘苷的含量[J].中兽医医药杂志,2009,28(3):49-50.
[7]国家药典委员会.中华人民共和国药典2010年版[S].
[8]张君仁,藏恒昌.体内药物分析[M].北京:化学工业出版社,2002:9.
[9]任 杰,姚敬明,武果桃,等.HPLC测定石榴皮提取物颗粒剂中不同时期鞣花酸含量的变化[J].中国兽药杂志,2012,46(2):30-32.
[10]蒋 红,王宏军,王春华,等.银翘天甘醇提物含药血清制备方法的研究[J].动物医学进展.2012,33(3):37-42.
[11]董新荣,郝圣峰,葛 铭,等.复方制剂中连翘苷的药物动力学试验[J].中国兽医杂志,2009,45(3):80-81.

