锌指E盒结合同源框2在人牙髓组织和细胞的表达*
陈丽虹 舒 珊 陈丽红 韦 曦
转化生长因子-β(trans-forming growth factor-β,TGF-β)为一种多肽类生长因子,可调节细胞的增殖、分化、凋亡、黏附和迁移,刺激成纤维细胞分裂。Smad是TGF-β家族信号传导的下游因子,介导TGF-β信号由胞质传入胞核。锌指E盒结合同源框2(zinc-finger E-box binding homeobox 2,ZEB2)属于ZEB家族,又称Smad结合蛋白1(Smad-interacting protein1,SIPl),是一类核转录因子[1]。ZEB2可结合TGF-β信号通路中的R-Smad,在TGF-β信号刺激下,ZEB2与R-Smad-Smad4复合体直接结合,调控下游靶基因的转录[2]。
在一定条件下,牙髓细胞可分化为成牙本质样细胞,形成修复性牙本质以保护牙髓牙本质复合体。TGF-β1在牙髓细胞和成牙本质细胞均可合成,牙髓受到刺激或损伤时分泌进入牙髓组织的TGF-β1能够促进牙髓细胞增殖,分泌细胞外基质,诱导牙髓细胞向成牙本质细胞分化,并已证实hDPCs的分化可由TGF-β1/Smad信号通路介导,但ZEB2在人牙髓组织和细胞中的表达以及与TGF-β1的作用关系尚不明确[3]。本实验采用FISH观察ZEB2在牙髓组织的定位和表达,RT-qPCR和FISH检测ZEB2在正常和TGF-β1刺激hDPCs中的表达,为进一步探讨ZEB2在hDPCs成牙本质向分化中的作用提供实验证据。
1.材料与方法
1.1 主要材料和设备 DMEM低糖培养基(Gibco,美国);标准胎牛血清FBS,I型胶原酶,0.25%胰蛋白酶,0.02%乙二胺四乙酸(Gibco,澳大利亚);青链霉素(Sigma,美国);培养瓶、培养孔板(Corning,美国);TGF-β1(Peprotech,美国);Trizol试剂(Invitrogen,美国);反转录cDNA合成试剂盒,SYBR Green I Master,LightCycler480荧光定量PCR仪(Roche,瑞士);4%多聚甲醛(含0.1%DEPC水)、Triton X-100、甲酰胺、无水乙醇、0.1%DEPC水、探针杂交液、DAPI染色液、荧光原位杂交探针(柏信生物有限公司),抗荧光衰减封片剂,超微量高精度分光光度计Nanodrop ND-2000(Thermo,美国),Axio observer Z1荧光倒置显微镜(Zeiss,德国),LSM710激光扫描共聚焦显微镜(Zeiss,德国)。
1.2 实验方法
1.2.1 人牙髓组织切片的制备 经患者知情同意收集中山大学附属口腔医院口腔颌面外科就诊患者中因阻生或正畸需要拔除的健康第三磨牙(患者年龄18-25岁,无系统性疾病,牙周状况良好,近两个月内未服用免疫制剂和抗生素),将新鲜收集的第三磨牙劈开后置入预冷的4%多聚甲醛溶液中,4℃固定3d,后置入10%EDTA脱钙液3-4个月,选择来源于不同患者的三个牙齿进行梯度酒精脱水,石蜡包埋,制作4μm厚的石蜡切片。
1.2.2 荧光原位杂交技术(FISH)检测ZEB2在正常牙髓组织的定位和表达 ZEB2荧光探针按以下序列合成:5‘-TGGTGAAATGAGGGCTTGCGA-3’,3’末端标记6-羧基荧光素(6-FAM)。牙髓组织石蜡切片脱蜡,梯度酒精复水,30%亚硫酸氢钠液处理20min,25mg/ml蛋白酶K孵育40min,洗涤,梯度酒精脱水,风干。探针变性,杂交缓冲液与探针混合后逐滴加入至组织切片。37℃杂交过夜。50%甲酰胺与2倍柠檬酸钠缓冲液(2XSSC)洗涤,梯度酒精脱水。DAPI染色,生理盐水洗涤,风干。抗荧光衰减封片剂封片,激光共聚焦显微镜观察。阴性对照组按以上条件处理但不加入探针。
1.2.3 人牙髓细胞的培养 收集中山大学光华口腔医学院口腔颌面外科18-25岁因正畸或阻生需要拔除的健康恒牙(患者均知情同意),消毒后沿牙颈部劈开取出牙髓,去除根尖1/3根髓后,剪成1*1mm2大小的组织块,3.3mg/mlⅠ型胶原酶37℃消化15min后离心,将组织块铺于培养瓶底,加入含20%胎牛血清的DMEM培养基,倒置于37℃、5%CO2培养箱6-8h,待组织块贴壁后翻转培养瓶。倒置显微镜下观察,待细胞生长至70%-80%汇合,0.25%胰蛋白酶(含0.02%EDTA)消化后按1:2比例传代。传代细胞置于37℃常规培养箱,2-3d换液。
1.2.4 实时荧光定量PCR 使用DMEM培养基配制含TGF-β1的细胞培养液,浓度设定为0、2.5、5、10、20ng/ml,取生长良好的hDPCs接种至6孔板(每孔细胞数为2×105),每组三孔,在含10%胎牛血清的细胞培养液中培养24h后,加入含不同浓度TGF-β1的细胞培养液继续培养24h后,细胞生长约达到六孔板的70%-80%。RT-qPCR检测ZEB2 mRNA的相对表达量,确定最大效应浓度。根据上一步确定TGF-β1的最大效应浓度为5ng/ml,实验组以5ng/ml TGF-β1 刺激培养 0h、2h、6h、12h、24h、48h、72h,对照组不加入TGF-β1,检测hDPCs中ZEB2 mRNA的相对表达量。Trizol试剂提取总RNA,超微量高精度分光光度计测量总RNA浓度。引物的设计及合成均由上海英潍捷基贸易有限公司完成,引物序列见表1。使用1μg体系反转录总RNA成为cDNA,20μl体系进行 PCR扩增。PCR扩增40个循环,包括10min预变性,95℃变性,60℃退火,72℃延伸及10min的延伸。采用2-△△Ct法进行数据分析。

表1 本实验所用的R T-P C R引物序列
1.2.5 FISH技术检测ZEB2在正常和TGF-β1刺激hDPCs的定位和表达 分别取正常和5ng/ml TGF-β1培养24h的细胞做爬片,4%多聚甲醛(含0.1%DEPC水)固定20min,蒸馏水洗,0.5%Triton X-100通透15min,PBS洗涤,酒精脱水。分别进行探针变性,杂交缓冲液与探针混合后逐滴加入至细胞爬片,37℃杂交过夜。50%甲酰胺与2倍柠檬酸钠缓冲液(2XSSC)洗涤,酒精脱水。DAPI染色,生理盐水洗涤,风干。抗荧光衰减封片剂封片,激光共聚焦显微镜观察。阴性对照组按以上条件处理但不加入探针。
1.3 统计学分析 采用统计学软件SPSS 13.0进行数据分析。先检验各样本方差齐性,若符合方差分析条件,两组间比较采用t-test,若不符合方差分析条件则使用秩和检验。使用LSD和Dunnett检验进行组间两两比较。检验水准为双侧α=0.05,p值小于0.05被认为有统计学意义。
2.结果
2.1 ZEB2在牙髓组织中ZEB2的定位和表达 如图1所示,实验组中ZEB2阳性表达主要集中于成牙本质细胞层,呈绿色荧光,牙髓细胞中表达较弱;阴性对照组未见ZEB2阳性染色细胞。
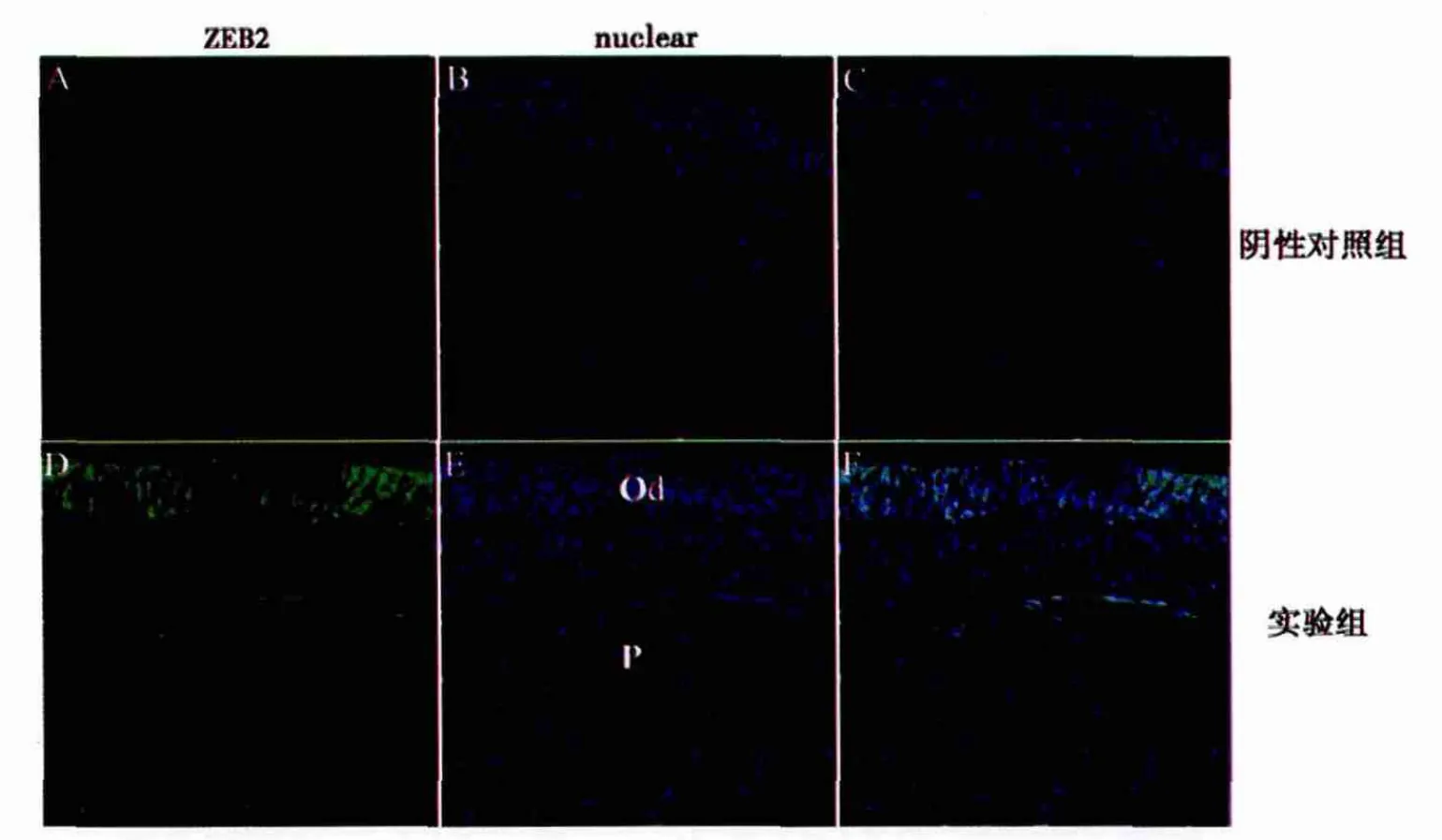
图1 ZEB2在正常人牙髓组织的FISH检测(激光共聚焦显微镜,×200)
2.2 实时荧光定量PCR检测ZEB2在不同浓度TGF-β1作用下的表达:随TGF-β1剂量增加,hDPCs中ZEB2 mRNA的表达逐渐上调,5ng/ml达最大(P< 0.05),10-20ng/ml有下降趋势,见表2。
表2 不同浓度TGF-β1培养hDPCs 24h后ZEB2m RNA的表达(×10-4)()

表2 不同浓度TGF-β1培养hDPCs 24h后ZEB2m RNA的表达(×10-4)()
注:与0ng/ml和20ng/ml对照组比较,*P<0.05
浓度(ng/ml) 样本量 ZEB2031.00±0.002.5 3 1.21±0.10532.14±0.09*10 3 1.98±0.1220 3 1.82±0.09
2.3 实时荧光定量PCR结果显示 5ng/ml TGF-β1刺激hDPCs 0-72h,与相同时间点对照组比较,ZEB2 mRNA表达均有上调(P<0.05);实验组中随时间增加,ZEB2 mRNA相对表达量逐渐上升,24h达峰值(P<0.05),随后表达有所降低,结果见表3。
表3 5ng/ml TGF-1刺激h DPCs后ZEB2m RNA的表达(×10-4)()
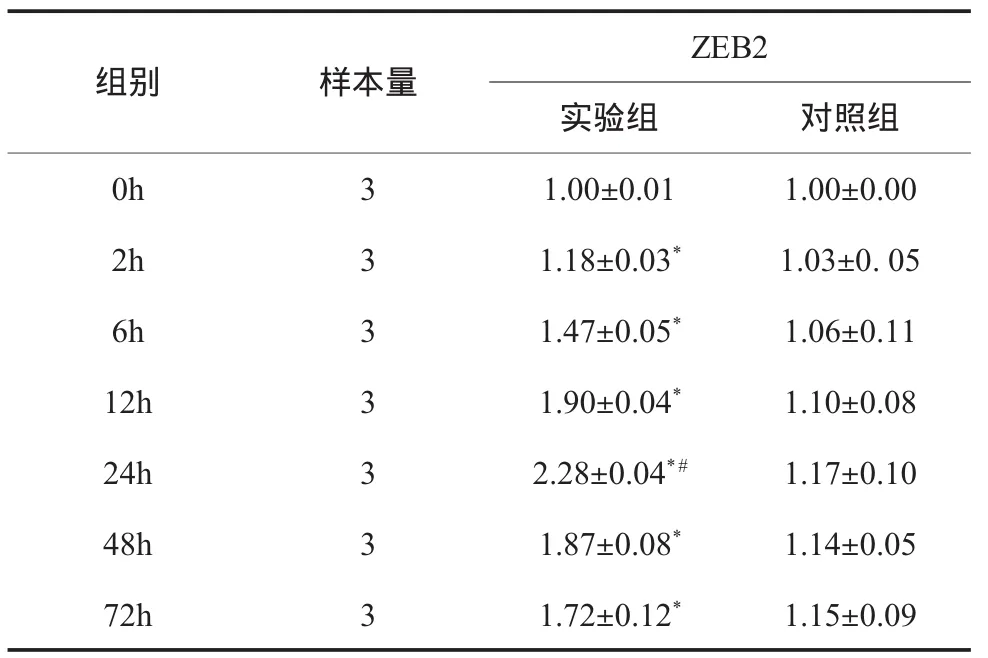
表3 5ng/ml TGF-1刺激h DPCs后ZEB2m RNA的表达(×10-4)()
注:与同时间点对照组比较,*P<0.05;与0h、72h实验组比较,#P<0.05
组别 样本量ZEB2实验组 对照组0h 3 1.00±0.01 1.00±0.002h 3 1.18±0.03* 1.03±0.056h 3 1.47±0.05* 1.06±0.1112h 3 1.90±0.04* 1.10±0.0824h 3 2.28±0.04*# 1.17±0.1048h 3 1.87±0.08* 1.14±0.0572h 3 1.72±0.12* 1.15±0.09
2.4 ZEB2在hDPCs中的定位和表达 如图2所示,正常hDPCs的胞质和胞核内均可见较浅的绿色荧光,ZEB2在正常hDPCs中呈弱阳性表达,TGF-β1培养24h后,hDPCs中绿色荧光染色变强,胞核表达更为明显,阴性对照组未见绿色荧光表达。

图2 ZEB2在hDPCs的FISH检测(激光共聚焦显微镜,×200)
3.讨论
ZEB2/SIP1是ZEB转录因子家族的重要成员,该基因序列由一个可变区域将两个相互独立且高度保守的锌指结构簇连接构成,ZEB2的锌指结构具有特异DNA结合活性,而可变区域中的Smad结合区域能与Smad基因的功能结构域-MH2结构域(Mad homology 2 domain),结合并相互作用,参与TGF-β/Smad信号转导,影响细胞增殖、分化和凋亡等生物过程[4,5]。ZEB2在人外胚层来源器官包括脑、脊髓、眼、皮肤、心、肝、肺和牙胚等均有表达,Verschueren等[6]研究发现 ZEB2可与 Smad1、Smad2、Smad3及Smad5结合并相互作用,在Smad介导的TGF-β信号转导通路中发挥一定作用。Lucchini等[6]通过免疫组化检测到人牙髓细胞中Smad2,Smad3和Smad4蛋白的表达,Smad蛋白是TGF-β受体作用的直接底物,TGF-β信号与细胞表面受体TGF-βRI和TGF-βRII结合,形成三聚体,激活R-Smad(Smad2和Smad3磷酸化)将信号传导至胞质,R-Smad与Co-Smad(Smad4)结合后,继而转移至胞核内与靶基因结合调节相关蛋白合成,使细胞表型和功能发生改变。TGF-β/Smad信号传导通路中任一环节改变均可导致信号传导异常,影响TGF-β的细胞生物学效应。
牙髓细胞是含有成牙本质细胞系干细胞的特异细胞群,有一定的增殖和分化能力,较牙髓干细胞易于获得,可作为牙髓干细胞的细胞代型进行研究[7],但牙髓细胞的分化能力有限,因此提高牙髓细胞的成牙本质分化能力对促进受损牙髓的修复具有积极意义。TGF-β是诱导成牙本质细胞分化和第三期牙本质形成的主要信号分子,牙本质基质中存在TGF-β,成牙本质细胞受到刺激或损伤时,可导致牙本质基质中的TGF-β释放并作用于成牙本质细胞,促进第三期牙本质的形成[8,9]。TGF-β有三种异构体,TGF-β1、TGF-β2和TGF-β3,研究发现牙髓细胞主要表达TGF-β1,TGF-β1在牙髓损伤后可反应性增加,诱导牙髓细胞的成牙本质向分化[10]。Kalyva等[11]发现富含TGF-β1的生物材料促进修复性牙本质的形成,表明TGF-β1与成牙本质细胞分化及牙本质基质分泌的调节密切相关。Li等[12]研究显示TGF-β1能诱导细胞极化和基质沉积,致使成牙本质样细胞的分化和牙本质的形成。
本实验利用FISH检测发现牙髓组织中ZEB2主要表达于成牙本质细胞,而牙髓细胞中的表达呈较弱;FISH检测发现ZEB2在正常hDPCs胞质和胞核内呈弱阳性表达,提示hDPCs中存在ZEB2的表达,ZEB2可能与hDPCs的成牙本质向分化相关。Berx等[13]研究发现肿瘤细胞中,ZEB在肿瘤早期通过抑制抑癌基因,促使细胞增殖;肿瘤后期ZEB影响细胞的极性并诱导其分化。RT-qPCR检测ZEB2在不同浓度TGF-β1作用下hDPCs中的表达,结果发现在0-5ng/ml范围内ZEB2 mRNA的表达随浓度增大而逐渐上调,5ng/ml达最大,10-20ng/ml有下降趋势,说明5ng/ml是最大作用浓度,以5ng/ml TGF-β1刺激hDPCs 0-72h,与培养相同时间点对照组比较,ZEB2 mRNA表达均有上调;实验组ZEB2 mRNA在TGF-β1刺激0-24h过程中表达逐渐上调,24h达到高峰,后随时间延长表达有所降低,提示TGF-β1促进hDPCs中ZEB2的表达,TGF-β1刺激下hDPCs中ZEB2 mRNA的表达可能与TGF-β1受体、TGF-β1的细胞毒性以及其他基因和通路的相互影响有关。Shiba等[14]报道TGF-β1的作用效应不仅与其浓度、作用时相有关,而且与细胞类型、生长状态也有关系,TGF-β1与细胞膜上相应的受体数量有关,当TGF-β1与其相应受体结合达到饱和后,即使再增加浓度也不能增强其作用;另外,也可能与不同细胞不同生长状态分泌生长因子的效能有关,随细胞的生长和增殖加快,细胞密度增大,细胞的分泌作用增强,外源性生长因子的作用反而不显著。TGF-β1信号的传导受到机体严密的调控,并与其他基因或信号通路存在交叉作用。Gregory等[15]研究发现在侵袭性乳腺导管癌中,ZEB、TGF-β与miR-200三者间可形成反馈环路,ZEB与TGF-β 的表达呈正相关,ZEB、TGF-β 与miR-200的表达呈负相关,促进肿瘤的侵袭及转移。Burk等[16]发现ZEB能负性调节miR-141和miR-200c的表达,miR-141通过抑制TGF-β下调ZEB的表达,miR-200抑制ZEB转录因子活性,TGF-β能通过下调miR-200家族成员诱导ZEB蛋白的表达。本实验TGF-β1促进ZEB2表达,这与Gregory、Burk等的研究结果相符。FISH检测观察到ZEB2在5ng/ml TGF-β1刺激24h后的hDPCs中表达变强,且胞核表达更为明显,提示TGF-β1刺激可能引起ZEB2由胞质转位至细胞核,目前对于ZEB2在细胞中定位的研究尚不明确,已有研究表明转录因子在胞核胞质的转位可作为一项重要的细胞调节机制[17]。以上研究提示ZEB2可能参与TGF-β1信号途径调控牙髓细胞的成牙本质向分化过程。
综上,本研究发现ZEB2在牙髓组织中主要表达于成牙本质细胞,TGF-β1刺激hDPCs后,ZEB2的表达上调且由胞质向胞核转位,提示ZEB2可能参与TGF-β1在成牙本质向分化的调控作用,为阐明TGF-β1/Smad信号传导机理提供新线索,但其在细胞中的作用机制需进一步探索。
[1]Nelles L,Van de Putte T,van Grunsven L,et al.Organization of the mouse Zfhx1b gene encoding the two-handed zinc finger repressor Smad-interacting protein-1[J].Genomics,2003,82(4):460-469
[2]Cunnington R H,Northcott J M,Ghavami S,et al.The Ski-Zeb2-Meox2 pathway provides a novel mechanism for regulation of the cardiac myofibroblast phenotype[J].J Cell Sci,2014,127(Pt 1):40-49
[3]Smith A J.Vitality of the dentin-pulp complex in health and disease:growth factors as key mediators[J].J Dent Educ,2003,67(6):678-689
[4]Katoh M,Katoh M.Integrative genomic analyses of ZEB2:Transcriptional regulation of ZEB2 based on SMADs,ETS1,HIF1alpha,POU/OCT,and NF-kappaB[J].Int J Oncol,2009,34(6):1737-1342
[5]Verschueren K,Remacle J E,Collart C,et al.SIP1,a novel zinc finger/homeodomain repressor,interacts with Smad proteins and binds to 5'-CACCT sequences in candidate target genes[J].J Biol Chem,1999,274(29):20489-20498
[6]Lucchini M,Romeas A,Couble M L,et al.TGF beta 1 signaling and stimulation of osteoadherin in human odontoblasts in vitro[J].Connect Tissue Res,2002,43(2-3):345-353
[7]Wei X,Ling J,Wu L,et al.Expression of mineralization markers in dental pulp cells[J].J Endod,2007,33(6):703-708
[8]Cassidy N,Fahey M,Prime S S,et al.Comparative analysis of transforming growth factor-beta isoforms 1-3 in human and rabbit dentine matrices[J].Arch Oral Biol,1997,42(3):219-223
[9]高 杰,吴补领,何文喜,等.TGF-β1/Smad3信号途径对牙本质涎磷蛋白基因表达的调控[J].中华老年口腔医学杂志,2008,6(3):155-158
[10]Laurent P,Camps J,About I.BiodentineTM induces TGF-beta1 release from human pulp cells and early dental pulp mineralization[J].International endodontic journal,2012,45(5):439-448
[11]Kalyva M,Papadimitriou S,Tziafas D.Transdentinal stimulation of tertiary dentine formation and intratubular mineralization by growth factors[J].Int Endod J,2010,43(5):382-392
[12]Li Y,Lu X,Sun X,et al.Odontoblast-like cell differentiation and dentin formation induced with TGF-beta1[J].Arch Oral Biol,2011,56(11):1221-1229
[13]Berx G,van Roy F.Involvement of members of the cadherin superfamily in cancer[J].Cold Spring Harb Perspect Biol,2009,1(6):a3129
[14]Shiba H,Fujita T,Doi N,et al.Differential effects of various growth factors and cytokines on the syntheses of DNA,type I collagen,laminin,fibronectin,osteonectin/secreted protein,acidic and rich in cysteine(SPARC),and alkaline phosphatase by human pulp cells in culture[J].J Cell Physiol,1998,174(2):194-205
[15]Gregory P A,Bracken C P,Smith E,et al.An autocrine TGF-beta/ZEB/miR-200 signaling network regulates establishmentand maintenance ofepithelial-mesenchymal transition[J].Mol Biol Cell,2011,22(10):1686-1698
[16]Burk U,Schubert J,Wellner U,et al.A reciprocal repression between ZEB1 and members of the miR-200 family promotes EMT and invasion in cancer cells[J].EMBO Rep,2008,9(6):582-589
[17]Oztas E,Avci M E,Ozcan A,et al.Novel monoclonal antibodies detect Smad-interacting protein 1(SIP1)in the cytoplasm of human cells from multiple tumor tissue arrays[J].Exp Mol Pathol,2010,89(2):182-189

