nHAC/CSH复合犬外周血基质细胞修复种植体周围骨缺损的组织学观察
韩 雪 刘洪臣 王东胜 鄂玲玲 吴 霞 周 威
种植牙修复缺失牙不仅恢复了咀嚼功能,美观效果也可与真牙媲美,已经成为口腔医学界和缺牙患者的首选。拔牙后即刻种植的优点有:(1)缩短了修复时间;(2)即刻种植修复极大限度保留了骨组织和软组织外形;(3)可获得理想的植入位置和角度,使龈乳头外形大小达到更理想的美学效果。然而,由于拔牙窝形态不规则,种植体与牙槽骨之间存在的空隙影响种植体的初期稳定性。有研究表明,如果空隙大于1mm,种植体-骨的结合率就会明显减小[1]。近年来,组织工程骨为骨缺损的修复治疗另辟蹊径。由于拔牙窝形态的不规整性,利用可注射组织工程骨能极大满足即刻种植体周围不规则的骨缺损。以往的研究表明,纳米羟基磷灰石/胶原/硫酸钙复合材料(nHAC/CSH)与天然骨的组成和空间结构极其相似,具有良好的生物相容性和生物活性[2]。外周血基质细胞(Peripheral blood-acquired mesenchymal progenitorcells,BMPC)易于获得,与骨髓基质细胞在表征上有许多共同点,同样具有高度自我更新和多向分化的能力[3]。本实验即以nHAC/CSH作为犬BMPC的支架载体,将nHAC/CSH-dBMPC复合物注射到犬即刻种植体周围,观察体内成骨能力,探讨可注射组织工程骨修复即刻种植体周围骨缺损的可行性。
1.材料和方法
1.1 主要试剂和设备 L-DMEM培养基、胎牛血清(Gibco公司,美国),β-甘油磷酸钠、地塞米松、抗坏血酸(Sigma公司,美国),淋巴细胞分离液(天津灏洋生物制品有限公司),胰酶(Amresco公司,美国),纳米羟基磷灰石/胶原/硫酸钙(北京奥精生物科技有限公司),Ti2448合金(中科院金属研究所提供)。
超净工作台(北京昌平净化设备厂),CO2恒温孵箱(Thermo Forma公司,美国),倒置相差显微镜(Leica公司,德国),E300CP硬组织切片机(Exakt,德国),SUNITM种植机(Satelec,法国)。
1.2 实验动物 成年雄性杂种犬4只,体重约15kg(由解放军军医进修学院医学实验动物中心提供并饲养)。
1.3 方法
1.3.1 犬BMPC的获取和培养[4]健康成年犬,肝素化注射器穿刺入前臂静脉抽血,约15-20mL,用等量L-DMEM培养基稀释,缓慢加入淋巴细胞分离液表面,离心20min收集中间云雾状的单个核细胞带,清洗3次,以5×106/mL密度接种于6孔板,培养液为含10%FBS的L-DMEM,置37℃、5%CO2孵箱培养,每隔3天进行换液。原代培养至贴壁细胞生长近融合后,胰蛋白酶消化,按1:2比例进行接种,置于培养箱中继续培养,次日更换培养基一次,倒置显微镜下观察细胞的生长增殖情况以及形态变化。
1.3.2 犬BMPC的成骨诱导分化 取第3代细胞,加入含10-8mol/L地塞米松,10mmol/L β-甘油磷酸钠,50μg/mL抗坏血酸的成骨诱导液。培养14天后,进行免疫细胞化学染色观察I型胶原表达情况;培养28d,茜素红染色观察钙结节形成情况。
1.3.3 nHAC/CSH-dBMPC可注射骨的制备 dBMPC成骨诱导2周后,调整细胞浓度达2×106/mL,取0.8ml细胞悬液,与1g nHAC/CSH均匀混合,形成糊状复合物。
1.3.4 植入试验 全麻消毒铺巾后,拔除犬双侧下颌第二、三、四前磨牙,并在拔牙创远中制备4mm×5mm×6mm箱状骨缺损,植入圆柱形种植体(直径3.0mm、高10.0mm),种植体骨缺损区进行不同处理,空白对照组(control组):不植入任何材料;单纯材料组(nHAC/CSH组):植入nHAC/CSH;可注射骨组(nHAC/CSH-dBMPC组):植入nHAC/CSH-dBMPC可注射骨。植入后覆盖Bio-guid膜,严密缝合创口。术后3d每日肌注青霉素160万U,流食2d,软食2周,口内缝线任其自行脱落。
1.3.5 取材与观察 术后12周处死动物取材,固定,甲基丙烯酸甲酯包埋,用E300CP型硬组织切片机及特制夹具,沿种植体长轴切开,将带种植体的骨组织修切成组织块,手工制作20μm厚的磨片[5],经亚甲基蓝染色后光学显微镜下观察种植体周围骨缺损区的骨愈合情况。
2.结果
2.1 dBMPC向成骨细胞诱导 成骨诱导培养14d,I型胶原免疫细胞化学染色阳性,胞浆内出现棕黄色的颗粒,胞核不着色(图1)。培养28d左右茜素红染色呈红色斑块,为钙盐特征性染色(图 2)。

图1 成骨诱导14d,犬BMPC I型胶原阳性表达(×100)
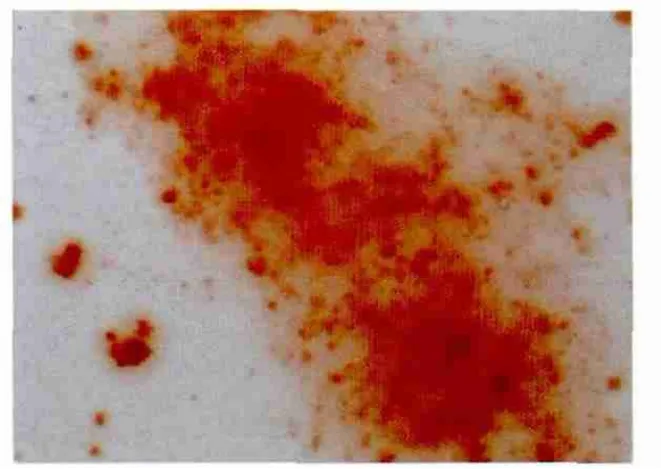
图2 成骨诱导28d,犬BMPC形成的钙结节(×100)
2.2 大体观察 实验犬均存活至取材,伤口愈合良好,种植体无脱落,周围无红肿和免疫排斥反应。
2.3 组织学观察 术后12周,空白组种植体周围骨缺损区已见新生骨小梁形成,种植体周围仅为少量直接接触的编织骨,骨小梁细小(图3A),骨结合率为18.271±2.15%;nHAC/CSH组种植体周围直接接触的骨组织较多,可见骨小梁较空白组粗大(图 3B),骨结合率为 33.131±7.29%;nHAC/CSH-dBMPC组种植体界面可见大量直接接触的骨组织,界面密合,无纤维组织和空隙存在,皮质骨处可见哈佛氏系统生成,骨结合率为65.031±3.13%(图3C)。三组之间骨结合率有显著性差异(图 4)。
3.讨论
近年来,随着干细胞研究的重大进展及应用材料的完善和发展,利用骨组织工程方法构建良好骨替代物己成为极具临床应用前景的研究热点。种子细胞的获取、培养和支架材料的选择,是组织工程骨研究的关键性环节。CD14+成纤维细胞可以从人外周血单核细胞原代培养出来,和骨髓间充质基质细胞在表征上有许多共同点,同样具有高度自我更新和多向分化的能力[6]。本实验利用密度梯度离心法并结合贴壁分离筛选法来分离纯化犬外周血基质细胞。
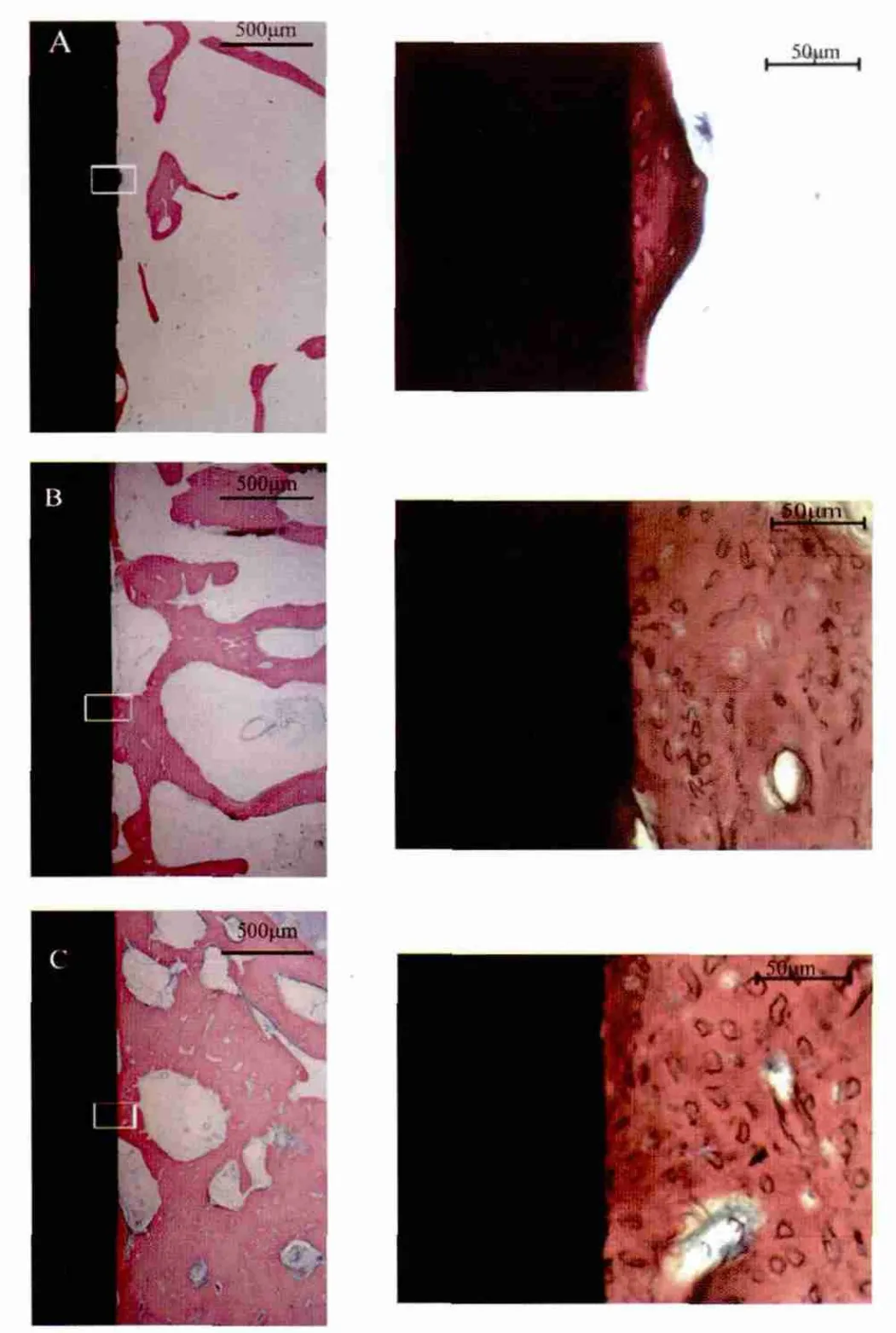
图3 术后12周的亚甲基蓝染色结果
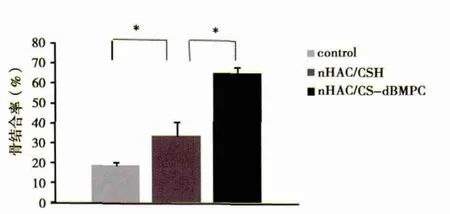
图4 三组骨结合率(*P<0.05%)
本实验培养的犬BMPC经成骨诱导后能使钙离子以钙盐的方式在细胞外面沉积下来,形成钙结节,茜素红和钙发生显色反应,钙结节也就被染成了深红色,茜素红染色阳性,同时I型胶原免疫细胞化学染色阳性,证明该细胞具有向成骨分化的能力,可作为可注射组织工程骨的种子细胞。
理想的骨修复材料是应具有可降解性、可以被宿主的新骨完全替代[7]。随着微创外科理论和技术的成熟,支架材料的研究热点集中于可注射材料的发展。可注射组织工程生物材料除了要求具有一般生物材料的特性:良好的生物相容性及组织相容性,具有生物可降解性,无毒、无不良反应,来源充足,性质稳定,易贮存等特点以外,还必须具有以下特征:(1)一定的流动性;(2)可靠的成骨效应;(3)工艺简单[8]。
硫酸钙是一种无机化合物,属多功能硬性胶凝材料。硫酸钙用作骨缺损填充修复材料已经达百年之久,其具有良好的生物相容性,已得到众多实验的证实[9-11]。硫酸钙根据其结合水分子量的多少,可分为二水硫酸钙、半水硫酸钙和无水硫酸钙三种形式,其中,因半水硫酸钙具有更好的强度及降解性能,常被作为骨移植替代材料。由α结晶技术改造的手术级半水硫酸钙颗粒,无毒,异物反应小,骨膜存在下有成骨效应,可生物降解。同时具有良好的微孔性,可加载干细胞、成骨细胞、生物因子或化疗药物,并能有效地阻止软组织向缺损部位生长[12]。
基于仿生学原理的纳米羟基磷灰石胶原(Nano-sized hydroxyapatite/collagen,n-HAC)由于晶体尺度与天然骨接近,是与天然骨的成分和空间结构极其相似的矿化纤维,具有降解与新骨生长匹配,接近自体骨框架,可供成骨细胞贴附生长增殖等优点,已有大量的研究证明其具有良好的生物活性和生物相容性。为了避免单用一种材料的缺陷,提高硫酸钙的骨再生性能,清华大学材料科学与工程系将两种具有互补特征的可降解材料按一定方式组合,变成可注射性的骨水泥,凝固时间适当,约20min,可用于骨再生的应用[2]。和纯硫酸钙相比,添加nHAC能使复合材料的凝固时间延长,显著提高其可注射性能;更重要的是,nHAC/CSH在模拟体液浸泡后可以诱导产生类骨磷灰石,说明添加nHAC显著改善了复合材料的生物活性。Liu[2]将该材料植入兔皮下及下颌骨临界性缺损处进行皮内反应实验和骨缺损修复实验,未见红斑及水肿,nHAC/CSH使兔下颌骨缺损区完全长平。
本实验将nHAC/CSH作为犬BMPC的支架载体,将nHAC/CSH-dBMPC复合物注射到犬即刻种植体周围,组织学观察显示:空白组种植体周围骨缺损区已见新生骨小梁形成,种植体周围仅为少量直接接触的编织骨,骨小梁细小;nHAC/CSH组种植体周围直接接触的骨组织较多,可见骨小梁较空白组粗大;nHAC/CSH-dBMPC组种植体界面可见新生骨组织。统计学分析后发现nHAC/CSH-dBMPC、nHAC/CSH和空白组的BIC存在显著性差异。
本实验的研究结果证明了以dBMPC为种子细胞,nHAC/CSH为支架材料构建的组织工程化骨本身具有成骨活性,可在种植体周围形成新骨,使种植体与组织工程化骨之间形成骨性结合界面。其原因在于nHAC/CSH材料在体内局部pH值降低,导致周围骨质脱矿缺损,从而导致BMP-2的释放,刺激骨质生成[13];nHAC能聚集更多蛋白质,诱导细胞粘附和增殖[14,15],为细胞成分的生长、细胞外基质的分泌、血管成分的长入提供了理想的条件。还可能与dBMPC具有向血管内皮细胞分化的特性,在体内种植体周围成骨细胞和成骨前体细胞分泌的多种细胞因子的作用下,dBMPC向血管内皮细胞分化,促进血运重建,为组织工程血管化提供条件。
综上所述,在本实验中,我们通过将nHAC/CSH-dBMPC复合体成功用于修复犬下颌骨即刻种植体周围骨缺损,初步评估了这种新型的可注射骨组织工程复合体在骨缺损修复治疗中的潜在价值,为骨组织工程复合体的构建以及应用开辟了一条新的途径。
[1]Akimoto K,Becker W,Persson R,et al.Evaluation of titanium implants placed into simulated extraction sockets:a study in dogs[J].The International journal of oral&maxillofacial implants,1999,14(3):351-360
[2]Liu HY,Liu X,Zhang LP,et al.Improvement on the performance of bone regeneration of calcium sulfate hemihydrate by adding mineralized collagen[J].Tissue engineering Part A,2010,16(6):2075-2084
[3]韩 雪,刘洪臣.外周血多潜能间充质基质细胞在骨组织工程中的应用进展[J].国际口腔医学杂志,2011,38(1):71-74
[4]韩 雪,刘洪臣,王东胜,等.犬外周血基质细胞的分离培养及其横向分化潜能研究[J].中华老年口腔医学杂志,2010,8(3):133-136
[5]王东胜,路正刚.种植体骨界面组织形态学研究方法探讨[J].中华老年口腔医学杂志,2005,3(3):142-144
[6]Seta N,Kuwana M.Derivation of multipotent progenitors from human circulating CD14+monocytes[J].Experimental hematology,2010,38(7):557-563
[7]Yoshikawa H,Myoui A.Bone tissue engineering with porous hydroxyapatite ceramics[J].J Artif Organs,2005,8(3):131-136
[8]黄若昆,林月秋.可注射性骨组织工程载体研究进展[J].中国矫形外科杂志,2007,19(9):681-683
[9]Sidqui M,Collin P,Vitte C,et al.Osteoblast adherence and resorption activity of isolated osteoclasts on calcium sulphate hemihydrate[J].Biomaterials,1995,16(17):1327-1332
[10]Nilsson M,Wang JS,Wielanek L,et al.Biodegradation and biocompatability of a calcium sulphate-hydroxyapatite bone substitute[J].The Journal of bone and joint surgery British volume,2004,86(1):120-125
[11]Winn SR,Hollinger JO.An osteogenic cell culture system to evaluate the cytocompatibility of Osteoset,a calcium sulfate bone void filler[J].Biomaterials,2000,21(23):2413-2425
[12]钮心刚,严力生,张红梅,等.可注射硫酸钙/羟基磷灰石复合物作为经皮椎体成形术填充物的实验研究[J].生物骨科材料与临床研究,2010,7(1):1-7
[13]Walsh WR,Morberg P,Yu Y,et al.Response of a calcium sulfate bone graft substitute in a confined cancellous defect[J].Clinical orthopaedics and related research,2003(406):228-236
[14]Li X,Gao H,Uo M,et al.Effect of carbon nanotubes on cellular functions in vitro[J].Journal of biomedical materials research Part A,2009,91(1):132-139
[15]Li X,van Blitterswijk CA,Feng Q,et al.The effect of calcium phosphate microstructure on bone-related cells in vitro[J].Biomaterials,2008,29(23):3306-3316

